背景色对红螯螯虾生长、存活、体色及栖息行为的影响
2020-11-06顾志峰石耀华黄智伟廖秀睿李娇妮刘春胜王爱民
魏 淼, 顾志峰, 2, 潘 志, 石耀华, 黄智伟, 郑 兴, 廖秀睿, 李娇妮, 刘春胜, 王爱民, 2
背景色对红螯螯虾生长、存活、体色及栖息行为的影响
魏 淼1, 顾志峰1, 2, 潘 志3, 石耀华1, 黄智伟1, 郑 兴1, 廖秀睿1, 李娇妮1, 刘春胜1, 王爱民1, 2
(1. 海南大学 海洋学院, 海南 海口 507228; 2. 南海海洋资源利用国家重点实验室, 海南 海口 507228; 3. 北京水产技术推广站海南育种中心, 海南 文昌 571323)
本研究通过设置5种不同背景色(白色、红色、绿色、蓝色、黑色), 以探究背景色差异对红螯螯虾()生长、存活、体色及栖息行为的影响。结果表明养殖56 d后黑色背景色组红螯螯虾体重增长量、特定生长率和成活率最高, 分别为32.66 g、1.74%和76.4%, 其次为绿色、蓝色和红色背景色组, 白色组最差(<0.05); 黑色和红色背景色红螯螯虾饵料系数最小(3.73~3.80); 黑色背景色条件下红螯螯虾体色偏蓝, ImageJ分析表明, 黑色背景色组虾壳RGB值中R和G值显著低于其他各组, 黑色背景色虾壳虾青素含20.23 mg/kg, 亦显著低于其他各组(69.34~82.15 mg/kg)(<0.05); 黑色背景色条件下红螯螯虾分布于遮蔽物外的几率显著高于其他各组(<0.05)。综上所述, 背景色能够影响红螯螯虾生长存活、体色及行为分布, 养殖中采用黑色作为背景色能够显著提高红螯螯虾生长存活, 改善虾体颜色。
红螯螯虾(); 背景色; 生长; 体色; 行为分布
红螯螯虾()俗称澳洲淡水蓝龙虾, 隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacean)、十足目(Decapoda)、拟螯虾科(Parastacidae), 具有个体大、生长速度快、含肉率高等优势, 深受广大养殖和消费者喜爱[1]。目前已经在澳大利亚、新西兰、马来西亚、泰国、阿根廷、美国等多个国家开展规模化养殖[2-4]。在国内, 湖北水产研究所于1992年首次引进该品种, 目前已在广东、海南、福建等23个省、市、自治区开展了养殖, 并且在海南和广东部分地区已经初步形成自然种群[5-6]。
在水产动物养殖过程中, 为其提供适宜栖息环境, 以减少应激反应, 对提高养殖成活率、增加养殖效益具有重要意义[7]。背景色是影响水产动物生理、生态及行为的重要环境因子之一, 研究表明背景色对生物的生长、存活、摄食、运动、代谢、繁殖等均有重要影响。例如, Tamazouzt[8]等通过研究光强和背景色对鲈鱼生长和存活影响, 表明浅色背景有利于鲈鱼生长和存活; Papoutsoglou[9]等研究表明不同背景色对鲤鱼的生长率、饲料转化率等生长性能具有重要影响。不同种类生物对养殖背景色偏好程度各不相同, 幼年的锯缘青蟹()[10]和乌贼()[11]喜欢生活在背景色为黑色的环境中, 红鲷()[12]和大口鲶()[13]则喜欢红色, 亚马逊对虾()[7]和鞭藻虾()[14]喜欢黑色等深色环境。此外, 背景色对生物体色也具有一定影响, 动物体色会随着环境颜色改变而改变[15, 16]。如长时间处于黑色或者白色背景下养殖斑节对虾体色会发生明显差异[17]。因此, 在水产动物养殖过程中可通过改变背景色达到促进生长和改善体色的目的。
迄今, 尚未有关于背景色与红螯螯虾生长及体色相关性研究。本实验拟通过设置5种不同养殖背景色, 探究其对红螯螯虾生长、存活、体色变化及栖息行为的影响, 探索其最适的环境背景色, 以期为红螯螯虾的健康养殖和体色调控提供参考。
1 材料与方法
1.1 实验材料
红螯螯虾来自于北京水产技术推广站海南育种中心, 选择活力好、肢体完整、体表无明显伤痕、规格一致的红螯螯虾幼虾(体质量为19.74±1.3 g)进行试验。
1.2 实验方法
1.2.1 实验分组与背景色设置
实验设置白色、红色、绿色、蓝色、黑色5种不同背景色, 每组3个平行。背景色的设置采用不同颜色的防水广告纸粘贴于玻璃缸内侧, 实验前用高锰酸钾进行消毒处理。将315尾相同规格的红螯螯虾随机分成15组, 分别放置于5种不同背景色组养殖缸(120 cm×50 cm×60 cm)中, 每一背景色组3个养殖缸。为保证养殖期间水质优良, 每个养殖缸设有1套独立循环过滤器, 同时每个养殖缸中投放21个PVC管(12 cm×5 cm)作为遮蔽物。实验期间由LED白色灯光提供光照, 光强为400 Lx, 光周期为12 h︰12 h。养殖水温(25±1)℃, pH7.8, 溶解氧>6 mg/L, 其他水质指标维持在红螯螯虾适合养殖范围内。每天晚7点投喂南美白对虾配合饲料, 投喂2 h后收集残饵并称量, 并根据吸水比例进行换算获得实际残饵量, 每天换水1次, 每次换水1/3, 实验持续56 d。
1.2.2 红螯螯虾生长性状测定
分别在实验开始和结束时测量各组红螯螯虾体质量, 称量前用吸水纸擦除虾体表面水分。实验期间, 每天换水前将死亡个体捞出, 并记录。各组红螯螯虾体质量增长量、特定生长率、存活率及饵料系数计算公式如下:
体质量增长量增=末–初
特定生长率GR=[(ln末–ln初)/] ×100%
其中末为养殖56 d后体质量;初为养殖初期体质量;为实验天数。
存活率=(存活数/初始放养虾数) ×100%;
摄食量:摄食=虾喂–虾剩×空喂/空剩
其中,虾喂为有虾组初始投喂饵料质量;虾剩为有虾组摄食后剩余饵料质量;空喂为无虾组初始投饵质量;空剩为无虾组吸水后饵料质量
饵料转化率 = 摄食量/体质量增长量
1.2.3 红螯螯虾行为观察
分布的测定采用在光照期间持续录像后对6个不同时间点(9: 00、11: 00、13: 00、15: 00、17: 00、19: 00)红螯螯虾分布情况进行统计分析, 并计算红螯螯虾遮蔽物外分布几率, 计算公式为:
遮蔽物外分布几率=(遮蔽物外虾数/环境总虾数) ×100%
1.2.4 体色与虾青素含量测量
实验结束后在相同条件下对各实验组每尾红螯螯虾进行拍照, 照片采用ImageJ软件进行图像处理, 并采用RGB(3原色)颜色分析模型进行比较分析不同背景色下红螯螯虾体色差异, 比较不同背景色虾壳体色差异。拍照采用自制拍照系统其相关参数为: 光强为500 Lx, 感光度ISO 200, 曝光时间S 1/125, 光圈f/1.8。
虾青素含量采用高效液相色谱法进行测定, 先将鲜虾壳用5%盐酸除钙离子, 烘干后用无水乙醇提取, 再将提取液与硫酸铵水溶液混合, 进行双水相萃取虾青素。具体方法参照Shuai等[18]高效液相色谱法测定虾青素含量方法。
1.3 数据统计与分析
各试验数据均以平均值±标准差表示。所有数据采用Excel和SPSS18.0软件进行处理。各处理组间显著性分析采用单因素方差分析(One-way ANOVA), 若组间存在显著差异, 再进行Turkey多重比较进行分析, 显著性水平为<0.05。
2 实验结果
2.1 背景色对生长与存活的影响
不同颜色背景养殖56 d后, 各组红螯螯虾体质量呈现显著差异(表1)。黑色背景组红螯螯虾体质量增长32.66 g, 显著高于其他各组(<0.05), 红色、绿色和蓝色3种背景色下红螯螯虾终末体质量之间无显著差异。黑色背景组红螯螯虾特定生长率最高(1.74), 白色组最低, 仅为0.93(<0.05)。不同背景颜色养殖红螯螯虾存活率也存在显著差异, 其中黑色存活率最高为76.4%, 其次是蓝色、绿色、红色, 而白色存活率最低(<0.05)。
2.2 不同背景色对分布的影响
如图1所示, 黑色背景下的红螯螯虾在遮蔽物外分布比例最高, 为43%, 显著高于绿色、蓝色和白色背景色组, 白色背景色组分布比例最低(18%)。
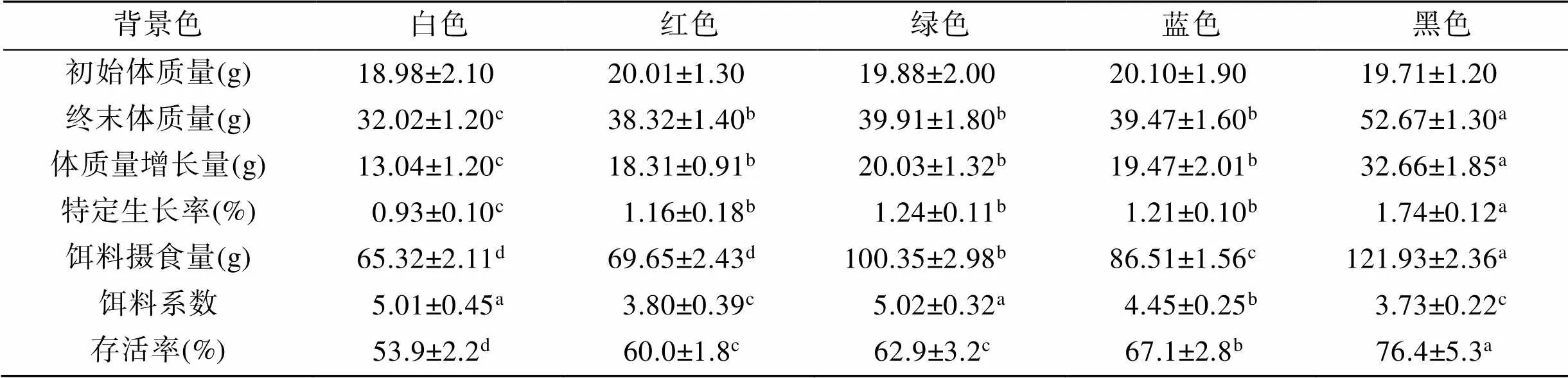
表1 不同背景色处理组红螯螯虾生长及存活率
注: 同一行不同字母表示差异显著(<0.05)
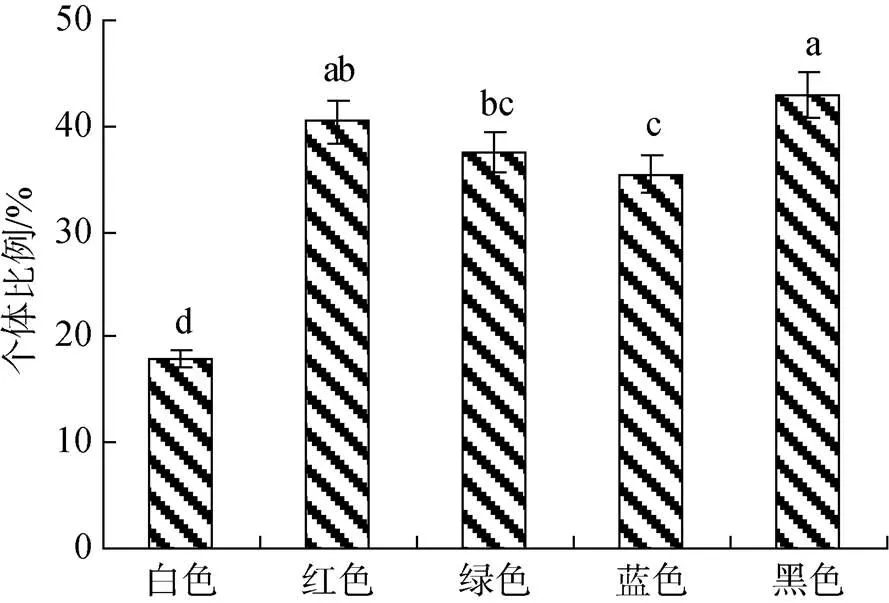
图1 红螯螯虾遮蔽物外分布比例
2.3 不同背景色对体色的影响
黑色环境下红螯螯虾颜色趋向深蓝色, 白色背景下红螯螯虾偏黄色, 而其他3种之间无明显差异(图2)。
ImageJ分析表明, 不同背景色养殖后虾壳RGB参数值存在显著差异(<0.05), 其中白色背景色处理组R值和G值最高, 黑色背景色处理组最低。白色和绿色背景色处理组B值显著高于黑色和红色背景色处理组(图3)。
对各处理组虾壳虾青素色素含量分析表明, 黑色背景组虾壳虾青素含量仅20.2 mg/kg, 显著低于其他各组(69.3~82.2 mg/kg)(<0.05)(图4)。

图2 不同背景色养殖后红螯螯虾体色
A. 白色; B. 红色; C. 绿色; D. 蓝色; E. 黑色
A. white; B. red; C. green; D. blue; E. black
3 讨论
基因、营养与环境因子等是影响生物生长与存活的重要因素[19]。一般而言生物长期接受某种(类)不适刺激会导致其消耗大量能量用于维持呼吸、运动、渗透压调节和机体组织损伤修复, 进而影响生长速率[20]。养殖生产中设置生物最佳环境, 有利于减少其因不适刺激而引起能量额外消耗, 促进生物健康生长。本实验比较了5种不同背景色下红螯螯虾的生长差异, 结果表明黑色背景色组红螯螯虾的饵料摄食量和增长率显著高于其他各组, 该结果与Maciel[7]等和Sykes[11]等报道的亚马逊对虾无节幼体和乌贼结果相一致此外, 黑色背景下红螯螯虾分布于遮蔽物外比例最高, 表明在该颜色环境下, 红螯螯虾安全感最高。不同背景色处理组红螯螯虾存活率也存在显著差异, 其中黑色背景下红螯螯虾存活率为76.4%, 而白色背景组仅为53.9%。Gardner等[21]研究表明黑色环境中澳洲大闸蟹残食率比白色环境中要低。Rabbani[10]等在锯缘青蟹的相关研究中亦表明, 白色背景色环境下锯缘青蟹幼体存活率低, 发育不良。在本实验过程中, 白色环境下红螯螯虾打斗次数明显要多于其他各组, 这或许是导致红螯螯虾生长速度降低, 甚至死亡的原因。
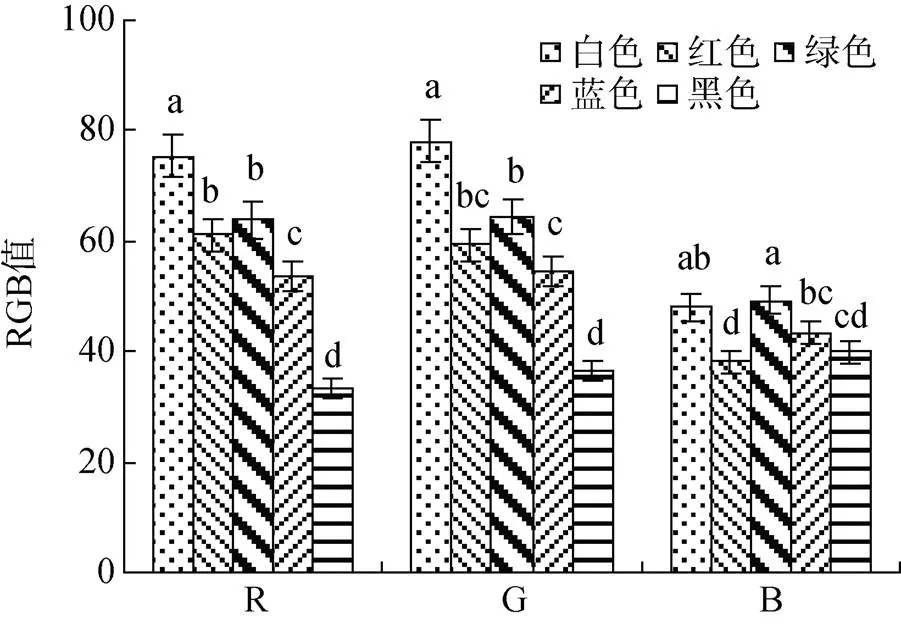
图3 不同背景色处理组红螯螯体色RGB值
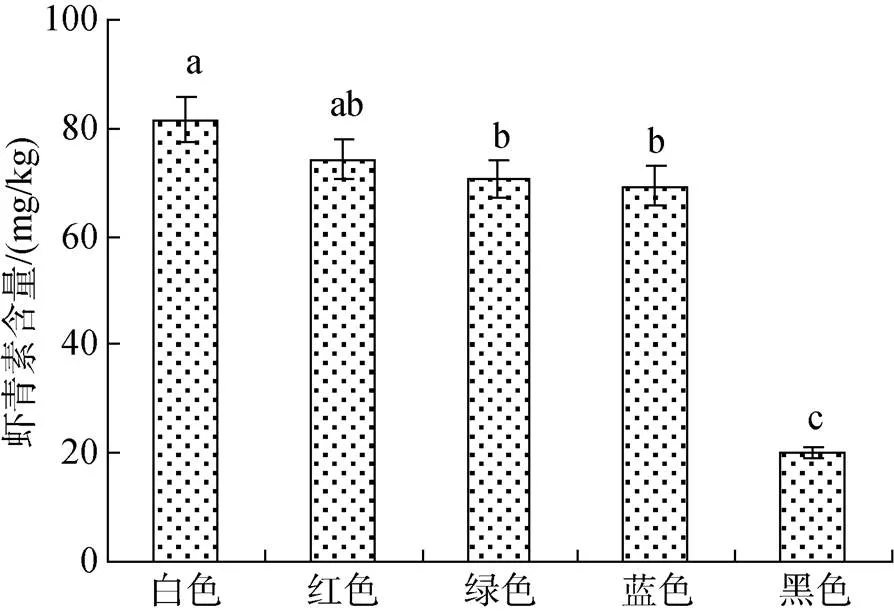
图4 不同背景色处理组红螯螯虾虾壳虾青素含量
实验结果中不同背景色养殖后红螯螯虾呈现不同体色特征, 其中黑色背景色组养殖红螯螯虾偏蓝, 虾壳虾青素含量较低, 白色养殖偏黄褐色, 虾壳虾青素含量高。这可能与环境颜色刺激引起红螯螯虾内分泌变化, 进而导致体内色素和蛋白质代谢速度改变有关。虾蟹类动物本身不能进行色素合成, 其是通过食物摄取类胡萝卜素, 进而经过色素沉积和转化合成自身所需色素种类[22, 23]。研究表明虾蟹体色偏蓝色与蛋白质和虾青素的结合的一种产物—甲壳蓝蛋白有关[24-26]。You[27]等在凡纳滨对虾相关研究中亦表明与黑暗条件相比, 白色背景下虾壳体色偏黄褐色, 虾青素含量更高。他们指出浅色环境增加了虾青素的酯化作用, 降低了虾青素与蛋白质的结合, 进而引起了体色改变。迄今, 已在斑节对虾()、薄荷虾()及欧洲横纹墨鱼()等多种水产动物体色研究中得出相似结果[28-30]。因此, 本研究初步推断背景色变化亦导致红螯螯虾虾青素合成速率发生变化, 最终引起体色改变。
4 结论
不同背景色养殖红螯螯虾对生长、存活和体色变化均会产生不同影响, 黑色背景下红螯螯虾生长速度最快, 存活率最高, 更加活跃性。黑色背景条件下, 红螯螯虾体色更蓝, 建议生产中以暗色背景色进行红螯螯虾养殖。
[1] Jones C M, Medley P B, Avault J W. A global perspective of Redclaw crayfish,: Production, economics and marketing[J]. Journal of World Aquaculture Society, 1994, 25(4): 6-13.
[2] Chang A K. Analysis of the performance of a formulated feed in comparison with a commercial prawn feed for the crayfish,[J]. World Aquaculture, 2001, 32(2): 19-23.
[3] AlimonA R, Roustaian P, Saad C R, et al. Lipid content and fatty acid composition during early and late embryonic development of red claw crayfish,[J]. Journal of Applied Ichthyology, 2003, 19(6): 397-398.
[4] Vanzquez F J, Lopez Greco L S. Intersex females in the red claw crayfish,(Decapoda: Parastacidae)[J]. Revista de Biologia Tropical, 2007, 55(2): 25-32.
[5] 成器. 虾类养殖优良新品种——澳洲淡水龙虾[J]. 广东科技, 1994, 7: 20, 15.Cheng Qi. New Excellent shrimp breeding new species - Australian freshwater lobster[J]. Science and Technology in Guangdong, 1994, 7: 20, 15.
[6] 殷悦, 严维辉, 郑友, 等. 红螯螯虾研究进展及在江苏的产业发展前景分析[J]. 水产养殖, 2018, 39(10): 9-13. Yin Yue, Yan Weihui, Zheng You, et al. Research progress and industrial development prospect in Jiangsu Province for[J]. Aquaculture, 2018, 39(10): 9-13.
[7] Maciel C R, Valenti W C. Effect of tank colour on larval performance of the Amazon River prawn,[J]. Aquaculture Research, 2014, 45(6): 1041-1050.
[8] Tamazouzt L, Chatain B, Fontaine P. Tank wall colour and light level affect growth and survival of Eurasian perch larvae (L.)[J]. Aquaculture, 2000, 182(1-2): 85-90.
[9] Papoutsoglou S E, Mylonakis G, Miliou H, et al. Effects of background color on growth performances and physiological responses of scaled carp (L.) reared in a closed circulated system[J]. Aquacultural Engineering, 2000, 22(4): 309-318.
[10] Rabbani A G, Zeng C. Effects of tank colour on larval survival and development of mud crab(Forskl)[J]. Aquaculture Research, 2005, 36(11): 1112-1119.
[11] Sykes A V, Domingues P M, Lorenzo M, et al. The effects of tank colours on the growth and survival of cuttlefish (, Linnaeus 1758) hatchlings and juveniles[J]. Aquaculture Research, 2011, 42(3): 441-449.
[12] Rotllant J, Tort L, Montero D, et al. Background colour influence on the stress response in cultured red porgy[J]. Aquaculture, 2003, 223(1-4): 129-139.
[13] Giri S S, Sahoo S K, Sahu B B, et al. Larval survival and growth in(Bloch and Schneider): effects of light, photoperiod and feeding regimes[J]. Aquaculture, 2002, 213(1-4): 151-161.
[14] Jimenez L D, Vergara M H, Rostro C P, et al. The effect of astaxanthin and β carotene inclusion in diets for growth, reproduction and pigmentation of the peppermint shrimp[J]. Latin American Journal of Aquatic Research, 2019, 47(3): 559-567.
[15] Duarte R C, Stevens M, Flores A A. Shape, colour plasticity, and habitat use indicate morph-specific camouflage strategies in a marine shrimp[J]. BMC evolutionary biology, 2016, 16(1): 218.
[16] Siegenthaler A, Mastin A, Dufaut C, et al. Background matching in the brown shrimp: adaptive camouflage and behavioural-plasticity[J]. Scientific reports, 2018, 8(1): 1-12.
[17] Wade N M, Anderson M, Sellars M J, et al. Mechanisms of colour adaptation in the prawn[J]. Journal of Experimental Biology, 2012, 215(2): 343-350.
[18] Shuai L, Junru G, Jinhua F, et al. Determination of astaxanthin and astaxanthin esters in shrimp shell by HPLC[J]. Marine Science Bulletin, 2019, 21(2): 57-71.
[19] Leclercq E, Taylor J F, Migaud H. Morphological skin colour changes in teleosts[J]. Fish and Fisheries, 2010, 11(2): 159-193.
[20] Biswas A K, Seoka M, Takii K, et al. Stress response of red sea bream Pagrus major to acute handling and chronic photoperiod manipulation[J]. Aquaculture, 2006, 252(24): 566-572.
[21] Gardner C, Maguire G B. Effect of photoperiod and light intensity on survival, development and cannibalism of larvae of the Australian giant crab Pseudocarcinus gigas (Lamarck)[J]. Aquaculture, 1998, 165(1-2): 51-63.
[22] Shiraki T, Kojima D, & Fukada Y. Light-induced body colorchange in developing zebrafish[J]. Photochemical & Photobiological Sciences, 2010, 9(11): 1498-1504.
[23] 冷向军, 李小勤. 水产动物着色的研究进展[J]. 水产学报, 2006, 30(1): 138-143.Leng Xiangjun, Li Xiaoqin. The recent advance of aquatic animal pigmentation[J]. Journal of Fisheries, 2006, 30(1): 138-143.
[24] Cianci M, Rizkallah P J, Olczak A, et al. The molecular basis of the coloration mechanism in lobster shell: β-crustacyanin at 3.2-Å resolution[J]. Proceedings of the National Academy of Sciences, 2002, 99(15): 9795-9800.
[25] Velu C S, Czeczuga B, Munuswamy N. Carotenoprotein complexes in entomostracan crustaceans (and)[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2003, 135(1): 35-42.
[26] Supamattaya K, Kiriratnikom S, Boonyaratpalin M, et al. Effect of a Dunaliella extract on growth performance, health condition, immune response and disease resistance in black tiger shrimp ()[J]. Aquaculture, 2005, 248(1-4): 207-216.
[27] You K, Yang H, Liu Y, et al. Effects of different light sources and illumination methods on growth and body color of shrimp Litopenaeus vannamei[J]. Aquaculture, 2006, 252(2-4): 557-565.
[28] Tume R K, Sikes A L, Tabrett S, et al. Effect of background colour on the distribution of astaxanthin in black tiger prawn (): Effective method for improvement of cooked colour[J]. Aquaculture, 2009, 296(1-2): 129-135.
[29] Díaz-Jiménez L, Hernández-Vergara M P, Pérez-Rostro C I. The effect of background colour and lighting of the aquarium on the body pigmentation of the peppered shrimp[J]. Aquaculture Research, 2018 , 49(11): 3508-3516.
[30] Mathger L M, Chiao C C, Barbosa A, et al. Color matching on natural substrates in cuttlefish,[J]. Journal of Comparative Physiology A, 2008, 194(6): 577-585.
Effects of background color on growth, survival, body color, and inhabiting behavior distribution of
WEI Miao1, GU Zhi-feng1, 2, PAN Zhi3, SHI Yao-hua1, HUANG Zhi-wei1, ZHENG Xing1, LIAO Xiu-rui1, LI Jiao-ni1, LIU Chun-sheng1, WANG Ai-min1, 2
(1. Ocean College, Hainan University, Haikou 507228, China; 2. State Key Laboratory of Marine Resource Utilization in South China Sea, Haikou 507228, China; 3. Hainan Breeding Center, Beijing Aquatic Technology Extension Station, Wenchang 571323, China)
In this study, five different background colors (white, red, green, blue, and black) were set to culture, in order to investigate the effects of background color on the growth, survival, body color, and distribution behavior of. After a 56-day rearing period, the black-backgroundshowed the highest increase in the body weight, specific growth rate, and survival rate (32.66 g, 1.74%, and 76.4%, respectively), followed by the green-, blue-, and red-background groups, with the white-background group showing the lowest values (<0.05). The feed coefficients of the black- and red-backgroundwere the lowest (3.73–3.80). The body color ofreared in black conditionwas bluer than those of other groups. ImageJ analysis showed that the R and G values of the black-background group were significantly lower than those of other groups, and the astaxanthin content in the black-background group was 20.23 mg/kg, which was significantly lower than those of other groups (69.34–82.15 mg/kg) (<0.05). Moreover, the probability ofdistribution outside the shelter was significantly higher in the black-background group compared with the other groups (<0.05). In summary, the background color can significantly affect the growth, survival, body color, and behavior distribution ofUsing a black background inrearing can improve their growth and survival rate, as well as body color.
; background color; growth; body color; behavior distribution
Apr. 3, 2020
S917.4
A
1000-3096(2020)10-0060-06
10.11759/hykx20200403001
2020-04-03;
2020-05-15
海南省重点研发计划项目(ZDYF2018046); 国家重点研发计划项目(2018YFD0900704)
[Supported by the Key Research and Development Program of Hainan Province , No.ZDYF2018046; National Key Research and Development Project, No.2018YFD0900704]
魏淼(1993-), 女, 山东日照人, 硕士, 主要从事热带水产动物种质改良与遗传育种研究, 电话: 18006339092, E-mail: 1459191652@qq.com; 刘春胜,通信作者, 电话: 13086002911, E-mail: lcs5113@163.com; 王爱民, 通信作者, 电话: 13006028618, E-mail: aimwang@163.com
(本文编辑: 谭雪静)
