流感病毒和冠状病毒的细胞表面结合与内化*
2020-11-06鲍美美杨恺元冰
鲍美美 杨恺 元冰
(苏州大学软凝聚态物理及交叉研究中心, 苏州 215006)
1 引 言
病毒是一种非细胞型生物, 体积微小. 最大的牛痘病毒直径约为300 nm, 最小的核糖核酸病毒直径仅有20 nm左右. 病毒大多为球形或近似球形, 少数为杆状、丝状等. 病毒由核酸 (DNA 或RNA) 及外面包裹的蛋白质核衣壳组成, 有的病毒表面还具有一层脂质双层膜. 尽管一些病毒能直接与细胞膜融合将遗传物质释放到细胞质中 (比如人类免疫缺陷病毒HIV), 但大部分病毒仍以通过穿透细胞膜的方式侵入胞内, 然后复制增殖, 从而将遗传物质传递至宿主细胞. 现在已知的病毒侵入细胞的途径包括网格蛋白介导的内吞、小窝/脂筏介导的内吞、巨胞饮及非网格蛋白非小窝结构依赖的内吞等[1,2]. 在这些途径当中, 网格蛋白介导的内吞是最常见的病毒侵入途径.
病毒是人类健康的巨大威胁. 仅在21世纪,世界范围内已发生了5次大规模的呼吸道病毒流行病, 引起这些大流行的病毒分别属于流感病毒和冠状病毒, 包括严重急性呼吸综合征冠状病毒(SARS-CoV)[3], H1N1 甲型流感病毒[4], 中东呼吸综合症冠状病毒 (MERS-CoV)[5], 亚洲H7N9甲型流感病毒[6], 以及现在仍在蔓延的新型冠状病毒(SARS-CoV-2)[7]. 流感病毒和冠状病毒同属于包膜病毒. 与流感病毒相比, 冠状病毒具有更强的传染能力和更高的致死率. 病毒大都通过表面突出的糖蛋白与宿主细胞膜上特定的受体进行结合[8], 继而在细胞因子的参与下, 通过不同的内化途径侵入细胞.细胞内吞体的低pH环境会诱导病毒膜与内吞体膜发生融合并释放遗传物质, 使其进入核内进行复制和组装, 最后转运至细胞膜出芽形成新的病毒体.
按照核蛋白的抗原性, 流感病毒可分为甲(A)、乙 (B)、丙 (C)、丁 (D) 四型. 人流感主要是 A 型和B型流感病毒引起的, C型流感病毒只引起人类不明显的或轻微的上呼吸道感染, D型流感病毒的宿主主要是牛. 目前相关研究主要聚焦于探究流感病毒侵入细胞的途径[9], 追踪其感染细胞的运动轨迹[10], 阐明其膜融合机制[11], 揭示其胞内转运的各个阶段[12], 以及探索遗传物质入核出核的过程[13]等. 另一方面, 对于冠状病毒, 国际病毒分类委员会 (The International Committee on Taxonomy of Viruses, ICTV) 将其分为 4 个属, 即 a, b,g及新假定的d冠状病毒属. SARS-CoV-2是近期新发现的一种b属冠状病毒, 有很强的传染能力. 目前已经检测出SARS-CoV-2的全基因组序列及病毒与细胞结合的蛋白等, 但对于它通过何种路径侵入并感染细胞的机制尚不清楚.
流感病毒和SARS-CoV-2结构相似, 直径大多分布在几十至几百纳米范围内, 都是利用表面突出的糖蛋白与细胞膜上的受体相结合. 这两种病毒主要是感染人的呼吸系统, 引发发热、咳嗽等症状,严重者甚至造成肺部的感染. 值得注意的是, 临床上常选用抗流感病毒的药物, 如鸟嘌呤类似物法匹拉韦[14]、神经氨酸酶抑制剂奥司他韦[14]及中药疏风解毒胶囊[15]和莲花清瘟胶囊[16]等都对SARSCoV-2的治疗显示出了一定的效果. 这表明SARS-CoV-2与流感病毒在感染细胞的过程中存在一定的相似性. 这也提示我们可以参考借鉴流感病毒感染细胞的路径来探究SARS-CoV-2与细胞的相互作用. 本文从该角度出发, 重点阐述流感病毒与细胞受体的结合及在多种细胞因子的参与下侵入细胞的路径, 最后介绍了SARS-CoV-2与细胞作用的相关研究进展, 旨在为当前SARS-CoV-2的相关研究提供帮助.
2 流感病毒的细胞结合与内化
2.1 流感病毒的结构
流感病毒属于正粘病毒科, 是一种包膜病毒,膜上镶嵌着3类膜蛋白: 血凝素 (hemagglutinin,HA)、神经氨酸酶 (neuraminidase, NA) 和膜蛋白M2 (membrane protein 2, M2)[17]. HA 以同源三聚体的形式存在. HA水解后形成轻链和重链两部分, 其中重链负责病毒与细胞的结合, 而轻链则协助病毒膜与内吞体膜的半融合. NA是蘑菇状的四聚体糖蛋白, 具有水解唾液酸的活性, 能帮助病毒从宿主细胞中释放. 膜蛋白M2具有离子通道和调节膜内 pH 的作用. 此外, 基质蛋白 M1 (matrix protein 1, M1) 构成病毒的外壳骨架, 与病毒最外层的包膜紧密结合, 起到保护病毒核心和维持病毒空间结构的作用. 病毒的遗传物质是单股负链RNA与核蛋白折叠在一起形成的病毒核糖核蛋白(virus ribonucleoprotein, vRNP) 复合物[17](图 1(a)).
流 感 病 毒 的 形 状 多 样. 1946 年, Mosley 和Wyckoff[18]首次利用电子显微镜从感染流感病毒的鸡胚尿囊液中观察到丝状流感病毒. 不同于已发现的尺寸约 80 nm的球状 A型流感病毒株RP8[19]及100 nm左右的B型流感病毒株Lee[20],丝状病毒的长度不一, 从几百纳米至几十微米, 但宽度小于球状病毒. 另外还存在一类长度小于250 nm、宽度约为95 nm左右的杆状流感病毒株.临床分离的A2流感病毒在鸡胚中生长两代后会出现丝状病毒, 但十二代后只见球状病毒 (图1(b)和图1(c))[21], 这可能是由于合成丝状病毒需要宿主提供更多特定的膜蛋白, 在传代过程中处于劣势, 导致最后只剩下球状病毒. 病毒形状的不同主要由其遗传性状决定[22].
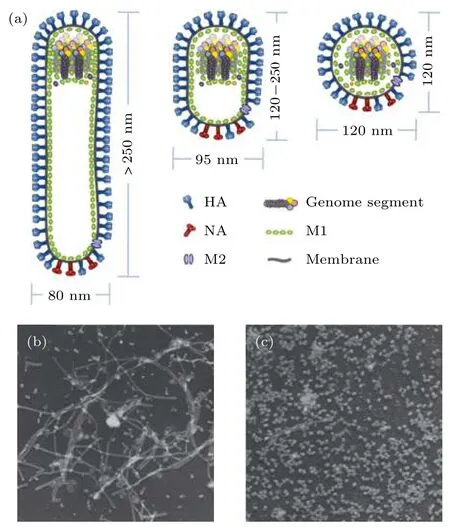
图 1 流感病毒的结构与形状[17,21] (a) 丝状、杆状与球状流感病毒模型图, 流感病毒是包被病毒, 最外层是脂质膜,膜上含有HA和NA两种糖蛋白及M2通道蛋白, 膜下是基质蛋白M1, 丝状病毒的基因组位于远端, 球状病毒的基因组位于中心; (b) 丝状病毒和(c) 球状病毒的电子显微镜照片Fig. 1. Composition and shape of influenza virus[17,21]: (a) Filamentous, rod-shaped and globular influenza virus models;(b), (c) representative electron microscopy images of filamentous and globular viruses, respectively.
2.2 流感病毒与细胞的结合
病毒感染细胞一般始于其吸附到细胞表面并经特定路径侵入细胞. 流感病毒主要通过HA的重链与呼吸道或肠上皮细胞上的唾液酸相结合[23].这是流感病毒与宿主细胞结合的主要靶向分子(表1). 唾液酸位于细胞膜上糖蛋白和糖脂的末端,通过 a-2, 3 或 a-2, 6 糖苷键连接到半乳糖上. HA特异性的亲和力主要是由唾液酸的拓扑结构决定的: 人源流感病毒优先结合至a-2, 6糖苷键连接的长链伞状的唾液酸, 而禽流感病毒一般结合到a-2,3糖苷键连接的短圆锥状结构的唾液酸[24,25]. 有研究显示禽流感病毒H3 N2也倾向于结合到人源唾液酸a-2, 6糖苷键连接的糖蛋白分支上[26], 从而导致不同物种间的传染. 实际上, HA与唾液酸的亲和力较弱. 但由于哺乳动物细胞表面唾液酸含量丰富, 因此病毒能高效地结合到细胞上[27].
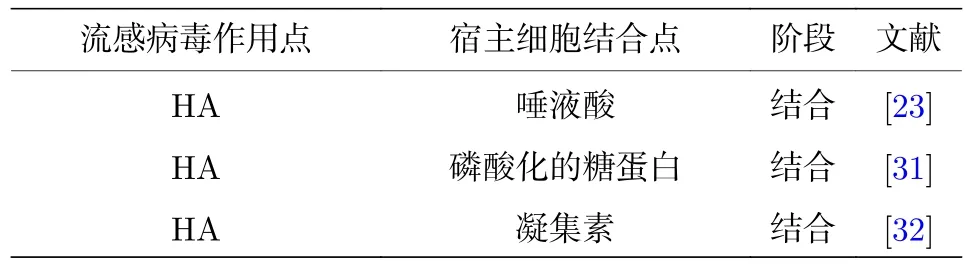
表 1 流感病毒与宿主细胞结合的靶向分子Table 1. Targeting molecules for influenza virus binding to host cells.
除此之外, 流感病毒与细胞的结合还涉及宿主细胞膜上的固醇及脂筏结构. 体外实验发现流感病毒与细胞的亲和力依赖于膜上固醇的类别和浓度;分子模拟结果也显示流感病毒在含胆固醇的双层膜上会形成含双唾液酸神经节苷脂的纳米簇, 进而促进病毒与膜的结合[28,29]. 单分子示踪和活细胞实时荧光实验结果显示, A型流感病毒 (influenza A virus, IAV) 与脂筏的标记物神经节苷脂单唾液酸四己糖共定位, 并且从感染IAV的细胞膜提取的脂筏结构中也检测到病毒蛋白. 此外, 在破坏膜上脂筏结构后, IAV的结合能力显著下降. 这些现象都证实病毒包被中浓缩的HA能够有效结合至脂筏区的唾液酸从而实现高亲多价结合[30].
然而, 流感病毒与细胞的结合具有复杂性特点. 一些研究表明病毒可能通过HA与不含唾液酸的磷酸化糖蛋白结合侵入人肺部细胞[31]. Ng等[32]的研究显示, IAV能够通过HA上富含甘露糖的糖链识别细胞表面凝集素完成吸附, 并感染表达了C型凝集素Langerin的仓鼠卵巢癌细胞Lec2.
2.3 流感病毒的细胞内化途径
大多数流感病毒结合至细胞表面后, 会在不同细胞因子的诱导下以内吞的方式侵入细胞, 完成内化. 细胞的内吞途径通常分为网格蛋白介导的内吞、小窝结构介导的内吞、吞噬、巨胞饮及吞饮等途径[33]. 其中网格蛋白和小窝结构途径属于受体介导的内吞; 吞噬一般仅限于特定的细胞比如巨噬细胞和中性粒细胞, 主要用于摄取大的颗粒物、消灭感染的细菌等; 巨胞饮途径是将液体和颗粒内化侵入细胞的非特异性过程; 而吞饮作用是从细胞外部环境吸收生物液体[34]. 科学家们曾利用透射电子显微镜技术研究流感病毒侵入细胞的方式. 形态学图像分析显示病毒会结合到细胞表面的有被小窝中, 这说明流感病毒可能是以网格蛋白介导的方式侵入细胞的[35,36]; 与此同时, 也观察到病毒位于表面没有包被且光滑的凹陷结构内, 这说明病毒还可能以其他途径侵入细胞. 现有研究表明, 流感病毒侵入细胞的内吞路径具有多样化的特点, 网格蛋白介导的内吞、小窝结构参与的内吞、巨胞饮作用、非网格蛋白/非小窝结构的内吞等都有可能是病毒内化的途径[37−39](图 2).
2.3.1 网格蛋白介导的病毒内吞
网格蛋白介导的方式 (clathrin mediated endocytosis, CME) 是流感病毒实现细胞内吞的主要途径. 庄小威课题组[40]利用单分子示踪及荧光共定位成像技术实时观察单个流感病毒侵入非洲绿猴正常肾上皮细胞BS-C-1的过程, 发现65%的内化病毒在相当长的一段时间内会与网格蛋白包被的结构相关联, 而其余35%的病毒与包被网格蛋白的结构没有任何联系, 说明大多数病毒通过网格蛋白介导的方式侵入细胞, 而其余病毒则会采用其他方式侵入; 这两种途径同时存在且具有相似的膜融合效率. 与此类似, 在马-达二氏犬肾细胞MDCK体系中, Whittaker课题组[41]发现在流感病毒结合位点处, 网格蛋白的荧光会逐渐增强、达到峰值后趋于稳定. 这表明网格蛋白包被小窝 (clathrin coated pit, CCP) 产生并渐渐成熟; 而当 CCP 内吞后形成网格蛋白包被小泡 (clathrin coated vesicle, CCV)、进行胞内转运后, 荧光会逐渐减弱直至消失. 另一方面, 单分子追踪实验数据表明约85%的病毒内化需要网格蛋白的参与[42]. 此外, 研究人员对流感病毒、网格蛋白、动力蛋白分别进行荧光标记和实时追踪, 发现动力蛋白也会参与网格蛋白与流感病毒的相互作用过程[42], 甚至在抑制CME途径、非网格蛋白依赖的内吞 (clathrin independent endocytosis, CIE) 途径的条件下, 仍然观察到了动力蛋白的聚集现象. 然而在这种情况下, 侵入细胞的病毒数量会减少至原来的2/3, 这也间接验证了流感病毒内化更倾向于CME途径.
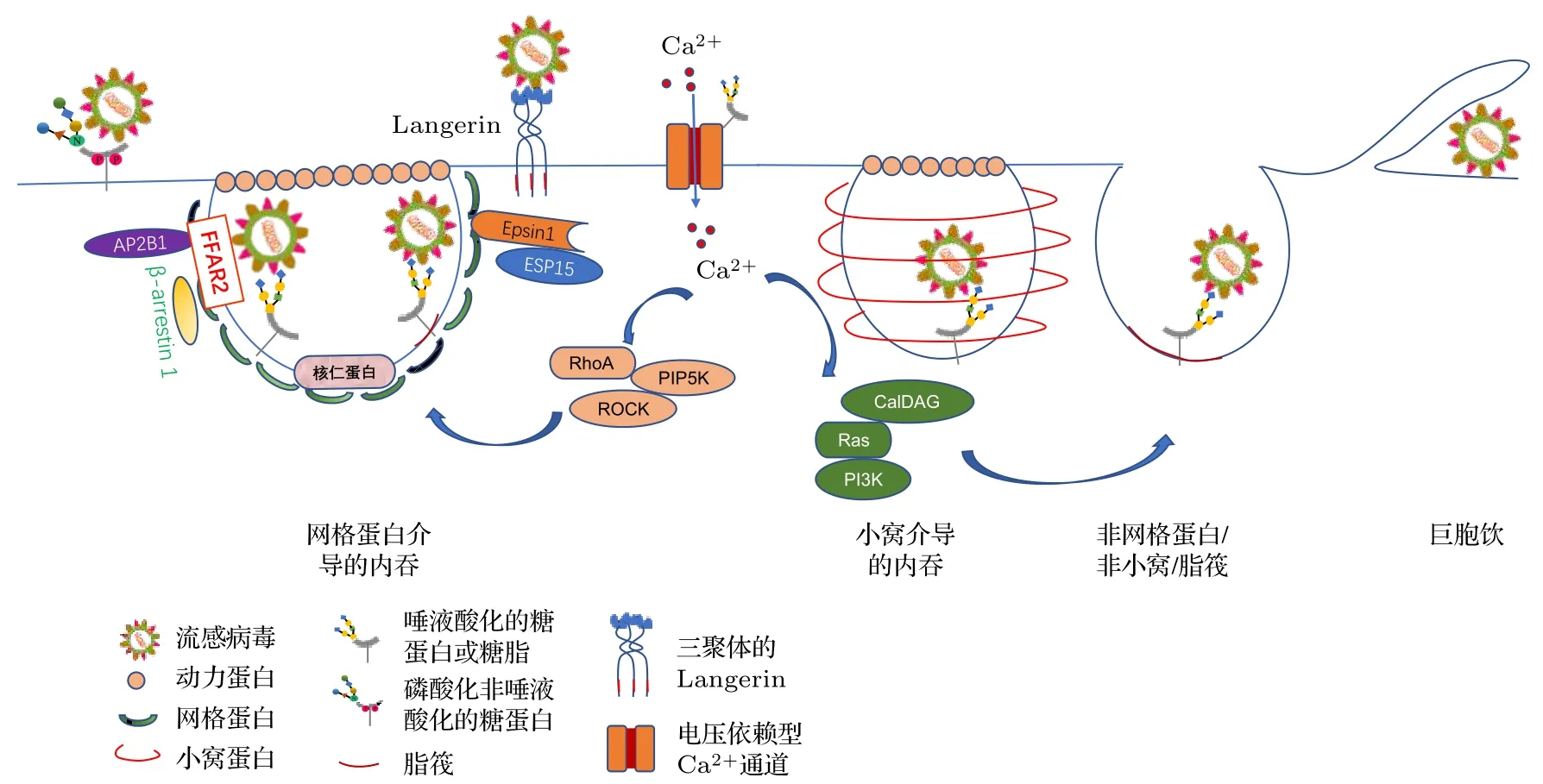
图 2 流感病毒在细胞表面结合及内化示意图. 流感病毒与细胞表面的糖蛋白或糖脂末端的唾液酸、或者磷酸化的糖蛋白、抑或是C型凝集素Langerin发生结合, 之后在G蛋白偶联受体FFAR2、表达于膜上的核仁蛋白、适配体蛋白Epsin1和EPS15、C型凝集素Langerin等细胞因子的参与下, 通过网格蛋白介导的方式发生内吞. 胞内Ca2+的增加可以促进流感病毒通过网格蛋白或非网格蛋白的方式侵入细胞, 另外膜上脂筏结构也参与病毒的吸附和内化过程Fig. 2. Schematic diagram of influenza virus binding and internalization at cellular surface. The influenza virus binds on the cell surface with sialic acid at the end of a glycoprotein or lipid, phosphorylated glycoprotein, or C-type lectin Langerin, and then enters into the cell through clathrin-mediated endocytosis with the participation of cytokines such as G protein coupled receptor FFAR2,nucleolus protein expressed in membrane, adapter proteins Epsin1 and EPS15, or C-type lectin Langerin. An increased amount of intracellular Ca2+ promotes the entry of influenza virus in the clathrin or non-clathrin way. Lipid rafts also play roles in the process of virus adsorption and internalization.
2.3.2 病毒内化过程对小窝结构的依赖性
小窝是细胞膜表面烧瓶状的内陷结构, 直径约50—100 nm, 内含丰富的胆固醇、鞘糖脂和小窝蛋白[43]. 这种结构主要分布在一些内皮细胞、纤维细胞、脂肪细胞及肌肉细胞内[44], 参与细胞内吞、胞吞转运、膜内稳态、炎症反应及信号传导等. 菲律宾菌素是常用的固醇特异性结合试剂, 与细胞作用后会抽出脂筏中的胆固醇从而破坏小窝结构[45].为了探究小窝介导的内吞作用在流感病毒内化中的潜在贡献, Nunes-Correia等[46]检测了菲律宾菌素对马-达二氏犬肾细胞MDCK内吞过程的影响,结果发现1 µg/mL的菲律宾菌素对病毒的内吞抑制率可以达到50%; 并且作者发现菲律宾菌素对流感病毒结合过程及与内吞膜融合均没有抑制作用.因此他们推断菲律宾菌素应该是影响了病毒的内化过程, 特别是抑制了小窝介导的内吞方式, 从而导致菲律宾菌素处理后的细胞内、病毒实现内吞比例的减少.
2.3.3 病毒以巨胞饮方式侵入细胞
巨胞饮作用是细胞非特异性摄取液体、溶质、膜、配体及吸附在质膜上的小颗粒物质的一种依赖肌动蛋白的内化方式. 在大多数类型的细胞中, 它不是持续进行的, 而是一个信号依赖的过程, 通常是在生长因子刺激的情况下发生, 例如血清中的生长因子能够刺激细胞发生巨胞饮[47]. 摄取细胞外异硫氰酸荧光素FITC标记的可溶性葡聚糖(FITC-Dextran, Fdx) 进入大的内吞泡被认为是胞饮体存在的标志和形态学研究的常用方法. 研究人员将Fdx加入含血清的细胞溶液中, 发现了溶液中的血清能够诱导Fdx进入内吞泡. 加入流感病毒后在更高的放大倍数下可见流感病毒共定位于含Fdx的内吞泡以及这些小泡的外部, 说明了流感病毒确实可以通过巨胞饮过程进入细胞[48]. 细胞周期依赖性蛋白激酶抑制因子P21活化激酶1(P21-activated kinase1, Pak1)是酪氨酸激酶信号通路的下游信号分子, 可激活许多不同的通路, 促进肌动蛋白网络重排, 从而诱导巨胞饮作用;Epsin1是流感病毒网格蛋白介导内吞途径中重要的适配体蛋白, 过表达Pak1显性负突变体明显抑制 IAV对细胞的感染, 同时过表达 Epsin1和Pak1的显性负突变体更加减少病毒的感染, 表明球状流感病毒同时利用网格蛋白和巨胞饮途径侵入细胞[49]. 另一方面, 丝状流感病毒由于尺寸的限制无法利用网格蛋白介导的方式进行内吞, 巨胞饮作用是它内吞的主要方式[49].
2.3.4 非网格蛋白非小窝方式的病毒内化
流感病毒侵入细胞的途径是多样化的, 除了上述几种内吞方式外, 还存在不依赖网格蛋白不依赖小窝结构的途径. Eps15是网格蛋白组装过程中重要的调节蛋白, 过表达Eps15显性负突变体可抑制网格蛋白介导的内吞. 但实验结果显示流感病毒可以侵入并感染表达突变体Eps15D95/295的细胞, 利用小窝结构的抑制剂并转染显性抑制的小窝蛋白1并不影响流感病毒感染细胞, 同时阻断网格蛋白和小窝结构介导的内吞也仍然能造成细胞的感染, 由此确定流感病毒可以通过其他途径, 即非网格蛋白非小窝的方式实现细胞内化[41].
另外有研究显示流感病毒还可以通过脂筏介导的内吞途径侵入细胞. 研究人员预先用甲基-b-环糊精作用A549细胞1 h去除胆固醇, 将处理后的细胞与流感病毒孵育, 结果显示流感病毒结合并侵入细胞的数量急剧减少, 若流感病毒感染细胞2 h后再暴露于甲基-b-环糊精中却不影响病毒对细胞的感染, 由此推断流感病毒侵入细胞可能需要脂筏结构的参与, 但具体机制尚不明确[30].
2.3.5 诱导病毒内化的细胞因子
病毒的内化过程还需要其他特定的细胞信号分子的参与[50,51]. N-连接的糖蛋白就是其中一种[52].de Vries等[52]利用丢失N-连接糖基化作用的中国仓鼠卵巢癌细胞Lec-1进行实验发现, 流感病毒与细胞表面的唾液酸结合后, 仅在有血清存在并且有N-连接糖蛋白协助的情况下IAV方可以侵入Lec-1细胞. 该现象显示可能在N-连接的糖蛋白上存在一种特定的碳水化合物, 它是病毒侵入细胞的必需物质.
衔接因子相关蛋白复合体2 (adaptor related protein complex 2, AP-2)是一类适配体蛋白, 包括 AP2 A1, AP2 B1, AP2 M1, AP2 S1 四种亚基,可与内吞过程中多种蛋白质和脂分子发生作用. 其中, AP2 M1与含酪氨酸内化序列的膜结合受体胞内端作用; AP2 B1 在质膜靶向中发挥作用, 作为一个平台招募其他功能相关的辅助蛋白如Eps15和Epsin1等[53]. 研究表明基因敲除其中的AP2 M1亚基后没有改变IAV的内化动力学及侵入细胞的比例, 然而敲除AP2 B1亚基却显著抑制了流感病毒H5 N1的复制[54]. 另外有研究发现IAV与细胞表面的唾液酸结合后, 游离脂肪酸受体2 (free fatty acid receptor 2, FFAR2)结合至 HA1 的球状头部区域, 将 b-arrestin1 与 AP2 B1 聚集至质膜与FFAR2作用, 激活G蛋白偶联受体激酶GRKs从而对FFAR2的C端磷酸化, 促进下游信号转导帮助IAV通过网格蛋白的方式侵入细胞[54]. Epsin1是一类与网格蛋白、泛素蛋白及磷脂作用的蛋白.利用单病毒追踪和活细胞成像技术, Epsin1被发现能够与网格蛋白同时聚集到病毒结合位点, 通过形成CCPs侵入细胞[55]. 过表达缺乏泛素化结构域的Epsin1显性负突变体几乎完全抑制网格蛋白介导的IAV内吞, 这表明Epsin1主要通过泛素化结构域识别流感病毒在上皮细胞表面的受体从而启动CCPs的形成, 最终导致病毒的内化[55].
核仁蛋白 (nucleolin, NCL)是一种普遍存在且含量丰富的蛋白, 参与细胞多种生理活动. 除了定位在细胞核, NCL也分布于核浆、细胞质及细胞表面. 已有研究证明NCL是呼吸道合胞体病毒感染过程中的功能型细胞受体[56]. 对于流感病毒,NCL可作用于H3 N2的非结构1蛋白使其定位于核仁[57,58]. 科学家分别用NCL抗体抑制细胞表面NCL蛋白的活性, 用纯化的NCL蛋白阻断PR8病毒, 用小干扰RNA敲除内源NCL蛋白的表达,然后结合病毒铺覆蛋白印迹技术和免疫共沉淀技术检测, 结果显示以上操作均减少了流感病毒的内化, 这表明除了唾液酸, HA还可能特异性结合NCL蛋白参与病毒网格蛋白介导的内化过程[59,60].
C 型凝集素受体 (C-type lectin receptor, CLR)识别碳水化合物结构, 参与免疫细胞比如巨噬细胞和树突细胞内病原体的吸收及抗原递呈[61−63]. 如巨噬细胞甘露糖凝集素 (macrophage mannose lectin, MML), 巨噬细胞半乳糖型凝集素 (macrophage galactose lectin, MGL), 它们均表达一种碳水化合物识别结构域, 可以结合病毒或其他病原体上的甘露糖或半乳糖衍生物[64]. 研究表明MGL和MML可以作为IAV侵入小鼠巨噬细胞的受体[27,65].而另一种C型凝集素受体Langerin结构与之不同, 分为胞外结构域、跨膜区域及富含脯氨酸信号结构域的胞内端, Langerin胞内端脯氨酸信号结构域的缺失或是位点突变显著抑制IAV对细胞的感染, 表明脯氨酸信号结构域参与了IAV的内化进程[32]. 已有研究显示脯氨酸信号结构域与特定的Src同源结构域3作用, 参与膜泡转运、细胞骨架运动、信号传导及内吞等生理过程[66,67].
Ca2+信号通路也参与了IAV感染细胞的过程[68].当IAV结合至细胞表面时会刺激大鼠肉瘤蛋白 (rat sarcoma, Ras) 结合至磷脂酰肌醇–3 激酶 (phosphatidylinositol 3-kinase, PI3 K), 随后活化的 PI3 K调节IAV的CIE途径. 另外还可以活化包括Ras同源基因家族成员 A (Ras homolog gene family,member A, RhoA)、Rho 相关激酶 (Rho-assocated kinase, ROCK)、磷脂酰肌醇 4-磷酸 5-激酶 (phosphatidylinositol 4-phosphate 5-kinase, PIP5 K)、磷脂酶 C (phoapholipase C, PLC) 以及 Ca2+自身的新的正反馈电路参与CME途径. 利用可穿过细胞膜的钙螯合剂BAPTA-AM螯合Ca2+后抑制病毒的内化和感染, 抑制程度类似于同时使用MDC(抑制 CME) 和 LY294002 (抑制 CIE), 说明 Ca2+信号通路在CME和CIE介导的病毒内化过程中是必要的[68]. 有研究报道细胞膜上电压依赖型钙离子通道很可能介导因IAV刺激引起的胞内Ca2+的增加, 这可能是通过与第Ⅲ/Ⅳ片段上的天冬氨酸残基的结合实现的[69].
另外, 有研究发现膜上脂筏结构也参与流感病毒的内化, 推断可能是因为流感病毒与细胞接触后刺激脂筏结构的形成, 为病毒的内化提供了信号平台. 流感病毒接触细胞后引起质膜区脂筏的聚集,当病毒的HA蛋白与脂筏上的唾液酸基团结合后激活表皮生长因子受体, 继而活化下游信号分子如 PI3K 及磷脂酶 Cg1 (PLC-g1) 等, 促进流感病毒侵入细胞[70,71](表 2).
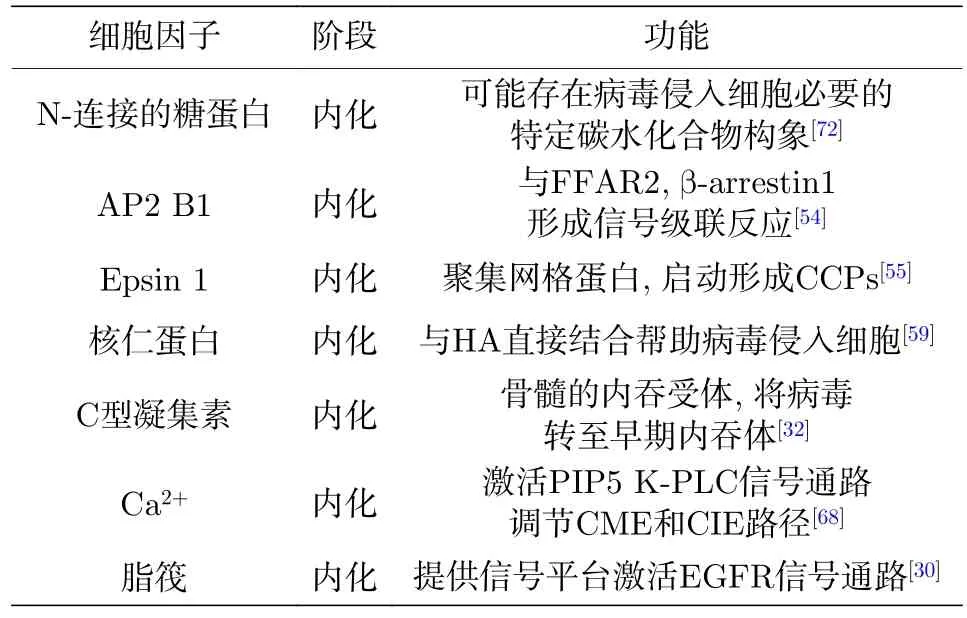
表 2 参与流感病毒内化的细胞因子Table 2. Cytokines involved in influenza virus internalization.
2.3.6 流感病毒侵入细胞后的过程
流感病毒通过不同方式内吞侵入上皮细胞后,新形成的包裹病毒的内吞泡都会进入“相同”的早期内吞体沿着微管蛋白进行转运. 流感病毒从早期内吞体转运至晚期内吞体-溶酶体区域后膜上M2蛋白质子通道打开, 将膜外的H+输送至膜内,导致 pH下降[10,73]. 低pH诱导 HA构象改变, 暴露的疏水端融合HA蛋白亚基多肽HA2插入宿主内吞膜, 使两种膜发生半融合, 病毒的vRNP复合物通过形成的融合孔释放至细胞内[74], 宿主细胞的核输入蛋白将病毒的vRNP通过核孔复合物输送至核内, 利用RNA聚合酶及宿主因子合成mRNA和基因组RNA[75], mRNA出核进入细胞质, 并在游离的核糖体内翻译产生蛋白质, 该蛋白质回到核内协助新的vRNP的合成. 细胞内的染色体区域稳定蛋白1及核输出蛋白1介导vRNP的输出[76].此外, 内质网的核糖体上合成的是病毒的包被蛋白 HA, NA, M2 蛋白, 经历糖基化后通过高尔基体回到细胞膜[77]. 病毒的M1蛋白通过与细胞膜上带负电的磷脂结合诱导其形成多聚体, 并与HA,NA或M2的胞内端作用[78]. 在病毒出芽位点, 细胞膜发生弯曲并包裹病毒基因组, 形成并释放新的病毒颗粒[79]. 最后, 病毒的NA破坏唾液酸的连接从而释放病毒.
3 SARS-CoV-2 的相关研究进展
3.1 冠状病毒的结构特征
冠状病毒是自然界广泛存在的一大类病毒, 仅感染脊椎动物, 最早是从鸡身上分离出来的. 冠状病毒粒子直径约为60—220 nm, 表面有3种糖蛋白: 刺突糖蛋白 (spike glycoprotein, S), 小包膜糖蛋白 (envelope glycoprotein, E), 膜糖蛋白 (membrane glycoprotein, M), 少数还含有血凝素糖蛋白(hemagglutinin protein, HE) (图 3(a))[80]. 冠状病毒的核酸为线性单股正链RNA, 5'端具有甲基化帽 状 结 构 , 3'端 具 有 polyA 尾 , 类 似 于 真 核mRNA, 自身就可以发挥翻译模版作用, 基因组全长27—32 kb, 是目前已知RNA病毒中基因组最大的病毒. 分析临床样品提取的病毒基因组序列发现典型的b属冠状病毒的特征包括: 5'端非翻译区(UTR)、复制酶复合体 (orf1 ab)、S 基因、E 基因、M基因、N基因、3'端UTR, 还有一些未定义的开放阅读框[81].
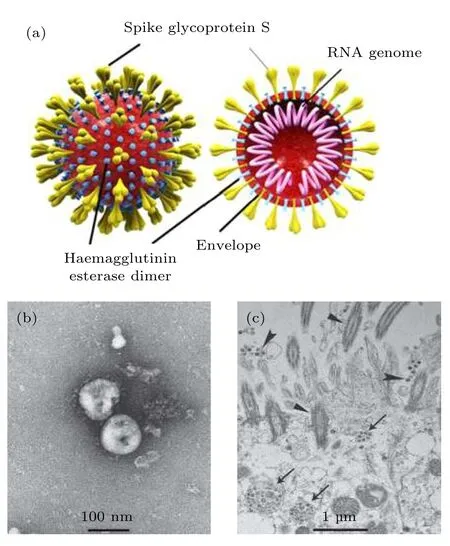
图 3 SARS-CoV-2 的病毒结构 [80]及透射电子显微镜图像[82] (a) SARS-CoV-2 的结构示意图; (b), (c) SARS-CoV-2在不同放大倍数下的透射电子显微镜图像Fig. 3. Structure[80] and transmission electron microscopy images[82] of SARS-CoV-2: (a) Structure of SARS-CoV-2;(b), (c) visualization of SARS-CoV-2 under transmission electron microscope.
2019新型冠状病毒是冠状病毒的一种. 2020年2月18日国际病毒分类委员会将新型冠状病毒正式命名为严重急性呼吸综合征冠状病毒2 (severe acute respiratory syndrome coronavirus 2, SARSCoV-2). 世界卫生组织将由这一病毒导致的疾病命名为COVID-19. 研究人员从新冠患者肺泡灌洗液中分离出的SARS-CoV-2在电镜下观察一般为球形, 具有一定的多形性, 直径约为 60—140 nm,表面带有9—12 nm的刺突, 整体看上去类似日冕(图3(b)和图3(c))[82].
3.2 冠状病毒的细胞表面结合与内化
冠状病毒主要依靠包被上的S蛋白进行受体结合及病毒内化. 所有冠状病毒的S蛋白都由3部分构成: 细胞外结构域、跨膜锚定结构域和短的胞内尾巴. 细胞外结构域包含两个功能亚基, 受体结合亚基S1和膜融合亚基S2. S1又包含独立的N端结构域 (S1-NTD) 及受体结合域 (RBD), 是进行受体识别及结合的关键蛋白[80]. 通过对SARSCoV-2受体配体结构域进行模拟分析, 研究人员发现其由一个核心子域及一个外部子域构成, 并且这个外部子域更类似于SARS-CoV; 尽管有些关键残基存在差异, 但可推断SARS-CoV-2与SARSCoV一样, 也是利用血管紧张素转化酶2 (angiotensin converting enzyme 2, ACE2) 作为细胞受体的[83]. Hoffmann等[84]继而从实验角度进行了验证, 结果表明SARS-CoV-2-S选择侵入 SARS-S侵入的细胞系, 两者S蛋白受体结合域内含有相似的保守氨基酸序列, 并且提高hACE2抗血清浓度能够阻止两种S蛋白介导的病毒侵入, 这验证了SARS-CoV-2利用S蛋白与细胞上ACE2受体结合的推断. 此外, 通过对氨基酸序列的排列发现SARS-CoV-2的S蛋白存在1个缺失和3个插入位点, 4个多余的氨基酸PRRA插入S1与S2亚基之间, 可能会潜在影响S蛋白的水解. 为了证实以上推测, Wang等[85]利用生物信息学分析发现SARS-CoV-2的S蛋白在S1与S2亚基之间存在一个特殊的弗林蛋白酶剪切位点. 弗林蛋白酶普遍表达于多种器官和组织, 包括脑、肺、胃肠道、肝、胰腺及生殖系统. 弗林蛋白酶的预剪切可能促进后面依赖于丝氨酸蛋白酶(TMPRSS2)的入胞过程.当SARS-CoV-2感染细胞时, 主要通过TMPRSS2对S蛋白水解, 有些可能还需要半胱氨酸蛋白酶CatB/L的参与[84]. 研究表明TMPRSS2不仅参与冠状病毒的蛋白水解, 在流感病毒H7 N9和H1 N1的感染中也发挥重要作用[86]. 冠状病毒的S蛋白与流感病毒HA同属Ⅰ型病毒融合蛋白, 在适当的蛋白水解裂解后, 二硫键结合亚基HA1和HA2形成同源三聚体. 作为参与其中的多种蛋白酶中的一种, TMPRSS2只裂解宿主细胞内新生的 HA, 而不参与侵入的病毒粒子HA的蛋白水解激活.
血管紧张素转化酶ACE2定位于多种器官的质膜上, 利用细胞外区域执行功能并通过血管紧张素Ⅱ-1 型 受 体 (angiotensin II type 1 receptor,AT1 R) 诱导病毒侵入细胞, 随后 ACE2 被降解[87].研究表明在SARS-CoV-2感染过程中, ACE2将血管紧张素Ⅱ (angiotensin Ⅱ, Ang Ⅱ) 降解为七肽血管紧张素1-7, 终止Ang Ⅱ的促炎症反应, 同时Ang Ⅱ通过内吞作用和溶酶体降解诱导ACE2的细胞内吞[87]. 研究者通过希尔函数形式阐明S蛋白与ACE2结合的过程, 即位于细胞膜上的ACE2通常是与氨基酸转运载体B0AT1结合, SARSCoV-2感染首先形成一种杂化三聚体, 由S1亚基的RBD结构域、ACE2蛋白和B0AT1组成[88], 说明SARS-CoV-2侵入细胞是通过受体介导的方式实现的.
对于SARS-CoV内吞机制的研究相对较多.早期研究认为SARS-CoV不依赖于pH即能感染细胞, 推断其侵入可能是通过直接的膜融合来实现的[89]; 后来有研究表明SARS-CoV侵入细胞具有一定的pH依赖性[90], 需要内体蛋白酶CatB/L的参与[91], 暗示其可能采取内吞途径. Inoue等[92]基于HepG2细胞的研究发现, SARS-CoV可以侵入caveolin-1阴性的HepG2细胞, 同时药物氯丙嗪(一种网格蛋白依赖的内吞抑制剂) 和阻止网格蛋白重链表达的小干扰RNA皆能够显著抑制该侵入过程; 此外, ACE2与网格蛋白重链共定位于非脂筏区. 这些现象表明网格蛋白依赖的内吞途径可能是SARS-CoV侵入宿主细胞的主要方式. 由于非洲绿猴肾细胞Vero E6具有相对较高的ACE2表达量, 因此它被广泛应用于SARS-CoV相关的研究中. 例如Wang课题组[93]分别用b-甲基环糊精和菲律宾菌素作用于细胞提取膜内胆固醇, 结果显示菲律宾菌素对SARS-CoV的内吞没有影响,而b-甲基环糊精作用后病毒侵入被抑制且抑制效果呈药物浓度依赖性; 同时, 双色免疫荧光结果显示SARS-CoV与caveolin-1并未发生共定位, 这暗示着b-甲基环糊精的抑制作用极有可能是通过改变膜脂质微区的完整性(而并非通过干扰小窝结构介导的内吞)来实现的, 进一步说明了小窝结构不一定参与SARS-CoV侵入细胞. 另外该研究还发现, 细胞松弛素D (一种抑制巨胞饮作用的药物) 可以轻微地抑制病毒对Vero E6细胞的感染,同时SARS-CoV假病毒颗粒能够诱导受体从细胞表面转移至细胞内; 考虑到巨胞饮过程并不需要受体参与, 这说明巨胞饮也不应是SARS-CoV侵入Vero E6细胞的主要途径; 然而氯丙嗪或者Eps15的显性负性突变体不能阻断病毒的侵入, 说明SARS-CoV能够通过受体介导, 而不依赖于网格蛋白和小窝结构的方式实现内吞, 其间可能有脂筏结构的参与[93]. 总之, 针对SARS-CoV对细胞的侵入过程目前已经观察到了网格蛋白介导的内吞、非网格蛋白非小窝结构介导的内吞、脂筏参与等多种可能的方式, 而SARS-CoV-2是否采用与SARSCoV类似的方式侵入细胞或者是否存在其他的途径仍需进一步的研究[94].
4 总结与讨论
本文从流感病毒的结构特征出发, 介绍了流感病毒感染细胞尤其是其在细胞表面键合并实现内化的过程. 流感病毒利用自身的HA, 与细胞表面糖蛋白或糖脂末端的唾液酸残基、或磷酸化糖蛋白、C型凝集素Langerin、乃至脂筏结构等结合,之后在 Epsin1, AP2B1, FFAR2, 核仁蛋白等细胞因子及Ca2+通道、脂筏等结构的调制下, 激活特定的细胞信号通路刺激细胞进行内化. 细胞表面键合的流感病毒主要通过网格蛋白介导的方式实现内吞, 此外也存在巨胞饮作用、依赖小窝结构、或非网格蛋白非小窝介导等内化途径, 侵入细胞后完成基因组复制和蛋白质表达从而组装成新的病毒体.与流感病毒类似, SARS-CoV-2利用包被上的刺突蛋白S1与宿主细胞的ACE2受体结合, 需要细胞内的 TMPRSS2, AT1 R, Ang Ⅱ等蛋白的参与从而侵入细胞.
病毒是很简单的生物, 但其与细胞相互作用的复杂途径为理解病毒的细胞内化和感染过程带来了巨大挑战. 流感病毒与SARS-CoV-2都是通过配体受体相结合的方式吸附至细胞表面, 经细胞内蛋白水解酶的作用将HA和S蛋白活化形成两个亚基, 分别负责病毒与宿主细胞的结合及介导膜融合过程. 流感病毒结合至细胞受体后需要多种细胞因子的参与才能实现内吞, 而有研究表明SARSCoV-2同样可能利用细胞内的某些促吸附因子, 例如与细胞糖蛋白的结合, 来增强其感染性[84]. 这表明流感病毒与SARS-CoV-2在对细胞作用的机理上存在一些相似之处, 因此利用流感病毒的研究方法开展对SARS-CoV-2与细胞作用的研究是一条潜在的途径, 这些方法包括利用siRNA技术或过表达显性负突变体探究细胞内的蛋白在病毒感染中的作用, 利用单病毒跟踪、定量活细胞成像和冷冻电镜技术并结合改进的分析方法以实时追踪病毒侵入细胞的过程等. 有效结合多种研究手段实现对病毒与细胞相互作用的深入了解, 将有助于开发出针对现有的及新出现的病毒性疾病的有效防御措施, 研发出针对宿主细胞关键功能的靶向药物.这类以宿主为导向的药物或抑制剂能够发挥更加有效的病毒抑制效果, 并且不易导致耐药性发生.
