Toll样受体2 Arg677Trp和Arg753Gln基因多态性与梅毒治疗后血清学试验阳性相关性研究
2020-11-06鲁东平张荣王芬贾婕付彪陆小兰
鲁东平, 张荣, 王芬, 贾婕, 付彪, 陆小兰
(1.深圳市宝安中医院(集团)皮肤科,广东 深圳 518101;2.深圳市宝安区慢性病防治院皮肤科,广东 深圳 518133;3.鄂东医疗集团黄石市妇幼保健院产科,湖北 黄石 435000;4.鄂东医养集团,湖北 黄石 435000)
梅毒治疗后会出现非特异性梅毒螺旋体抗体阳性和特异性抗体阳性,或非特异性梅毒螺旋体抗体转阴而特异性抗体阳性两种情况,这种部分血清学试验长期保持阳性的现象,给医患带来一些困惑。目前为止,对梅毒治疗后血清学特点形成的机制尚未完全阐明。Toll 样受体(Toll-like receptor,TLR)作为天然免疫中的重要识别受体,在感染性疾病的防御中有不可替代的作用,其多态性可能会影响疾病的发病、病情以及预后[1-2]。目前研究较多的是Toll样受体2(Toll-like receptor 2,TLR2)两个单核苷酸多态性位点Arg677Trp和Arg753Gln多态性与感染性疾病的关系。已有研究表明TLR2基因多态性可能与葡萄球菌感染及结核病相关[3-4],是增加感染性疾病易感性的危险因素,但尚未见TLR2基因多态性与梅毒治疗后患者血清学试验阳性的相关报道。本研究采用聚合酶链式反应-限制性片断长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)分析及DNA测序法,探讨TLR2 Arg677Trp和Arg753Gln基因多态性与此类患者易感性是否相关,为其形成机制提供理论依据。
1 对象与方法
1.1 研究对象
实验组1: 2016年1月—2018年1月在我区已行规范梅毒治疗并确诊为梅毒血清固定患者100例。其中男58例,女42例,年龄22~56岁,平均(35.52±5.57)岁。纳入标准[5]:①配偶或患者有不洁性交史; ②在确诊为血清固定前均已接受过规范的驱梅治疗,纳入研究时无临床症状;③血清学甲苯胺红不加热血清试验(tolulized red unheated serum test,TRUST)、梅毒螺旋体明胶颗粒凝集试验(treponema pallidum particle agglutination test,TPPA)检测均阳性,每3~6个月复查1次,其中TRUST滴度均≤1 ∶8,在随访3年期间滴度无下降或上升4倍的情况;④HIV抗体检测阴性;⑤无自身免疫性疾病。
实验组2:梅毒治疗后血清学TPPA持续阳性3年以上而TRUST阴性的患者50例。其中男32例,女18例;年龄20~54岁,平均(34.24±5.31)岁。纳入标准:①配偶或患者有梅毒病史;②已接受过规范的驱梅治疗,定期随访3年或以上;③治疗后的一段时间内TPPA和TRUST均阳性,2~3年或若干年后TRUST转阴;④HIV抗体检测阴性。
上述两组患者均通过病史询问,长期随访。均排除有系统性红斑狼疮、传染性单核细胞增多症、心肝肾等重大疾病及结核感染者。
纳入健康志愿者100例作为健康对照组,其中男52例,女48例;年龄21~56岁,平均(34.71±5.64)岁。HIV检测均为阴性。
1.2 试剂及仪器
全血DNA 提取试剂盒(QIAamp DNA Blood Mini Kit,51104);Taq酶(EasyTaq DNA Polymerase,北京全式金生物,AP101-01);dNTP(Takara公司,D4030A);PCR纯化试剂盒(QIAquick PCR Purification Kit,28104);限制性内切酶AciI (New England Biolabs,R0157S)。PCR仪(Eppendorf,American);小型离心机(Eppendorf,American);紫外分光光度计(Eppendorf,American);水平凝胶电泳仪(BioRad,American);凝胶成像分析系统(BioRad, American)。
1.3 方法
1.3.1 DNA提取和PCR扩增 无菌条件抽取研究对象外周血5 mL,EDTA抗凝,-80 ℃保存。使用全血 DNA提取试剂盒提取DNA,置于-80 ℃冰箱保存备用。PCR反应引物由上海生工生物工程有限公司合成(上游引物: 5′-CAGGAAAGCTCCCAGCAGGAA-3′;下游引物:5′- TAGTAAGCAAGTCCTCAAATG-3′),PCR反应体系25 μL: 2.5 μL 10×PCR buffer,1 μL dNTP (2.5 mM), 0.5 μL Taq酶,引物各1 μL,2 μL DNA模板,17 μL双蒸水。PCR反应条件:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35 个循环;72 ℃延伸5 min。1.5%琼脂糖凝胶电泳检测。
1.3.2 RFLP分析及测序 PCR扩增产物使用QIAGEN公司的PCR纯化试剂盒纯化,操作按说明书进行。RFLP反应体系10 μL: PCR产物5.0 μL,限制性内切酶AciⅠ 1 μL,10×酶切反应buffer 1.0 μL,双蒸水补至10.0 μL混匀。37 ℃水浴孵育过夜,65 ℃ 加热20 min停止酶切反应。1.5%琼脂糖凝胶电泳检测,凝胶成像分析系统拍照分析并保存实验结果。酶切结果判断:因引物扩增的590 bp片段包含编码677和753 位氨基酸的核苷酸序列,野生型片段具有两个AciⅠ识别位点(CGCC),当677或753氨基酸位点发生突变时,会失去AciⅠ酶切识别位点,故片段不可以被酶切。在RFLP反应结束后,观察电泳结果,如果出现片段长度为135、232和223 bp的PCR条带,则说明该样本中677和753位点都未发生突变;如果片段长度仍然为590 bp,则说明677和753 bp都发生突变;如果片段长度为135 bp和455 bp,则说明753位点发生突变;如果片段长度为367 bp和223 bp,则说明677位点发生突变。对酶切反应后电泳结果不清晰的样本,于上海生工生物工程有限公司进行 DNA 测序以进一步确认结果。
1.4 统计学方法
采用SPSS 17.0进行统计学分析,将实验组1、2和对照组的测序结果进行比对后,统计三组中突变的位点及突变的频率后作2检验,P<0.05为差异有统计学意义。
2 结果
实验组1、2和对照组共计250例样本,RFLP分析结果显示,未发现存在TLR2 Arg677Trp基因多态性,但实验组1、2存在753Arg突变。见图1、图2。
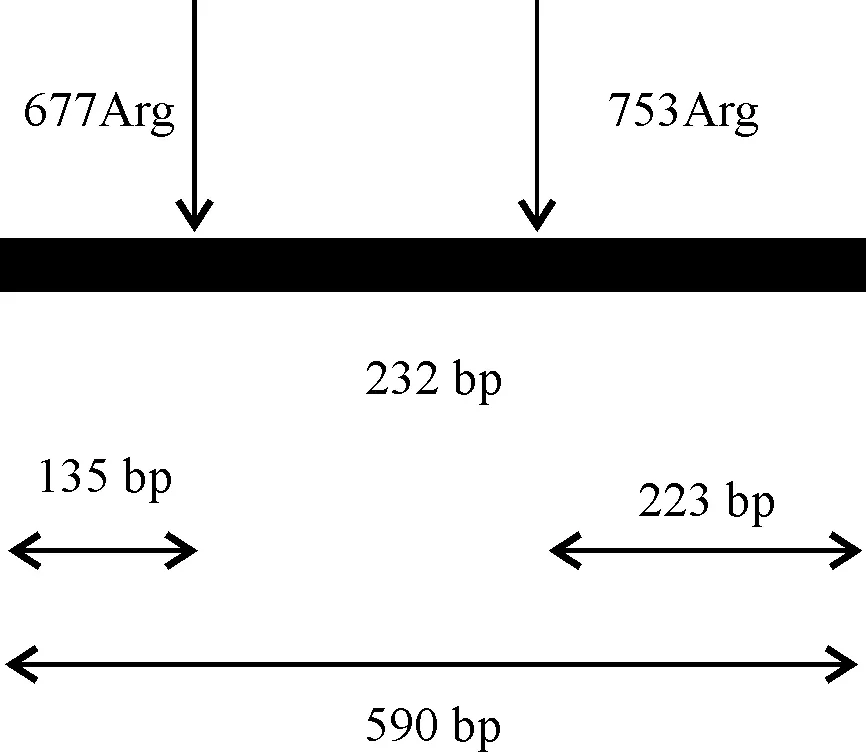
图1 TLR2 RFLP酶切示意图及片段酶切代表图, 箭头所指位点为 677及753位AciⅠ酶切位点Fig.1 Diagrams of TLR2 RFLP digestion and fragment digestion. The sites indicated by the arrows are the AciⅠ restriction site at 677 and 753.
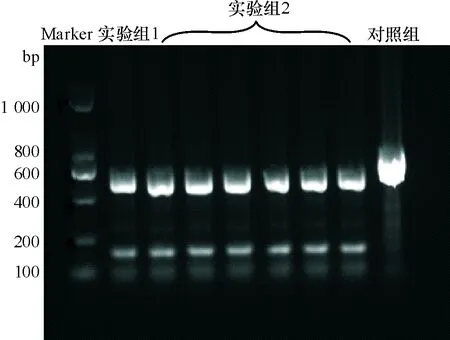
图2 PCR产物酶切结果Fig.2 Results of PCR product digestion.
使用MEGA软件,对实验组1、2以及对照组中TLR2 Arg677Trp和Arg753Gln两个易突变位点区测序序列比对后,发现所有的样本中677位点均未发生突变,其DNA序列为CGG;实验组2中RFLP结果示部分患者存在753位点突变,其DNA序列为CAG,由于缺失特异性GCGG,导致AciⅠ酶无法识别该位点进行酶切。测序比对见图3。
综合RFLP分析及DNA测序鉴定结果显示,对照组中无Arg753Gln基因多态性,实验组有1例(1%)Arg753Gln基因多态性,与对照组比较无明显差异(2=1.01,P=0.316);实验组2有6例(12%)出现Arg753Gln基因多态性,与对照组比较有明显差异(2=12.50,P<0.01)。

图3 样本中代表性TLR2 Arg677Trp和Arg753Gln 基因多态性测序分析Fig.3 Sequencing analysis of the TLR2 Arg677Trp and Arg753Gln gene polymorphism in the samples.
3 讨论
梅毒螺旋体(Treponemapallidum,TP)侵入人体产生两种抗体,一种是在TP破坏组织时释放的抗原性物质刺激机体产生类脂样IgM和 IgG抗体 (心磷脂抗体),为非特异性抗体[6],常用的检测方法有TRUST、快速血浆反应素试验(rapid plasma reagin test,RPR)等;TP侵入人体还会产生另一种针对TP表面抗原的特异性抗体,检测方法有TPPA等,用作梅毒确诊试验,通常认为这种特异性抗体在治疗后不发生变化,大多数患者将终生保持阳性。而TRUST或RPR的滴度在梅毒的病程中会有变化,尤其是早期梅毒治疗后滴度通常会下降4倍或以上,随着时间的延长也可能会阴转,然而有些患者长期保持不变化或变化不足4倍,则称为血清固定[7]。不同的临床研究显示梅毒患者治疗后出现的血清固定现象(TRUST和TPPA长期阳性)发生率在3.80%~56.20%之间[8-10]。另外,在长期随访或回顾性研究中,我们经常见到TPPA阳性而TRUST或RPR阴转的现象。已有的研究显示梅毒孕妇人群中TRUST阴转率约为1.81%~3.62%[11];而Rwmnowski等[12]的结果显示RPR阴转率较高,一期梅毒治疗3年后 RPR阴转率为72%,二期梅毒RPR阴转率约为56%[12]。除了现有的一些临床研究外,目前没有相关的基础研究解释梅毒治疗后出现的两种现象。
TLR2在梅毒免疫机制中有很重要的作用,机体感染TP后,树突细胞、单核细胞膜上的TLR2可识别TP的脂蛋白[13],经过天然免疫识别信号转导,启动获得性免疫,体内将发生一系列复杂的细胞免疫和体液免疫,不同患者临床表现不同、轻重不一,或为显发梅毒,或为潜伏梅毒;不同患者对治疗的反应性不同,血清学结果也有不同,具体形成机制不清楚。近来有研究认为梅毒的易感性可能与某些免疫相关基因存在关联[14-16]。TLR2基因位于人4号染色体上,其基因多态性会影响TLR2的表达,使TLR2信号传导受阻,从而改变疾病病程的发展[17]。已有实验研究证实 TLR2 Arg677Trp 和Arg753Gln 突变可导致 TLR2 功能障碍[18],这两个位点的基因多态性与莱姆病、麻风杆菌感染有密切关联[19-20]。梅毒规范治疗后,患者会出现血清学试验阳性的现象,易感基因是否在其中发挥作用目前尚无相关研究报道。
本研究采用PCR-RFLP及DNA测序法检测TLR2 Arg677Trp和Arg753Gln基因多态性,探讨该基因多态性与梅毒治疗后出现血清学阳性现象的关系,探索这种现象遗传易感性。初步研究结果显示,在梅毒血清固定、梅毒治疗后TPPA阳性TRUST阴性者及健康人中,均未检测到TLR2 Arg677Trp基因多态性,说明该位点与梅毒治疗后出现血清学阳性的现象可能无相关。在梅毒血清固定患者的实验组中只发现1例(1%)TLR2 Arg753Gln基因多态性,与对照组之间比较,差异并无统计学意义,提示TLR2 Arg753Gln基因多态性可能在梅毒治疗后出现血清固定现象的形成机制中无直接相关性,说明该现象免疫机制的复杂性以及与其它疾病的差异性;在梅毒规范治疗后TPPA阳性TRUST阴性者的实验组中有12%的患者出现TLR2 Arg753Gln基因多态性,与对照组比较,差异有统计学意义(P<0.05),提示该位点基因多态性与梅毒规范治疗后TPPA阳性TRUST阴性的现象可能相关。国内有学者对早期梅毒未治疗患者的TLR2基因多态性进行研究,未发现TLR2 Arg753Gln基因多态性与梅毒遗传易感性相关性[17],可能与该研究未将梅毒治疗后的患者进行分类分析有关。
本研究发现TLR2 Arg677Trp和Arg753Gln基因多态性与梅毒血清固定无相关性,与单一TPPA阳性的形成可能相关,但由于本研究的入组样本较少,可能会使结果产生偏倚,该结果的证实以及基因多态性与该现象形成关系的进一步评估,还需扩大样本量、更严格选择研究对象进行深入的研究。
