免疫沉积C3与IgA肾病临床病理特征的关系
2020-11-06陈卫东
潘 艳,陈卫东
IgA肾病是我国最常见的原发性肾小球疾病,多发生于中青年人,但也会发生于儿童及老年人,临床多表现为血尿、蛋白尿、肾病综合征、高血压及肾功能不全,是终末期肾脏病常见病因。IgA肾病作为一种病理诊断,其病理特征是IgA为主的免疫球蛋白及补体成分沉积在肾小球系膜区,同时伴有系膜细胞及系膜基质增生和/或肾间质及肾血管的病理改变。而它作为一种免疫炎症介导的肾小球肾炎,并不是“单一”病因疾病,其发病机制复杂,现在普遍认为它的发病机制是一种“多重打击”学说[1],其中涉及IgA的肾小球损伤与补体系统的激活有关[2],目前有研究[3]证明肾小球系膜区补体C3的沉积程度与IgA肾病的病情相关,能够用于判断病情,评估预后。本文就补体C3沉积程度对IgA肾病的诊断及评估病情的价值作一探讨。
1 资料与方法
1.1 一般资料 选取我科2013年6月至2018年6月经肾脏活检确诊的原发性IgA肾病病人43例作为研究对象,排除因系统性红斑狼疮、肿瘤、紫癜性肾炎、血液系统疾病等导致的IgA肾病病人以及乙肝、肝硬化、类风湿性关节炎、其他全身性疾病继发的肾脏损害病人。其中男20例,女23例,年龄27~46岁。IgA肾病组织病理学免疫荧光检测显示肾小球系膜区沉积物主要是IgA和补体C3,活检前所有病人均未服用免疫抑制剂和/或糖皮质激素。所有研究对象对本研究均知情同意并签署知情同意书。
1.2 研究方法
1.2.1 临床指标 临床指标包括血压(收缩压、舒张压);尿液检查项目镜下血尿、24 h 尿蛋白定量;血液检查项目肝肾功能白蛋白、血肌酐、尿素氮、尿酸、血糖;血脂成分胆固醇、三酰甘油、低密度脂蛋白、高密度脂蛋白;以及血清中免疫球蛋白 IgA、IgG、IgM,补体 C3、C4 水平,同时应用 2012 年改善全球肾脏病预后组织(KDIGO)指南推荐的CKD-EPI 公式,根据血肌酐水平估算肾小球滤过率(eGFR),以及相应的 CKD 分期[4]。
1.2.2 肾活检检查项目 病人行肾穿刺活检,经皮肾穿刺取得肾组织,石蜡包埋切片厚度2~3 μm,送检肾组织常规行:(1)苏木精-伊红(HE)、高碘酸-希夫(PAS)、过碘酸六胺银(PASM)、Masson 染色后进行光镜检查;(2)直接免疫荧光法检测免疫球蛋白IgA、IgG、IgM,补体C3、C4沉积强度和部位;(3)电镜检测,依据 IgA Lee分型病理指标评价病人病理改变程度。
1.2.3 肾活检病理资料处理 根据肾活检病理结果,采用三种评估方法,评价病人肾脏病理改变。(1) IgA肾病Lee分级方法:采用 1982 年 IgAN 病理分级标准 Lee′s分级[5],将肾脏的病理改变分为Ⅰ~Ⅴ级。(2)IgA肾病牛津分型[6]:包含5个病理参数,M系膜细胞增殖,E毛细血管内增生,S节段硬化和粘连,T肾皮质小管萎缩或间质纤维化。(3)参照 Katafuchi 的半定量法[7]分别对肾小球病变、肾小管间质病变及肾血管病变进行评分 。A:肾小球病变积分为 0~12分,包括系膜细胞和系膜基质增生程度(0~4分);节段性肾小球病变,如新月体形成、球囊壁粘连、节段性硬化和节段性毛细血管壁纤维素样坏死(0~4分);肾小球球性硬化(0~4分)。积分评定标准:无,1分; <25%,2分;25%~50%,3分;>50%,4分。B:肾小管间质积分0~9分,包括间质炎细胞浸润(0~3分)、间质纤维化(0~3分) 和肾小管萎缩(0~3分)。积分评定标准:无,1分;<25%,1分;25%~50%,2分;>50%,3分。C:血管积分,血管壁增厚和透明样变性,评定标准:无,0分;有,1分。
1.2.4 分组 按照系膜区C3沉积强度进行分组,(-)为阴性组;(±~+) 为弱阳性组;( 2+~3+) 为强阳性组。
1.3 统计学方法 采用方差分析、χ2检验、Pearson相关分析和Wilcoxon符号秩和检验。
2 结果
2.1 补体C3沉积程度与临床指标关系 根据系膜区补体C3沉积强度不同,分为阴性组、弱阳组和强阳组,3组病人分别为 10例(23.3%)、13例(30.2%)和20例(46.5%),在阴性组、弱阳组和强阳组中,随组织 C3 沉积加重,病人血肌酐、尿素氮升高,eGFR降低,组间比较差异有统计学意义(P<0.05~P<0.01)。而在尿酸、24 h尿蛋白定量及镜下血尿、血脂、血压、血糖差异无统计学意义(P>0.05)(见表1)。行Pearson相关分析显示,补体C3强度与免疫球蛋白及补体(血清+系膜区沉积强度)数值变化相反,但两者无显著相关性(P>0.05)(见表2)。
2.2 补体C3沉积程度与Lee分级关系 根据系膜区C3补体沉积强度,3组Lee分级差异有统计学意义(P<0.01)(见表3)。
2.3 补体C3沉积程度与牛津分类关系 根据牛津分类,可见补体C3沉积程度与系膜细胞增殖及毛细血管内皮细胞增生相关(P<0.05)(见表4)。
2.4 补体C3沉积程度与半定量病理积分关系 系膜细胞增殖、球性硬化及肾小管间质积分(包括间质炎性细胞浸润、间质纤维化、肾小管萎缩)差异有统计学意义(P<0.05),而节段损害及血管积分差异无统计学意义(P>0.05)(见表5)。

表1 各临床指标在3组中比较

表2 补体C3沉积程度与血清免疫指标、余免疫荧光沉积强度的相关性

表3 Lee分级在3组中比较(n)
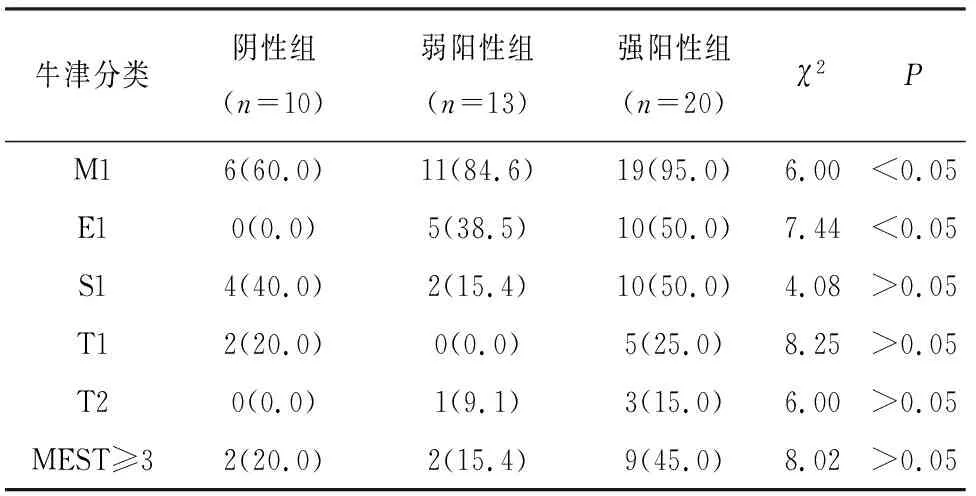
表4 牛津分类在3组中的比较[ n;百分率(%)]

表5 半定量病理积分在3组中的比较
3 讨论
IgA肾病作为中国最常见的慢性肾炎之一,是导致终末期肾病的常见原因。常见于上呼吸道感染后发病,其临床症状表现多样,病情发展不一,存在与病理严重程度不一致的情况。IgA肾病发病机制复杂,是免疫炎症介导的自身免疫性肾炎,同时补体系统激活是IgA肾病发病机制的重要环节。IgA肾病发病时常伴随系膜区不同程度的补体C3沉积,提示局部补体反应活跃,有研究[8-9]证明随着补体C3沉积加重,病人整体病情及预后较差。为了更好地评估病人病情,协助治疗,补体C3局部活化反应逐渐成为近年研究热点。
IgA肾病以大分子IgA在肾小球系膜区沉积为病理特点,行免疫染色时常见补体C3系膜区不同程度的沉积[9],提示补体活化可能参与IgA肾病的发病及进展过程。补体通过三种激活途径介导IgA肾病发生发展,而补体成分C3在其中发挥了一定作用。(1)从发病机制角度来说:IgA肾病涉及补体局部及全身激活,肾小球系膜区沉积的IgA以多聚体IgA1为主,直接激活旁路途径,活化系膜细胞产生大量炎症因子,上调肾脏C3过度表达,后者通过活性片段 C3b、C3d 促使T细胞增殖诱发炎症因子过度释放,两者恶性循环,进一步激活补体系统[9],加重肾脏损伤。IgA肾病病人中,90%以上存在补体C3的沉积;同时IgA肾病膜攻击复合物中可检测补体C3成分,证明补体系统参与了IgA肾病发病的多个环节。(2)补体C3与疾病进展相关:本研究发现,按照C3免疫荧光沉积程度进行分组,随着系膜区 C3的加重,病人血肌酐、尿素氮升高、eGFR 降低越明显,提示系膜区C3沉积强度能够反映IgA病人肾功能水平。CALISKAN等[10]研究表明,系膜区C3沉积的IgA肾病病人较无沉积病人相比,病人临床及预后都较差。KIM等[11]也在长期随访的病人中发现,系膜区C3沉积程度的增高是IgA肾病病人病情进展的危险因素,且与预后相关。(3)从病理角度分析:补体C3沉积程度与肾脏病理改变密切联系。根据IgA肾病的半定量积分分析:C3沉积程度不断加重,肾小球的系膜细胞增殖、球性硬化加重,同时间质炎性细胞浸润、间质纤维化、肾小管萎缩方面更为严重,证明补体C3沉积程度越重,病人肾脏病理变化越重。肾小球中C3的沉积与肾小球病理活动性病变相关,如系膜细胞增殖,间质炎性细胞浸润。究其原因,考虑IgA肾病存在补体过度活化,系膜区沉积的IgA1导致C3沉积,并形成膜攻击复合物[8],后者激活系膜细胞,通过细胞增殖、细胞外基质成分和细胞因子/趋化因子的过度产生诱导肾损伤[12]。C3沉积强度与肾小管萎缩及肾间质纤维化等IgA肾病病变的慢性指标也相关,补体异常活化会导致肾间质纤维化,IgA肾病肾间质浸润的肥大细胞明显增多[13],同时周边补体C3异常表达。C3受体调控肥大细胞活化、脱颗粒,后者所产生的炎症因子等多种生物学成分会诱导炎性反应,扩大炎性环境,诱导上皮间充质转分化;同时介导局部C3形成、调控C3水平升高,参与多种病理过程,最终导致肾间质纤维化发生[14-15]。分析牛津分类3组结果:可见补体C3沉积与系膜增殖及毛细血管内增生相关,系膜区C3可裂解形成C3c和C3b片断,C3b可再裂解成新的片断或免疫复合物再次攻击肾小球,与新月体、肾小球硬化、间质纤维化等提示预后差的病理指标相关。当然目前牛津分类纳入细胞或细胞纤维性新月体(C)指标,大部分IgA肾病进展缓慢,少部分快速进展到终末期肾病的病人,行肾活检病理提示新月体型IgA肾病,其中可检测到系膜区C3沉积明显升高[16],提示补体活化参与了IgA肾病的快速进展,而补体C3参与其中。
本研究结果显示,随着免疫沉积C3升高,血清C3逐渐下降,但两者无显著相关性。目前研究中也发现IgA肾病中补体C3沉积的病人,血C3水平可正常或降低,其中低C3血症的病人数目少于系膜区C3沉积的病人,以此推测 IgA肾病病人肾脏局部补体激活异常较全身严重。但因为本研究样本量少,有待进一步研究。
近几年如何评估IgA肾病预后引起了人们的重视,YANG等[17]研究表明系膜增生、肾小球节段硬化、肾小管萎缩和肾间质纤维化皆可提示不良预后,而新月体也被证明可作为独立的预测因素[6]。NASRI等[18]研究证明,C3沉积与血清肌酐有显著相关性,同时与新月体形成、系膜增殖、毛细血管增生、节段性肾小球硬化显著正相关。章晓炎等[19]也研究证实系膜区C3 沉积较多的IgA病人病理中毛细血管内细胞增生和间质纤维化更为严重,提示此类病人肾脏损害更重,预后更差。结合以上情况,肾活检补体行免疫染色可在一定程度上评估病人病情及预后。但本文作为横断面研究,此方面的研究还需不断地随访及收集材料,综合评估补体C3与IgA肾病整体预后的关系。而基于IgA肾病补体活化研究的不断深入,人们也考虑能否通过干预补体活化来缓解IgA肾病。晏现丽等[20]通过建立IgA肾病小鼠模型,证明C3a、C5a受体缺失确实会减轻IgA肾病损伤,考虑两者缺失会减少C3a及C5a与其结合的及机会,继而减少炎症因子及趋化因子的分泌,从而减轻肾损伤,其中C3a受体缺失减轻作用更明显。目前依库珠单抗(重组人源型C5单克隆抗体)和0MS-721(MASP2抑制剂)以抑制补体活化为靶点,已被试用于IgA肾病治疗领域[21]。
总之,补体C3活化在IgA肾病发病及进展机制起到了重要作用,激活程度明显影响IgA的临床和病理的损伤程度。应用肾组织补体C3染色作为IgA肾病病情监测及判断预后的指标,同时将干预补体活化作为今后的治疗策略,期望未来对IgA肾病补体的深入研究能促进IgA肾病临床诊断、监控和治疗策略的进一步完善。
