季铵化花生壳对Cr(Ⅵ)的吸附研究*
2020-11-05刘茹王春英黄晓霞
刘茹 王春英 黄晓霞
(嘉应学院化学与环境学院 广东梅州 514015)
0 引言
铬(Cr)是一种电镀、制革、化工等行业广泛使用的具有高毒性、高致癌和致突变能力的重金属污染物。Cr(Ⅵ)的毒性比Cr(Ⅲ)高出100~1 000倍。世界卫生组织规定引用水中Cr(Ⅵ)质量浓度不能超过50 μg/L[1]。常见Cr(Ⅵ)废水的处理方法主要有化学法、吸附法、电解法等。其中以废弃生物材料包括木屑、玉米芯、花生壳、板栗壳、辣椒秸秆等及其改性产品作为吸附剂吸附铬等重金属得到了越来越多的关注。
花生壳作为农作物的固体废物,其主要成分是纤维、半纤维、多酚类等高分子化合物,易于改性和化学修饰,通过化学改性引入活性基团,增强其吸附能力。研究人员通过采用酸改性[2]、化学修饰[3-4]等方法对花生壳进行改性,得到生物吸附剂在吸附方面表现优良。
本文用环氧氯丙烷、乙二胺、N,N-二甲基甲酰胺(DMF)、三乙胺和花生壳制备季铵化花生壳,考察季铵化花生壳对水中Cr(Ⅵ)的吸附,讨论吸附机理,为含Cr(Ⅵ)废水处理提供新材料。
1 实验部分
1.1 仪器与试剂
仪器设备:722s可见分光光度计(上海精科有限公司),AVATAR370智能型傅里叶红外光谱仪(美国Nicolet公司),Vario EL cube元素分析仪(德国Elementar公司),ME104E/02电子天平(梅特勒-托利多仪器(上海)有限公司),HN-WO恒温水(油)浴锅(郑州长城科工贸有限公司),DGX-9/43BC-1鼓风干燥箱(上海福玛实验设备有限公司),ZD-85恒温振荡器(江苏省金坛市环宇科学仪器厂),EMS-18C磁力搅拌器(天津市欧诺仪表有限公司),pHS-3F型pH计(上海精科有限公司)。
药品:环氧氯丙烷、三乙胺、乙二胺、N,N二甲基甲酰胺(DMF)、氢氧化钠、浓硫酸、浓盐酸、二苯碳酰二肼、重铬酸钾均为分析纯。
1.2 季铵化改性花生壳的制备
将花生壳洗净,于60 ℃下烘干,粉碎过380 μm筛后备用。称取处理后花生壳4.0 g加入20 mL环氧氯丙烷,25 mL N,N-二甲基甲酰胺于三口圆底烧瓶,于80 ℃反应1 h;之后缓慢加入1 mL乙二胺,在80 ℃反应45 min,最后加入10 mL三乙胺在80 ℃反应2 h,清洗、抽滤、干燥得到季铵化花生壳。
季铵化花生壳的合成过程中,花生壳中含有较丰富的纤维素和半纤维素,纤维素和半纤维素较难直接与三乙胺反应,用环氧氯丙烷作为交联剂与纤维素和半纤维素反应不仅提高反应活性还能增加纤维素醚的产量,纤维素醚中的环氧环打开后可以与乙二胺中的一个胺基有效地反应,乙二胺中的另一个胺基继续和环氧氯丙烷反应,最后三乙胺再与环氧氯丙烷反应,生成最终产物。
1.3 材料表征
1.3.1 等电点(pHzpc)
等电点(pHzpc)是指溶液当中固体表面的正负电荷相抵时所对应的溶液的pH[5]。材料的等电点通过测定溶液最终pHf值与初始pHi值之差随pHi变化的曲线在X轴上的交点来确定[6]。称取0.2 g材料加入40 mL,pHi值在2~12的0.1 mol/L KNO3溶液(0.1 mol/L HNO3和0.1 mol/L KOH 调节pH 值),保持离子强度不变,于恒温振荡器中振荡24 h,过滤,测定滤液最终pHf值[7]。
1.3.2 元素分析
使用德国Elementar公司 Vario EL cube型元素分析仪分析了材料中C,H,N 3种元素含量。
1.3.3 红外光谱分析
使用美国Nicolet公司AVATAR370智能型傅里叶红外光谱仪对季铵化前后材料进行表征。
1.4 吸附实验
称取0.1 g吸附剂,加入50 mL不同初始浓度和pH值的Cr(Ⅵ)溶液,一定振荡速率下振荡一定时间,过滤,使用国标法测定溶液中六价铬浓度,根据式(1)计算Cr(Ⅵ)的吸附量:
( 1 )
式中,q为吸附量,mg/g;C0为溶液初始质量浓度,mg/L;Ce为溶液平衡质量浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g。
2 结果与讨论
2.1 季铵化花生壳的表征
2.1.1 等电点分析
经等电点实验测定吸附前后溶液pH值的变化结果如图1所示。

图1 改性前后花生壳在KNO3溶液中pHzpc的测定
由图1可知,季铵化花生壳的pHzpc低于花生壳的pHzpc,表明在相同离子强度和pH值条件下,季铵化花生壳对H+及OH-离子的吸附能力高于花生壳,说明季铵化花生壳接枝上的胺基基团使得其表面带的电荷比花生壳的多,更有利于溶液中离子的吸附。
2.1.2 元素分析
C,H,N元素分析结果表明(表1),花生壳改性前后C,H的含量变化不明显,但N的含量比改性前提高了57.04%。这是因为花生壳在修饰过程中,与乙二胺、三乙胺反应后引入了胺基基团,因而季铵化花生壳中氮含量提高明显。

表1 花生壳改性前后元素含量变化情况 %
2.1.3 红外光谱分析
由花生壳改性前后的FTIR图谱分析, 3 360 cm-1处的吸收峰明显变宽变强,这是由于羟基的O—H的伸缩振动和氨基N—H的伸缩振动峰重叠而成[8],2 930 cm-1处出现的峰是亚甲基(—CH2)的特征吸收峰[9],在1 630 cm-1是N—H键的变形振动引起的。1 420 cm-1~1 260 cm-1吸收峰强度明显增加是由于C—N的伸缩振动引起的[10]。
由等电点、元素分析、红外光谱分析可知,吸附剂引入了胺基基团。
2.2 季铵化花生壳对Cr(Ⅵ)的吸附
2.2.1 pH值的影响
溶液的pH值直接影响吸附剂表面的电荷形态和吸附质水中存在的形态,是吸附重要的影响因素。因此实验重点考察了pH值对六价铬吸附的影响。溶液初始pH值1.0~12.0变化时,吸附剂对Cr(Ⅵ)的吸附量变化,结果见图2。

图2 初始pH值对吸附量的影响

2.2.2 Cr(Ⅵ)浓度的影响
由Cr(Ⅵ)吸附等温线(图3)可见,随着溶液中Cr(Ⅵ)浓度的增加,季铵化花生壳对Cr(Ⅵ)的吸附量呈先快速上升后缓慢增加,最终达到平衡。当Cr(Ⅵ)初始质量浓度达到800~1 000 mg/L时,最大吸附量为23.27 mg/g。这是因为一定质量的吸附剂,质子化的活性位点数是一定的,随着Cr(Ⅵ)浓度的增加,当所有的位点都被占据后,六价铬的吸附量达到最大。

图3 Cr(Ⅵ)吸附等温线
应用Langmuir和Freundlich等温吸附方程[11-12],对等温吸附数据进行分析,拟合方程见式(2)、式(3)。
(2)
(3)
式中,qm为最大吸附量,mg/g ;Ce为平衡质量浓度,mg/L;qe为平衡吸附量,mg/g;kL为吸附剂与污染物相互作用下的相关亲和力常数,L/mg;kF为Freundlich吸附能力常数, (L/mg)1/n;n为Freundlich吸附强度常数,n值通常用来判断吸附过程的难易程度;1/n值越小,吸附性能越好。一般认为1/n值为0.1~0.5时,易吸附;1/n值大于2时,则难吸附。
表2为吸附等温模型拟合参数,Ce/qe~Ce,lgqe~ lgCe线性拟合相关系数,其中Ce/qe~Ce线性拟合相关系数较好,线性相关系数为0.995>0.941,故对六价铬的吸附更符合L型等温吸附模型,说明季铵化花生壳对Cr(Ⅵ)的吸附属单分子层吸附,理论最大吸附量23.81 mg/g与实际值23.27 mg/g相接近。1/n为0.330<0.5,吸附过程属于易吸附。

表2 吸附等温模型拟合参数
2.2.3 时间的影响
吸附反应会随着吸附剂与吸附质接触的时间变化而变化,直至吸附达到平衡。加入固液比为0.1 g/50 mL的吸附剂和溶液,在25 ℃一定速率下搅拌,间隔一定时间移取0.15 mL溶液,测定浓度,计算吸附量,结果如图4所示。
由图4可知,吸附过程分为3个阶段,第一阶段吸附量快速上升,时间在5~20 min;第二阶段平稳上升,时间在30~90 min;第三阶段平衡,时间在120 ~150 min,此时 Cr(Ⅵ)的吸附达到平衡。因为,第一阶段,吸附剂表面的活性位点较多,吸附容易发生,所以0~20 min时吸附量迅速上升;第二阶段,附剂有效的活性位点越来越少,吸附在30~90 min时吸附量上升缓慢;第三阶段,随着吸附反应的进行已经吸附上的Cr(Ⅵ)对溶液中剩余的Cr(Ⅵ)产生排斥,阻碍溶液中Cr(Ⅵ)的进一步吸附,吸附达到平衡。

图4 吸附时间对吸附量的影响
采用Lagergren准一级和准二级速率方程[13]对吸附时间数据进行了拟合。拟合方程见式(4)、式(5)。
(4)
(5)
式中,qe为平衡吸附量, mg/g;qt为t时刻的吸附量, mg/g;k1为一级动力学方程速率常数,min-1;k2为二级动力学方程速率常数,g/(mg·min-1)。
表3中准二级速率方程R2为0.999 9优于0.722,拟合结果良好,可知Cr(Ⅵ)溶液在季铵化花生壳上的吸附动力学过程符合准二级速率方程。

表3 吸附动力学拟合方程
准二级速率方程包括吸附实验的所有过程,可以更准确地表述季铵化花生壳对Cr(Ⅵ)溶液的吸附机理。主要有以下步骤:①溶质从液体内部转移到吸附剂粒子表面;②溶质在吸附剂孔隙中扩散和粒子表面附着;③溶质与吸附剂表面的功能基团发生化学反应。在以上的步骤中会有一个步骤的阻力明显大于其他两个步骤,这一个步骤被称为吸附过程的速率控制步骤[14]。为了确认液膜扩散、粒子内部扩散、化学反应,哪个过程在吸附中起主导作用,对图4的数据作进一步分析,拟合方程见式(6)、式(7)、式(8)。
ln(1-F)=-kft
( 6 )
qt=kpt1/2
( 7 )
1-(1-F)1/3=krt
( 8 )
式中,kf,kp,kr为液膜扩散模型、粒子内部扩散模型和化学反应模型的速率常数;F(qt/qe) 为某一时刻吸附容量与平衡吸附容量的比值。
由表4可知,化学反应模型R2为0.895更接近1,但经化学反应模型拟合后直线不通过原点,说明化学反应过程是该吸附过程的主要控速步骤,但不是唯一的控速步骤。

表4 3种速率控制模型拟合方程
2.2.4 温度的影响
随着温度的升高,吸附量下降,实验结果如图5所示。振荡温度从25 ℃~40 ℃变化时,Cr(Ⅵ)的吸附量呈现下降趋势,说明吸附过程是一个放热过程。

图5 吸附温度对吸附量的影响
热力学参数△H,△G,△S值反映出吸附过程热力学能的变化,根据这些值的变化作为判断反应受温度的影响、反应能够自发进行以及反应混乱度的判据。计算公式见式(9)、式(10)、式(11)、式(12):
(9)
△G=-RTlnkc
(10)
(11)
(12)
式中,kc为平衡常数;Cad,e为平衡时溶质在吸附剂上的质量浓度,mg/L;Ce为平衡时溶液中溶质质量浓度,mg/L;R为理想气体常数,8.314 J/(mol·K);T为绝对温度,K。
由表5可知,不同温度下吸附过程的△G<0,说明吸附过程是自发进行的,同时△G的绝对值随着温度升高而减小,说明升温不利于该反应的进行;吸附过程的△H<0,说明该反应是一个放热反应,升温不利于吸附的进行,与实验结果相一致。在固液吸附体系中,同时存在吸附和解吸过程,吸附是熵减过程,解吸为熵增过程,吸附过程的熵变为两者之和[15]。吸附过程的△S<0,其原因为重铬酸钾在吸附剂表面吸附后,其分子从原来的三维空间自由运动变成限制在表面上的二维运动,运动的自由度减少[16]。可见,该反应是一个自发进行的放热反应。
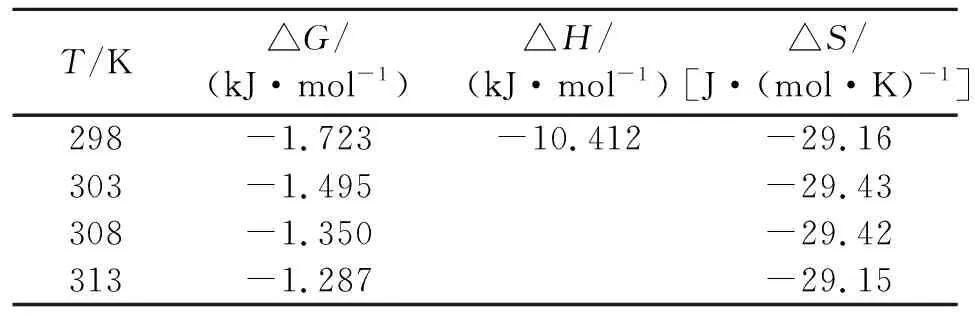
表5 不同温度吸附平衡热力学参数
3 结论
(1)制备的吸附剂引入了胺基基团,利于对阴离子的吸附。
(2)六价铬吸附受pH值、浓度、时间以及温度影响。实验最佳条件为,溶液pH值为3,振荡时间120 min,振荡温度为25 ℃,初始质量浓度为1 000 mg/L时,六价铬吸附量为23.27 mg/g。吸附量随着温度的升高而降低。
(3)应用等温方程、动力学方程、热力学方程分析吸附等温过程符合Langmuir等温方程的描述,吸附过程为单分子层吸附;吸附动力学过程符合准二级速率方程的描述,且化学反应过程是该吸附过程的主要但不是唯一的控速步骤;热力学方程计算结果△G<0,△H<0,△S<0表明吸附是自发进行的放热反应且是熵减过程。
