陶融型大曲微生物多样性与挥发性风味成分的相关性研究
2020-11-04陈蒙恩侯建光张振科韩素娜李建民陈伟平王二英胡晓龙
陈蒙恩,侯建光,张振科,韩素娜,李建民,陈伟平,王二英,胡晓龙
(1.河南仰韶酒业有限公司,河南 三门峡 472400;2.河南仰韶生物科技有限公司,河南 三门峡 472400;3.郑州轻工业大学,河南 郑州 450002)
中国白酒历史悠久,它是以高粱等谷物为原料,以酒曲为糖化发酵剂,经蒸煮、发酵、蒸馏等工艺而制成的,因此,酒曲在酿酒过程中扮演着重要的角色[1-3]。固态法白酒大多采用大曲作为糖化发酵剂,它蕴含了酿酒所需的多种微生物和酶,可促使原料发生糖化、发酵和产香等生化反应,从而赋予白酒独特的风味,而大曲中的微生物则是决定大曲品质的核心因素[4-7]。研究表明,大曲在白酒酿造过程中不仅提供了大量的酿酒功能微生物,其本身所含有的大量风味物质或其前体物质在酿造过程中亦可直接或间接地进入酒体,从而赋予白酒独特的风味,并对白酒的质量起到关键作用[1,5,8]。目前,对大曲的研究多趋向于单一的风味或微生物指标[9],而对微生物与风味成分之间的相关性以及如何基于现代检测手段,建立更加全面科学的大曲评价标准的研究较少。
以往对大曲微生物的研究多采用传统的分离培养方法[10],但该方法自身存在一定缺陷,无法全面地认识大曲中的微生物[11-12]。相比之下,高通量测序技术作为新一代测序手段,可方便快捷地对样品中复杂的微生物菌群结构进行分析[9,13-14],且高通量测序检测到的是样品中所有微生物的脱氧核糖核酸(deoxyribonucleic acid,DNA)序列,能够更加客观的反应样品中微生物群落结构的真实性[15]。目前,利用高通量技术对大曲中微生物群落结构进行分析,并进一步对大曲的挥发性风味成分进行相关性研究已有文献报道[16-17],但对陶融型大曲[18-19]微生物群落结构多样性与挥发性风味成分的相关性研究尚未见报道。
本研究采用高通量测序手段,对成品陶融型大曲的微生物群落结构多样性进行研究,得出陶融型大曲中主要的微生物群落构成,并与大曲的挥发性风味成分进行相关性分析,为解析陶融型大曲的生香机理及筛选优良酿造功能微生物提供坚实的理论依据;同时,可通过进一步研究,将个别优势酿酒功能微生物作为优质大曲的评判指标,结合原有评价体系,有望形成一套更加合理的大曲评价标准。
1 材料与方法
1.1 材料与试剂
1.1.1 大曲样品
对河南某公司夏季同时培养的4房陶融型大曲成品进行取样,大曲的培养时间为30 d,每房曲均采用四点中心法进行取样(大曲在入房培养室时对要取样的曲块进行标记,在大曲培养过程中进行翻曲、打拢、并房时仍将其放至指定位置),样品粉碎后过40目筛,采用四分法浓缩后至于无菌袋内4 ℃保存。
1.1.2 主要试剂
DNA Ladder 2000、DL 2000 TMDNA Marker:宝生物工程(大连)有限公司;Soil DNA Kit提取试剂盒:美国OMEGA公司;蛋白酶K、溶菌酶:美国Sigma公司;AxyPrep DNA凝胶回收试剂盒:美国AxyPrepDNA公司。
1.2 仪器与设备
SW-CJ-VS2 型超净工作台:无锡易纯净化设备有限公司;TGL-20M高速冷冻离心机:上海卢湘仪离心机仪器有限公司;NanoDrop 2000微量分光光度计:美国ThermoFisher公司;GeneAmp®9700 型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;MX-S型可调式混匀仪:美国SCILOGEX公司;QuantiFluorTM-ST 蓝色荧光定量系统:美国Promega公司。
1.3 方法
1.3.1 大曲挥发性风味成分检测
利用顶空固相微萃取及气相色谱-质谱联用技术(headspacesolidphasemicroextractionandgaschromatographymass spectrometry,HS-SPME-GC-MS)[20]对刚培养成熟的4房陶融型大曲的挥发性风味成分进行检测。
HS-SPME条件:准确称取3.0 g大曲样品置于20 mL顶空瓶中;孵化炉温度设为60 ℃,孵化10 min;萃取40 min;进样口温度设为260 ℃,解吸2 min;后自动进行GC-MS分析。
GC-MS条件:毛细管色谱柱为DB-FFAP(60m×250μm×0.25 μm),260 ℃条件下自动不分流进样;程序升温:35 ℃保持3 min,5 ℃/min升至100 ℃保持3 min,5 ℃/min升至150 ℃保持3min,10℃/min升至230℃保持3 min;载气:高纯度氦气(He),流速为1.00 mL/min;离子源:电子电离(electron ionization,EI)源,电子能量70 eV,传输线温度280 ℃,离子源温度300 ℃,扫描范围30~550 u。
定性及半定量:将大曲挥发性风味物质的质谱图与标准谱库(NIST05a.L)进行对比鉴定,匹配度>800的鉴定结果予以确认;以乙酸正丁酯为内标,将大曲样品中鉴定的挥发性化合物的浓度与乙酸丁酯质量浓度作比进行计算。
1.3.2 大曲微生物总DNA提取及PCR扩增定量
采用Soil DNA Kit对大曲微生物总基因组DNA进行提取,提取方法按照试剂公司提供的实验操作指南进行。利用NanoDrop 2000微量分光光度计对提取的微生物DNA浓度及纯度进行检测,将检测合格的DNA提取物置于-20 ℃备用。
PCR采用TransGen AP221-02,TransStart Fastpfu DNA聚合酶,20μL反应体系:5×FastPfuBuffer4μL,2.5mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)2 μL;正向引物(5μmol/L)0.8μL;反向引物(5μmol/L)0.8μL;FastPfu聚合酶0.4μL;牛血清蛋白(bovineserumalbumin,BSA)0.2 μL;Template DNA 10 ng;补双蒸水(ddH2O)至20 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,28个循环后;72 ℃延伸10 min,10 ℃保持至停止。每个样本按照正式实验进行3个重复,同一样本的扩增产物合并混合后进行电泳检测,采用AxyPrepDNA凝胶回收试剂盒对不同样本的PCR扩增产物进行切胶回收,Tris HCl洗脱;2%琼脂糖凝胶电泳检测,同时对不同大曲样本的PCR扩增产物进行荧光定量。
1.3.3 高通量测序与数据分析
样本的建库和测序由上海凌恩生物科技有限公司完成。高通量测序针对细菌16S rRNA基因515F_907R区域,真菌ITS1F_ITS2R区序列,设计带核苷酸便签[21]的特异引物,测序平台为Illumina MiSeq。通过双末端测序[22],将基因序列进行初级筛选,通过barcode找对应编号样本,去掉引物,再把质量差的序列剔除。通过提取优化序列中的非重复序列,降低分析中间过程冗余计算量(http://drive5.com/usearch/manual/dereplication.html);去除没有重复的单序列(http://drive5.com/usearch/manual/singletons.html);操作分类单元(operational taxonomic unit,OTU)聚类采用97%的相似性进行,去除嵌合体后得到OTU的代表序列。
1.3.4 相关性分析[23]
数据采用SPSS19.0软件进行统计分析、绘图采用Origin9.0软件、相关性分析采用SPSS19.0软件,显著性水平设定在5%。
2 结果与分析
2.1 大曲样品中挥发性风味成分检测
对刚培养成熟的4房陶融型大曲的挥发性风味成分进行检测,结果见表1。由表1可知,4房大曲共检测到45种挥发性风味成分,分为9类,其中酯类化合物种类及含量最高(17种,含量为331.92 μg/g),其次是醇类化合物(7种,含量为273.34 μg/g)、芳香族类化合物(3种,含量为184.88 μg/g)和吡嗪类化合物(4种,含量为65.99 μg/g)。
2.2 高通量原始数据获取及统计学分析[24-25]
通过Illumina PE250高通量测序筛选获取有效基因组序列信息,测序数据统计见表2。由表2可知,经过分析统计,4房大曲样品共获得细菌有效序列145 532条,平均长度在370 bp以上,测序长度主要分布在351~400 bp(99.98%)之间,与设计引物扩增长度接近,由此判断测序结果较好。共获得真菌有效序列149 091条,平均长度约为280 bp,测序长度集中分布在251~300 bp,与设计引物扩增序列长度为300 bp左右较接近,说明本次测序结果较合理,保证了足够的测序数量,可以满足后续的数据分析。
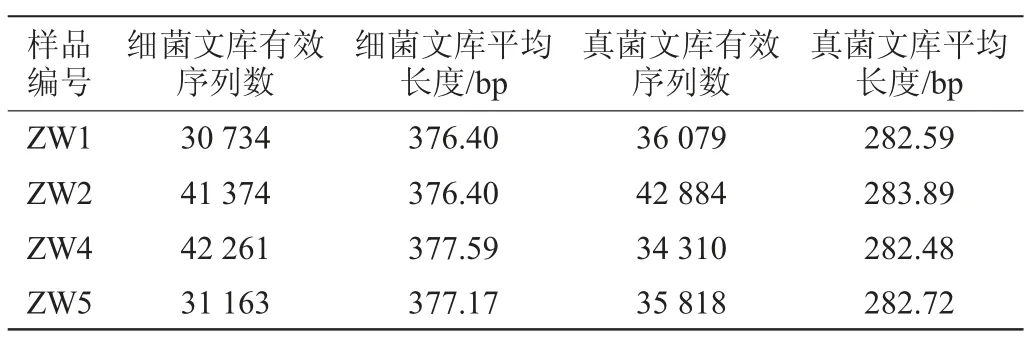
表2 文库测序情况数据统计Table 2 Statistics of sequences data
2.3 大曲微生物聚类
稀释曲线可以用来比较测序数据量不同的样本中物种的丰富度,当曲线趋向平缓时,更多的数据量只会产生少量新的OTU,反之则表明继续测序还可能产生较多新的OTU[16]。对不同样品之间共有的以及独有的OTU数进行叠加,得出4个大曲样本中微生物OTU分布的Venn图[26-28]见图1。由图1可知,4房陶融型大曲中共获得细菌OTU数目为68个,其中共同拥有的OTU数目为44个,占OTU总数的65%;共获得真菌OTU数目为47个,其中共同拥有的OTU数目为25个,占OTU总数的53%。
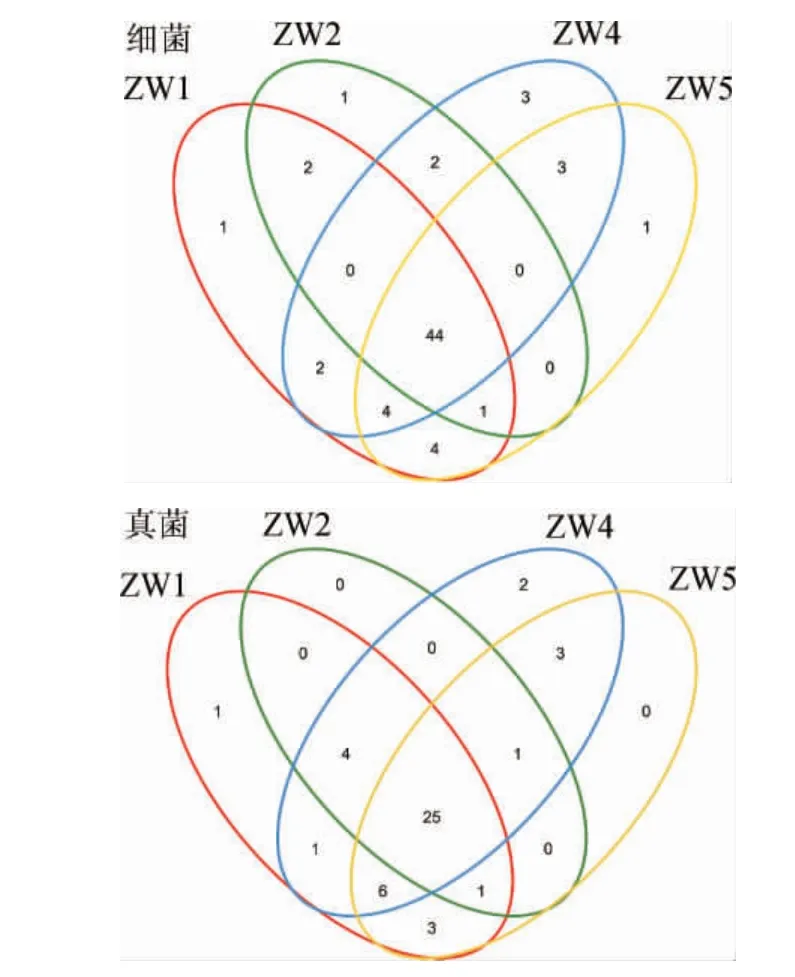
图1 大曲文库内OTU的韦恩图Fig.1 Venn diagram of OTUs of Daqu libraries
2.4 Shannon指数和Rank指数分析
为研究样品的取样量能否代表原样品物种丰富度,对样品的个数和物种的种类做稀释分布曲线[29-30],从而评估所构建的文库的覆盖率是否达到饱和,结果见图2;以97%的序列相似度水平作为OTU的界定,通过分析样品的OTU数目及分布情况,来反映样品中所含种群的多样性及丰富度;通过Shannon指数[31]反映样本中微生物多样性;Rank-Abundance[32]来解释样品物种丰度和物种均匀度,结果见图3、图4。
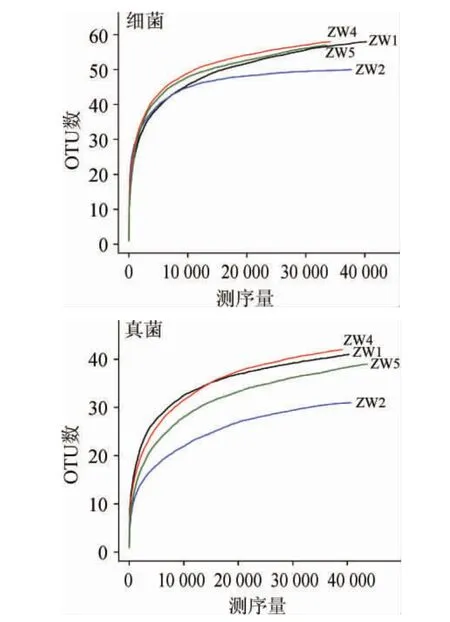
图2 样品稀释性曲线Fig.2 Rarefaction curve of samples

图3 样本的Shannon曲线Fig.3 Shannon curves of samples
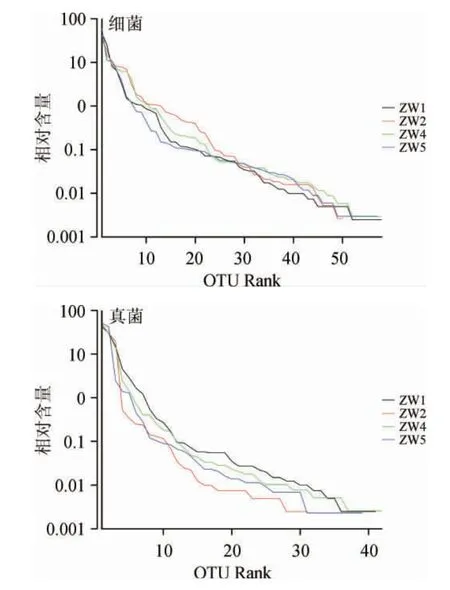
图4 OTU等级丰度曲线Fig.4 OTU rank-abundance curves
根据图2和图3的结果可得,各曲样的稀释性曲线和Shannon曲线都随测序深度的增加呈现先增加后趋于平缓的趋势,这表明测序数据量合理,测序深度能够反映出样品中绝大多数微生物的物种信息。图2中细菌文库内OTU数目表现为ZW4>ZW5>ZW1>ZW2;真菌文库的OTU数目表现为ZW4>ZW1>ZW5>ZW2,与细菌文库基本一致。从Rank-abundance曲线(图4)可以看出,细菌微生物多样性丰度及均匀度均高于真菌。
2.5 陶融型大曲群落结构组成
对大曲样品中微生物OTUs信息丰度进行加权聚类分析[33-34],结果见图5、图6。由图5、图6可知,从获得的145 532条大曲细菌优质序列中可以归类到7个门,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、梭杆菌门(Fusobacteria)、未分类细菌(Bacteria-Unclassified)。其中变形菌门、厚壁菌门和放线菌门占比较大,分别为52.22%、41.51%和2.52%,厚壁菌门为大曲中的优势微生物,可能是优势细菌属属于该门,且厚壁菌门主要由芽孢杆菌纲(Bacilli)和梭菌纲(Clostridia)等微生物组成[35],具有很强的环境适应性,能够在相对极端的条件保持生长代谢;放线菌广泛分布于土壤环境、海洋环境、植物体及其他极端自然生态环境中,和厚壁菌门相似,也具有极强的耐受性[36]。从获得的149 091条大曲真菌优质序列中可以归类到3个门,分别为子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)。其中子囊菌门真菌占比最大,达99.38%,接合菌门和担子菌门共占0.62%。
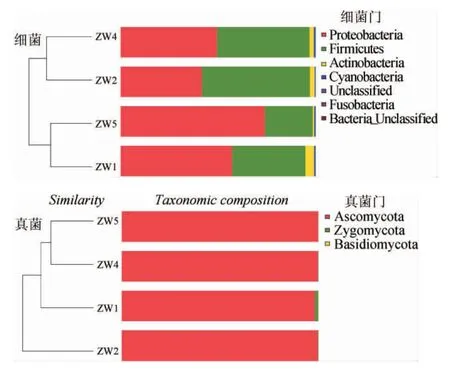
图5 聚类树与柱状图组合Fig.5 Cluster tree and histogram combination
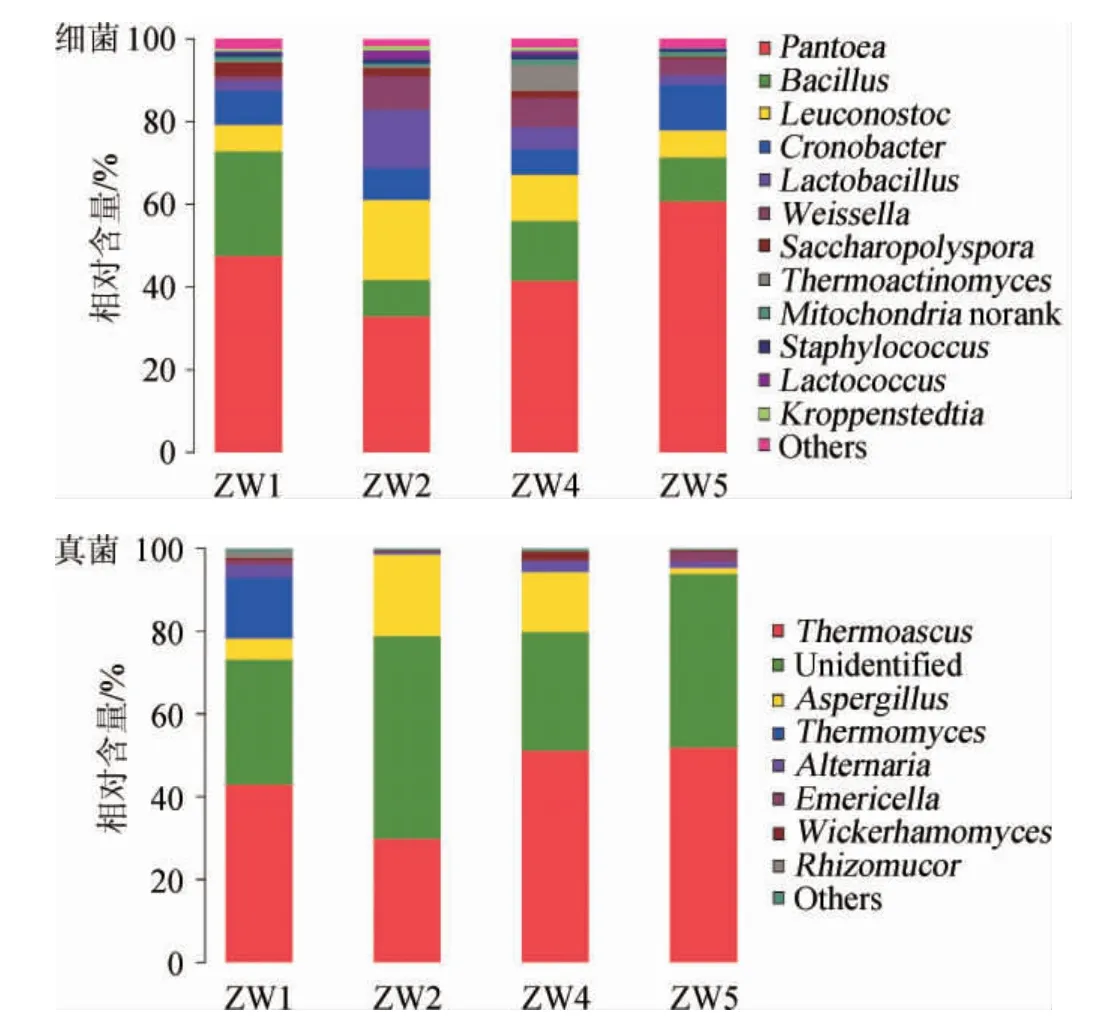
图6 微生物群落结构Fig.6 Structure of microbial community
在属的水平上细菌共得到40个属,将丰度低于1%的合并为一类(Others),由图6可知,4个曲样中丰度较高的为泛菌属(Pantoea,45.32%)、芽孢杆菌属(Bacillus,15.15%)、明串珠菌属(Leuconostoc,10.89%)、克罗诺杆菌属(Cronobacter,8.36%)、乳杆菌属(Lactobacillus,6.02%)、魏斯氏菌属(Weissella,5.02%)、糖多孢菌属(Saccharopolyspora,1.88%)、嗜热放线菌(Thermoactinomyces,1.63%)、克罗彭斯特菌属(Kroppenstedtia,1.58%)、葡萄球菌属(Staphylococcus,1.02%)、Mitochondrianorank(1.08%)、乳球菌属(Lactococcus,0.86%)。4个曲样的优势细菌属为泛菌属、芽孢杆菌属、明串珠菌属、克罗诺杆菌属、乳杆菌属和魏斯氏菌属。
4个曲样中,在属的水平上真菌OTU可归为28个属。真菌群落丰度不如细菌群落,是因为大曲在培养过程中顶火温度超过50 ℃,致使大部分真菌死亡,只有少部分耐热和嗜热真菌得以存活[37-38]。4个曲样中的优势真菌属为嗜热子囊菌属(Thermoascus,44.07%)、Unidentified(37.58%)、曲霉属(Aspergillus,10.04%)、嗜热真菌属(Thermomyces,3.79%)、链格孢霉属(Alternaria,1.78%)、泡波曲霉属(Emericella,1.02%)、威克汉姆酵母(Wickerhamomyces,0.78%)、根毛霉属(Rhizomucor,0.42%)。
2.6 优势微生物与大曲风味物质的相关性分析
大曲优势微生物与风味物质的相关性分析结果见表3。由表3可知,芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)与吡嗪类、芳香族类、酸类、酯类均呈显著正相关性(P<0.05),芽孢杆菌等耐热微生物是大曲中吡嗪类、芳香族类等风味物质的主要产生菌,在其他学者的研究成果中已有报道[39-43],这与本研究结果保持一致;魏斯氏菌属(Weissella)与吡嗪类、酮类、酸类、酯类均呈显著正相关性(P<0.05),这与现有文献相一致[44]。通过对大曲中的微生物和挥发性风味成分进行相关性分析,结合传统感官对大曲的认识,能够找到感官指标与微生物形态呈现的关系,如果通过进一步研究,将个别优势微生物作为大曲评判的指标,结合原有评价体系,能够形成一套对大曲更加合理的评价标准。
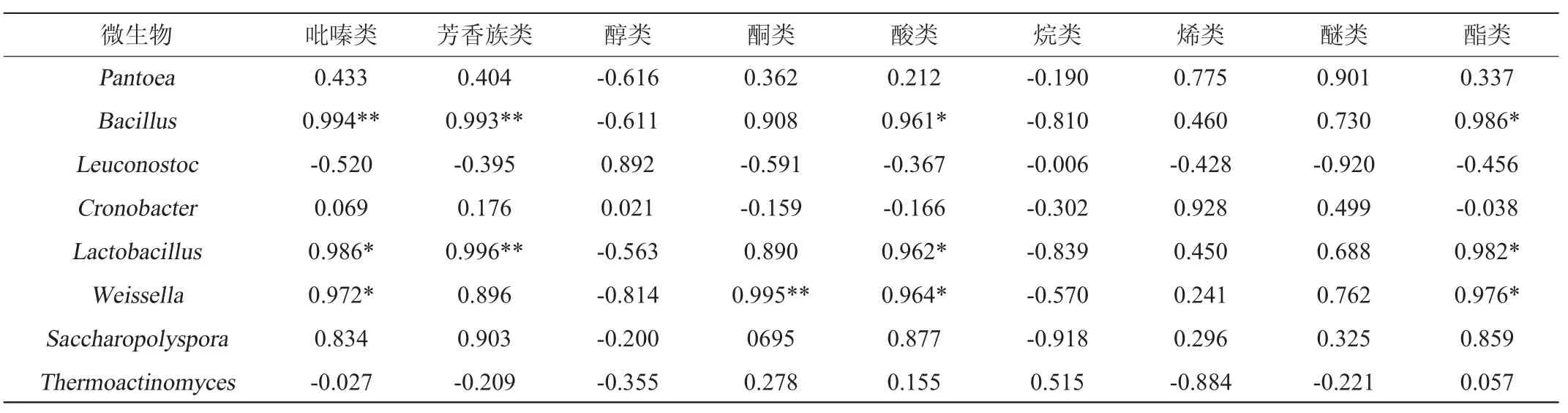
表3 微生物与风味成分的相关性Table 3 Correlation between microbe and flavor component
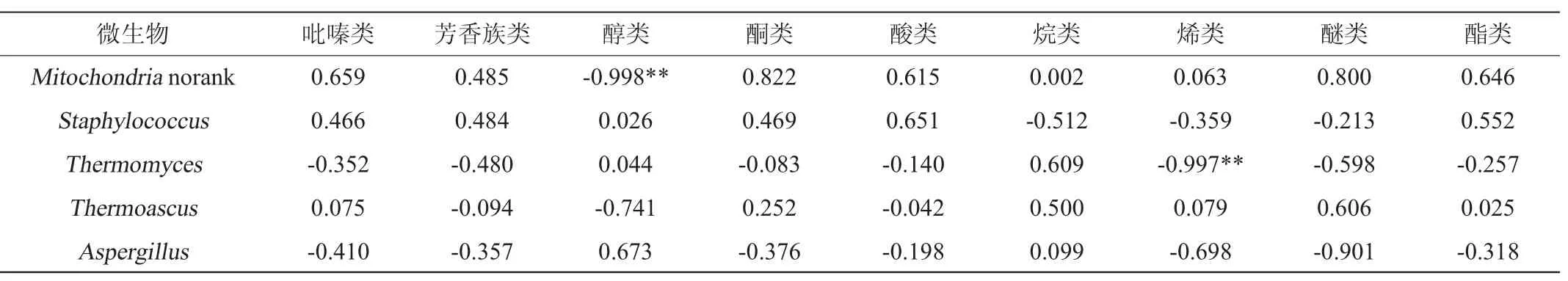
续表
3 结论
大曲是白酒酿造中功能微生物的主要来源,大曲微生物群落结构的组成往往决定着白酒的质量。本研究利用高通量测序技术对成品陶融型大曲的微生物群落结构进行了系统研究,结果表明,刚出房的成品陶融型大曲中细菌的物种多样性高于真菌,大曲中共检测到细菌OTU数为68,真菌OTU数为47。微生物丰度统计表明,大曲细菌优势菌属主要为泛菌属、芽孢杆菌属、明串珠菌属、克罗诺杆菌属、乳杆菌属和魏斯氏菌属六大类,六类菌属共占大曲细菌多样性的90.76%,同时还检测到了糖多孢菌属、嗜热放线菌、Mitochondrianorank、乳球菌属等;大曲的优势菌属主要为嗜热子囊菌属、曲霉属、嗜热真菌属、链格孢霉属、泡波曲霉属五大类,五类菌属共占大曲真菌多样性的60.70%,同时还检测到了链格孢霉属、泡波曲霉属、威克汉姆酵母、根毛霉属等。相关性分析结果表明,大曲中厚壁菌门下的芽孢杆菌属、乳杆菌属与大曲中吡嗪类、酯类、芳香族类等多数挥发性风味成分呈显著正相关性,说明这两类微生物是大曲制作过程中风味物质的主要产生菌,这与以往其他学者的研究结果相一致。
开放的制作环境是大曲微生物的主要来源,独特的制曲工艺和地域菌群环境是造酒陶融型大曲特有微生物菌群构成的根本。因此,对大曲微生物群落结构的构成及大曲挥发性风味成分的相关性进行系统研究,将有助于解析陶融型白酒典型风格的成因。同时,可结合大曲传统的感官评价体系,将个别优势酿酒功能微生物作为大曲评判的指标,有望形成一套对大曲更加合理的评价标准。该研究结果为解析陶融型大曲挥发性风味物质的形成机理及完善大曲质量评价标准提供了新的视角。
