CD4-CD8-双阴性T 淋巴细胞在视神经脊髓炎谱系疾病与多发性硬化中的表达差异
2020-11-04沙晶杨丽娟玛依努尔买买提李红燕
沙晶 杨丽娟 玛依努尔·买买提 李红燕
视神经脊髓炎谱系疾病(NMOSDs)是一类主要由B 淋巴细胞(B 细胞)和抗体介导的中枢神经系统自身免疫性疾病[1],表现为视神经和脊髓炎性脱髓鞘改变,以视神经和脊髓同时或相继受累为主要临床特征,呈复发-缓解病程,在反复发作后可遗留严重的神经功能缺损。多发性硬化亦是一类主要由细胞免疫介导的中枢神经系统自身免疫性疾病,主要表现为白质脱髓鞘改变[2],因此NMOSDs 最初被认为是多发性硬化(MS)的一种亚型[3]。然而,自2004 年Lennon 等[4]首次确认 水 通道蛋白4(AQP4)抗体是NMOSDs 的特异性抗体以来,越来越多的学者意识到NMOSDs 的免疫学机制可能与多发性硬化并不一致。研究表明,淋巴细胞参与NMOSDs 发病与疾病演变的全过程,疾病早期T 淋巴细胞(T 细胞)浸润靶器官和组织,随着病情进展至中晚期B 细胞介入并产生相应抗体,诱导免疫炎症反应。CD4-CD8-双阴性T 淋巴细胞(DNT)仅占外周血T 细胞的1%~2%[5],主要由T 细胞受体αβ和γδ(TCRαβ和TCRγδ)等亚群组成,源自CD4+T 细胞和CD8+T 细胞或特殊细胞谱系[6],可能参与不同自身免疫性疾病的发病机制[7],迄今尚无有关DNT 在NMOSDs 和多发性硬化两种疾病中表达差异的研究报道。鉴于此,本研究对新疆维吾尔自治区人民医院近3 年诊断与治疗的53 例NMOSDs 和20 例多发性硬化患者的临床资料进行回顾分析,通过分析CD4-CD8-DNT 细胞数目,探讨CD4-CD8-DNT 在两种疾病中的表达差异。
对象与方法
一、研究对象
1. 纳入与排除标准 (1)NMOSDs 诊断符合2015 年《NMOSDs 国际共识诊断标准》[8],多发性硬化符合2017 年McDonald 诊断标准[9]。(2)患者入院至采集血液标本时间<24 h,且在采集脑脊液和血液样本之前均未曾接受过皮质类固醇激素、免疫球蛋白或其他免疫抑制剂治疗。(3)所有入组患者性别、年龄、诱因、临床症状和基线数据等临床资料完整。(4)新发神经功能缺损症状持续时间≥24 h,且距前次发作≥30 d[10]。(5)凡存在以下情况者均非本研究纳入对象:同时合并结缔组织病和(或)其他自身免疫性疾病、肿瘤、感染、获得性免疫缺陷综合征及其他传染性疾病,以及临床和实验室数据不完整者。
2.一般资料 选择2017 年1 月至2019 年12 月在我院神经内科住院治疗的53 例NMOSDs 和20 例多发性硬化急性期患者。(1)NMOSDs 组:53 例,男性19 例,女性34 例;发病年龄16 ~66 岁,平均(36.72±17.04)岁;病 程 为1 ~8 年,中 位 病 程1.50(1.00,4.00)年。(2)MS 组:20 例,男性4 例,女性16 例;发病年龄为25 ~42 岁,平均(33.18±5.46)岁;病程为1 ~14 年,中位病程7.00(1.50,11.00)年。(3)正常对照组:选择同期在我院进行体格检查的健康志愿者共27 例,男性13 例,女性14 例;年龄18 ~45 岁,平均(35.25±15.05)岁。3 组受试者性别(χ2=3.952,P=0.139)和年龄(F=5.799,P=0.571)差异无统计学意义,NMOSDs 组与MS 组患者病程差异亦无统计学意义(Z=21.000,P=0.081),具有可比性。
二、研究方法
1.常规实验室指标检测 患者入院24 h 内采集外周静脉血3 ~5 ml,排除腰椎穿刺禁忌证后留取脑脊液3 ~5 ml,仪器分析法测定红细胞计数[(4.00 ~5.50)×1012/L]、白细胞计数[(3.50 ~9.50)×109/L]、中性粒细胞计数[(1.80 ~6.30)×109/L];免疫层析法测定C-反应蛋白(0 ~8 mg/L);酶耦联法测定丙氨酸转氨酶(7 ~45 U/L)、天冬氨酸转氨酶(13 ~40 U/L);反应速率法测定血尿素氮(2.50 ~7.50 mmol/L)、肌酐(41 ~73 μmol/L);免疫比浊法测定补体C3(0.80 ~1.20 g/L)、C4(0.10 ~0.40 g/L),间接免疫荧光法测定抗核抗体、抗双链DNA 抗体;蛋白定量分析法测定血清和脑脊液寡克隆区带(OCB),细胞免疫荧光法(CBA)测定血清和脑脊液髓鞘少突胶质细胞糖蛋白(MOG)抗体、髓鞘碱性蛋白(MBP)抗体以及AQP4抗体。
2.流式细胞术测定DNT 细胞数目 (1)主要试剂与仪器:免疫试剂Ⅰ抗工作液[含多甲藻黄素叶绿素蛋白(PerCP)标记的小鼠抗人CD3 单克隆抗体(CD3-PerCP)、异硫氰酸荧光素(FITC)标记的小鼠抗人CD4 单克隆抗体(CD4-FITC)和藻红蛋白(PE)标记的小鼠抗人CD8 单克隆抗体(CD8-PE)],溶血素均购自美国BD 公司。BY-80C 型离心机由北京白洋医疗器械有限公司提供,FACS Canto Plus 流式细胞仪为美国BD 公司产品。(2)检测方法:将采集的外周静脉血标本置于含有乙二胺四乙酸(EDTA)抗凝剂的EP 管,6 h 内分别滴加CD3-PerCP(20 μl)、CD4-FITC(20 μl)和CD8-PE(20 μl),混匀、室温避光孵育15 min,加入溶血素(2 ml)10 min 后于离心半径5 cm、转速1500 r/min 离心5 min,去上清液,磷酸盐缓冲液2 ml 洗涤,再于离心半径5 cm、转速1500 r/min 离心5 min,去上清液、加入磷酸盐缓冲液(500 μl)重悬细胞,流式细胞术测定CD4-CD8-DNT细胞数目,FlowJo v10.0 软件进行数据分析。
3.神经功能缺损程度评价 入院后24 h 采用扩展残疾状态量表(EDSS)[11]进行残疾程度评价,包括视觉功能(6 分)、脑干功能(5 分)、锥体功能(6 分)、小脑功能(5 分)、感觉功能(6 分)、膀胱和直肠功能(6 分)、大脑功能(5 分)及行动(6.50 分)共8 项内容,每项评分经转化后计为总评分,总评分10 分,评分越高、残疾程度越严重。
4. 统计分析方法 本研究采用SPSS 22.0 统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验。呈正态分布的计量资料以均数±标准差(x±s)表示,采用两独立样本的t检验或单因素方差分析,两两比较采用LSD-t检验;呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,行Mann-WhitneyU检验或Kruskal-Wallis 检验(H检验),两两比较行Mann-WhitneyU检验。以P≤0.05 为差异具有统计学意义。
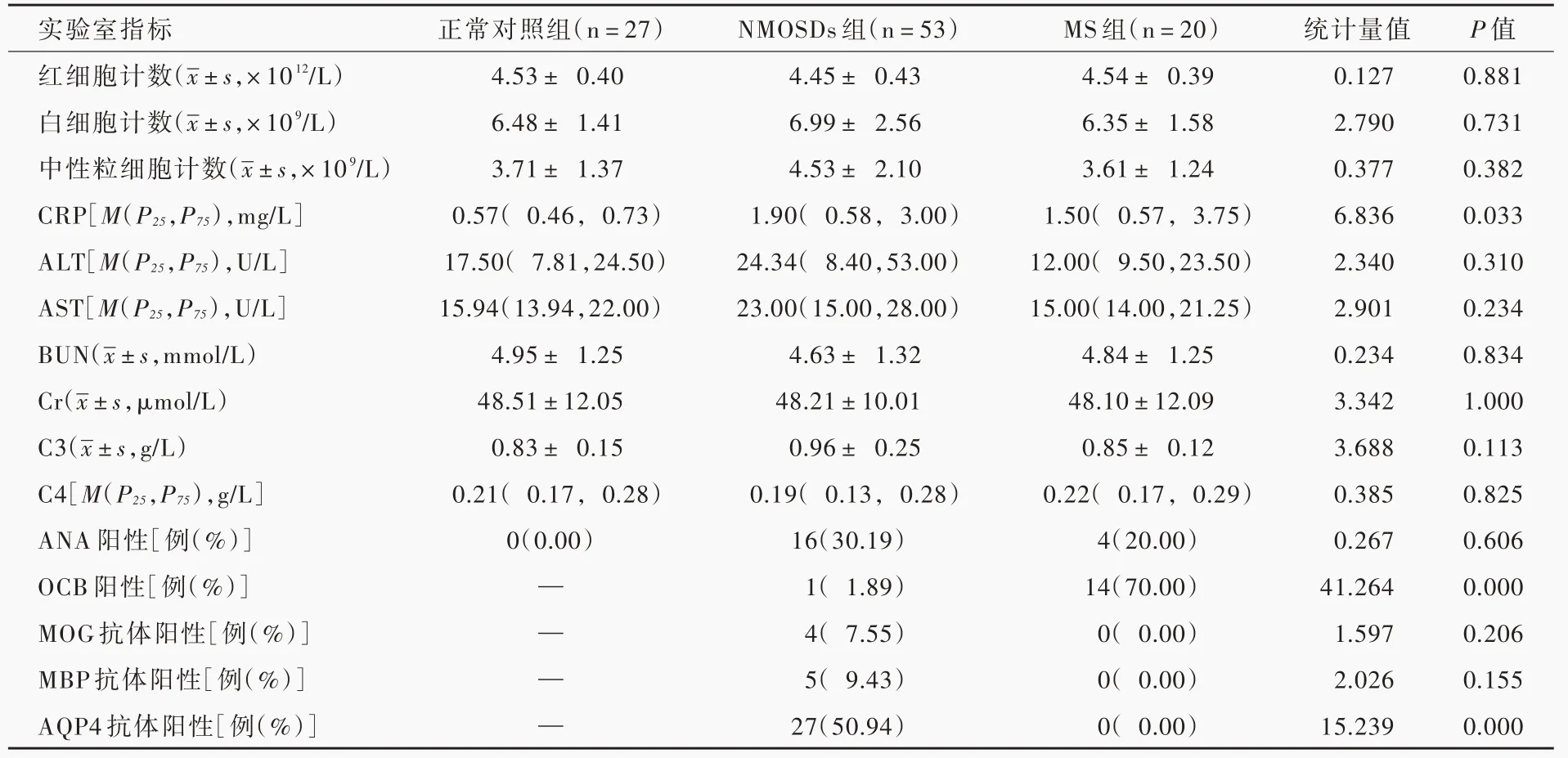
表1 各组受试者常规实验室指标的比较Table 1. Comparison of the laboratory indicators of the 3 groups
结 果
对各组受试者实验室指标比较,血清C-反应蛋白差异具有统计学意义(P=0.033),其中NMOSDs 组高于正常对照组(Z=1.456,P=0.029),但与多发性硬化组之间差异无统计学意义(Z= 0.312,P=1.000);多发性硬化组血清寡克隆区带阳性率高于NMOSDs 组(P=0.000);NMOSDs 组血清AQP4 抗体阳性率高于多发性硬化组(P=0.000);其余各项指标组间差异无统计学意义(均P> 0.05,表1)。NMOSDs 组EDSS 评分为1 ~8 分、中位评分2.50(2.00,6.50)分,多发性硬化组EDSS 评分2 ~6 分、中位评分4.50(2.75,5.25)分,组间差异有统计学意义(Z=45.000,P=0.700)。
各组受试者外周血DNT 细胞数目差异有统计学意义(P=0.015),其中NMOSDs 组DNT 细胞数目分别高于正常对照组(P= 0.018)和MS 组(P=0.023),而MS 组与正常对照组DNT 细胞数目差异无统计学意义(P=0.881;表2,3)。
讨 论
AQP4 抗体的发现让人们逐渐认识到,由B 细胞介导的体液免疫在NMOSDs 的发病机制中发挥至关重要的作用[11],但是目前针对外周血B 细胞的治疗药物如利妥昔单抗等尚无法完全阻止NMOSDs 的进展[12],表明B 细胞介导的体液免疫并非唯一致病因素,T 细胞介导的细胞免疫或其他免疫因素也参与其中且发挥重要作用。本研究结果显示,NMOSDs患者外周血DNT 细胞数目高于正常对照者和多发性硬化患者,据此推测外周血DNT 细胞数目增加可能提示NMOSDs 处于疾病的急性期。

表2 各组受试者外周血DNT 细胞数目的比较(x±s,×106/L)Table 2. Comparison of the number of DNT cells in NMOSDs group, MS group and control group (x±s, ×106/L)
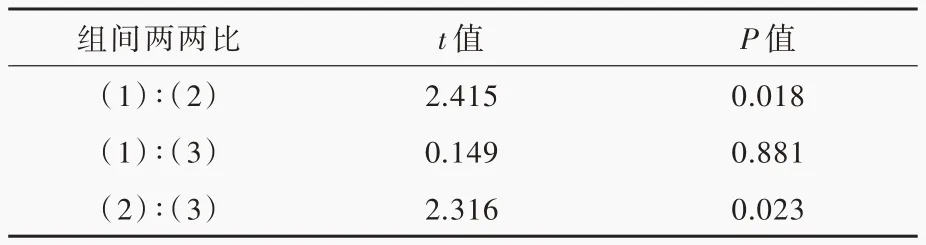
表3 各组受试者外周血DNT 细胞数目的两两比较Table 3. Pairewise comparison of the number of DNT cells in NMOSDs group, MS group and control group
目前,对于DNT 细胞的起源及其在免疫机制中的作用尚未完全阐明。DNT 细胞因表面分子不同而表达多样,可分泌大量细胞因子,提示其不同来源或分化途径[13]。有文献报道,外周血DNT 细胞主要来源于胸腺和脾[14],较少来源于不依赖胸腺的途径,如活化的外周血CD4+和(或)CD8+T 细胞[15]。Priatel 等[16]研究显示,T 细胞受体(TCR)信号强度是DNT 细胞发育的重要因素,较低强度的TCR 信号可诱导生成成熟的CD4+和(或)CD8+T 细胞,而较高强度的TCR 信号则对胸腺DNT 细胞的存活或逃逸具有促进作用。正常人外周血中亦可以检出DNT 细胞,通常少于总淋巴细胞的2.5%[13],但是这一小部分DNT 细胞具有同源异质性,分别表达TCRγδ和TCRαβ[13,17]。目前对于DNT 细胞的病理生理学机制尚不完全清楚,有证据显示其可以识别寄生虫、细菌(尤其是分枝杆菌)或应激的哺乳动物细胞表达的应激蛋白和热休克蛋白(HSP)[6]。2019 年来自德国的一项研究显示,DNT 很可能通过作用于T 细胞的哺乳动物雷帕霉素靶蛋白(mTOR)以影响其代谢和功能[18]。因此,DNT 细胞可能通过识别自身应激反应所诱导的分子在自身免疫性疾病中发挥重要作用[19]。
在本研究中,NMOSDs 急性期患者外周血DNT细胞数目增加,而多发性硬化患者则无明显改变,提示DNT 细胞可能参与NMOSDs 的发病机制。临床上NMOSDs 患者表现出的更高的复发率和更快的疾病进展速度,亦不能完全排除与DNT 细胞相关。目前,国内外尚无关于DNT 细胞在NMOSDs 中表达变化的研究,但有些学者已经开始关注DNT 细胞在自身免疫性疾病中的作用机制。Reinhardt 和Melms[20]在重症肌无力(MG)患者的外周血中检测到DNT 细胞,并发现切除胸腺瘤后DNT 细胞数目可随乙酰胆碱受体(AChR)抗体滴度的下降和临床症状的好转而逐渐恢复正常,高度提示DNT 细胞参与免疫调节机制。Crispín 和Tsokos[21]发现,系统性红斑狼疮患者外周血DNT 细胞数目显著增加,同时可促进白细胞介素-17(IL-17)的分泌。而最新研究显示,系统性红斑狼疮发病后紊乱的细胞因子和凋亡碎片可以导致CD8 细胞向DNT 细胞转变,同时促进IL-17 的生成[22]。一项针对自身免疫性淋巴细胞增生综合征(ALPS)的研究显示,外周血DNT 细胞比例从1%增至40%[17]。上述研究均表明,DNT 细胞具有通过调节免疫和炎症稳态的多种功能在系统性自身免疫性疾病的发病中发挥作用。然而,DNT 细胞在中枢神经系统的作用仍未知。Matsumoto 等[23]于1996 年最早描述了自身免疫性脑脊髓膜炎动物模型DNT 细胞的特点,提出蛛网膜下腔DNT 细胞是脊髓病变的T 细胞前体,并在T 细胞浸润中枢神经系统实质的过程中发生表型转换。此后,关于DNT细胞在神经系统疾病中的描述较少。2019 年,南京大学医学院附属鼓楼医院徐运教授团队的研究显示,脑卒中患者脑组织和外周血DNT 细胞数目显著增加,浸润的DNT 细胞通过调节FasL/PTPN2/肿瘤坏死因子-α(TNF-α)信号转导通路以增强脑组织免疫炎症反应,进而加重缺血性脑损伤[24]。Gagliani等[25]在神经炎症的再溶解过程中发现,某些独特的T 细胞亚群如辅助性T 细胞17(Th17)可在脑组织中转变为另一T 细胞亚群——调节性T 细胞(Treg),但并不知晓缺血性卒中期间是否可从其他T 细胞亚群转变为DNT 细胞。此外,在中枢神经系统炎症中表达上调的诸如自身抗原的刺激物也可以导致T 细胞原位增殖和扩增[26],这也可能是DNT 细胞在缺血性卒中增多的原因之一。在一些疾病中,DNT 细胞可在周围神经系统生成TNF-α,进一步加剧炎症反应,促进疾病进展[26]。DNT 细胞参与免疫炎症反应的机制还可能与其分泌炎性因子IL-17 有关[22]。本研究未进一步探讨TCR 信号和细胞因子与DNT 细胞间的关系,推测TCR 信号和部分细胞因子表达变化可能引起NMOSDs 患者DNT 细胞数目变化,尚待今后扩大样本量进一步深入研究。
综上所述,NMOSDs 患者外周血DNT 细胞数目显著增加,可能与免疫功能紊乱有关。进一步研究NMOSDs 患者外周血DNT 细胞生物表型和功能特征将对了解其发病机制,以及探索免疫治疗潜在靶标和途径具有重要意义。
