新旧指南下乳腺癌HER-2基因状态和蛋白表达及与临床病理关系的比较和再评价
2020-11-03罗斯译高子清肖秀丽阮思蓓张翠微唐明希
罗斯译,高子清,陈 丽,肖秀丽,阮思蓓,张翠微,凌 凤,吴 宁,唐明希
乳腺癌是女性生殖系统最常见的恶性肿瘤,20%~30%乳腺癌患者存在HER-2过表达或扩增,而HER-2过表达或扩增患者对赫赛汀等靶向药物敏感性高[1]。因此,通过免疫组织化学(immunohistochemistry, IHC)和荧光原位杂交(fluorescence in situ hybridization, FISH)正确检测和评价HER-2状态对乳腺癌治疗方案的选择和预后评估极其重要。目前,我国最新《乳腺癌HER2检测指南(2019版)》(以下简称新指南)已经发布[2],本文根据新指南再评价1 518例乳腺癌患者IHC和FISH检测结果的一致性及其与各临床病理特征的关系,并比较分析与《乳腺癌HER2检测指南(2014版)》(以下简称旧指南)[3]指南下判读结果的异同和优劣,为乳腺癌患者正确选择治疗方案和预后评估,特别是抗HER-2阳性靶向治疗患者个体化方案和预后疗效评估提供更为合理的参考。
1 材料与方法
1.1 临床资料选取2010年11月~2019年10月经西南医科大学附属医院病理科确诊为浸润性乳腺癌并行FISH和IHC检测的女性乳腺癌患者1 518例。组织标本主要来源于四川地区泸州、宜宾、内江、自贡、德阳等及川、滇、黔、渝结合部地区人群。文献报道乳腺浸润性导管癌穿刺标本与手术标本HER-2蛋白表达具有较高的一致性[4],因此本实验选取浸润性乳腺癌根治手术切除标本和粗针穿刺标本,其中根治手术标本1 343例、粗针穿刺标本175例,年龄17~90岁。所有病例均有完整的FISH报告记录和ER、PR、HER-2等IHC切片及临床病理资料。根据新、旧指南中IHC和FISH判读标准对所有病例进行再判读和差异统计分析。FISH再判读主要通过查阅检测报告记录,IHC再判读由2名教授复阅切片完成。
1.2 试剂与探针IHC中ER(SP1)、PR(1E2)和HER-2(4B5)检测使用罗氏公司抗体;Ki-67(MIB.I)抗体由北京中杉金桥公司提供。FISH检测采用北京金普嘉公司HER-2基因扩增试剂盒。
1.3 方法
1.3.1IHC法 新鲜标本经10%中性福尔马林固定后石蜡包埋并连续3 μm厚切片,IHC操作步骤严格按照EnVision两步法试剂盒说明书进行,ER、PR、Ki-67阳性为细胞核呈棕色或棕褐色,HER-2阳性为细胞膜呈棕色。
1.3.2FISH法 按照北京金普嘉公司HER-2基因扩增试剂盒操作说明书进行FISH检测,具体操作步骤参照文献[5-6]。
1.4 结果判断
1.4.1IHC结果判断 HER-2蛋白表达强度判读参照新版指南[2]进行,与旧版[3]不同者主要为:针对IHC(2+)判读的第一种情况,由旧版本的>10%的浸润癌细胞呈现不完整和(或)弱至中等强度的细胞膜染色,改为>10%的浸润癌细胞呈现弱/中等强度的完整细胞膜染色。
1.4.2FISH结果判读 新、旧指南不同之处主要为:(1)旧指南HER-2/CEP17比值≥2.0判读为阳性,新指南还需结合平均HER-2拷贝数/细胞≥4.0才能判为阳性,对HER-2/CEP17比值≥2.0但HER-2拷贝数/细胞<4.0者,新指南还需增加细胞计数,结果不变者判为阴性。(2)旧指南中HER-2/CEP17比值<2.0,但平均HER-2拷贝数/细胞≥6.0者判读为阳性,新版下还需增加细胞计数,结果不变者判为阳性。(3)旧指南HER-2/CEP17比值<2.0,平均HER-2拷贝/细胞数≥4.0且<6.0判为可疑,新指南要重新计数细胞后综合判读,若结果仍不变还需结合IHC结果进行判读,若IHC(3+)则判为阳性,若IHC(0~2+)则判为阴性。
1.5 统计学分析采用SPSS 17.0软件进行统计学分析,HER-2基因状态及蛋白表达与临床病理特征的关系采用χ2检验及Gamma关联分析,P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌中HER-2蛋白表达和HER-2基因扩增情况1 518例乳腺癌组织标本中,HER-2蛋白(-/+)者视为阴性,合计251例(16.53%),(2+)和(3+)者均视为阳性,分别为1 084例(71.41%)和183例(12.06%)。HER-2基因扩增406例(26.75%),无扩增1 112例(73.25%)(图1~4)。

①②③④
2.2 IHC和FISH检测乳腺癌中HER-2蛋白表达、基因扩增的一致性新指南下,HER-2蛋白阳性率为83.47%(1 267/1 518),HER-2基因扩增率为26.75%(406/1 518)。在1 267例HER-2蛋白阳性患者中有397例HER-2基因扩增,其中HER-2(2+)者263例,HER-2(3+)者134例,在406例HER-2基因扩增患者中有9例HER-2(-)。新、旧指南下HER-2蛋白表达和HER-2基因检测结果均相关(r=0.233,P<0.001;r=0.780,P<0.001);HER-2(-/+)和HER-2基因阴性的符合率分别为100%和95.36%;HER-2(2+)和HER-2(3+)与HER-2基因阳性的符合率分别为24.26%和73.22%。新、旧指南中IHC(2+)与FISH检测符合率差异有统计学意义(P<0.001),IHC(-/+)、IHC(3+)与FISH符合率差异无统计学意义(表1)。
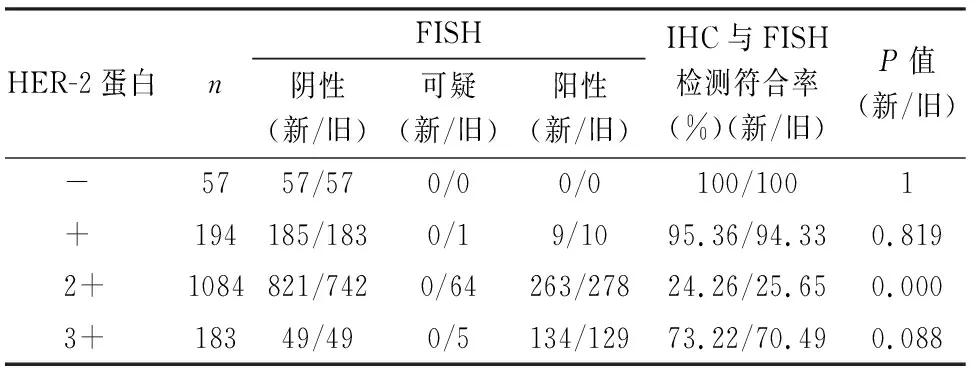
表1 FISH及IHC检测HER-2基因状态和蛋白表达一致性
2.3 乳腺癌中HER-2基因扩增及HER-2蛋白表达与临床病理特征的关系ER、PR、ER/PR表达状态与HER-2基因扩增(χ2=229.674,P<0.001;χ2=93.935,P<0.001;χ2=96.466,P<0.001)及HER-2蛋白表达(χ2=65.436,P<0.001;χ2=92.133,P<0.001;χ2=41.207,P<0.001)差异有统计学意义;组织学分级与HER-2基因扩增及蛋白表达呈正相关(r=0.097,P<0.05;r=0.139,P<0.05)。ER表达与HER-2基因扩增及蛋白表达呈负相关(r=-0.606,P<0.001;r=-0.126,P<0.05),PR、ER/PR状态与HER-2基因扩增呈负相关(r=-0.428,P<0.001;r=-0.428,P<0.001),与HER-2蛋白表达无关(P>0.05)。此外,Ki-67与HER-2基因扩增相关,肿瘤大小与HER-2蛋白表达相关,年龄及淋巴结数量与HER-2基因扩增及蛋白表达无显著相关性(P>0.05,表2)。
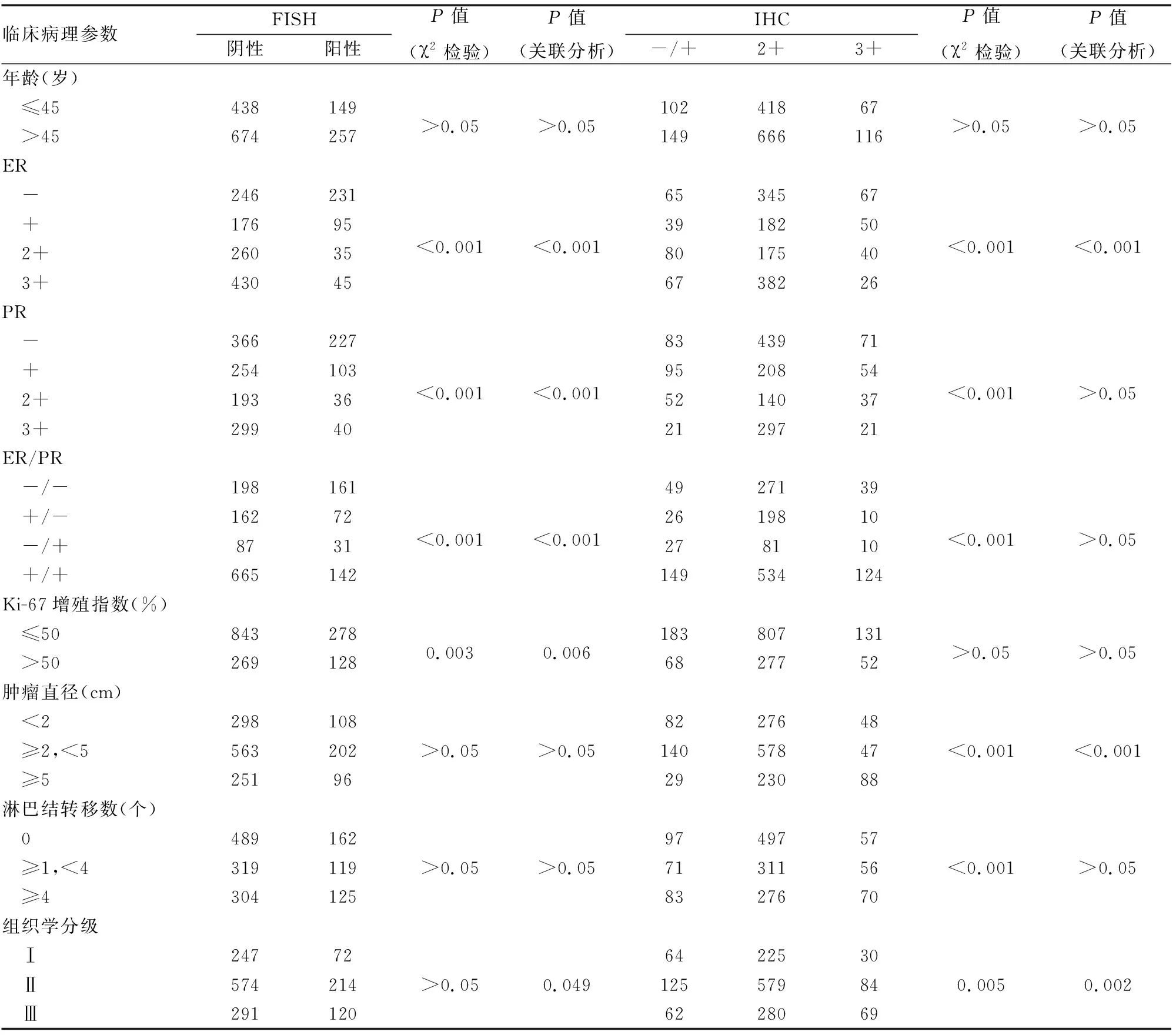
表2 乳腺癌中HER-2蛋白表达、HER-2基因状态与临床病理特征的关系
3 讨论
随着抗HER-2阳性乳腺癌靶向药物的广泛应用,极大地提高了HER-2阳性患者的生存期[7]。因此,HER-2的精确检测和评估对乳腺癌患者治疗选择和预后判断具有重要意义。本实验根据新版指南对四川及周边地区1 518例乳腺癌患者FISH和IHC检测结果的一致性及与临床病理特征的关系进行了再评价,并与旧版指南结果进行了比较与分析。
新指南结果显示:IHC(-)和FISH阴性的符合率为100%,与旧指南结果相同;IHC(+)和FISH阴性的符合率为95.36%,略高于旧指南(94.33%),这与新指南结果新增2例FISH阴性有关。因为新指南考虑到目前临床试验数据中仍缺乏充分证据证明HER-2/CEP17比值≥2.0,平均HER-2拷贝数/细胞<4.0的患者能从HER-2靶向治疗中获益[8-9],因此,新指南有效规避了旧指南标准下1例的FISH“假阳性”和1例“可疑”的判读结果,对临床用药指导更为准确;新版指南下IHC(2+)和FISH阳性符合率为24.26%,略低于旧指南的25.65%,这与新指南删除了“可疑”判读标准有关,在新指南判读标准下减少了15例FISH阳性和增加了79例FISH阴性结果,相应地有效规避了15例旧指南FISH“假阳性”和64例“可疑”结果的不确定性判读,使临床靶向药物的应用更加准确和完善;新指南下IHC(3+)和FISH阳性符合率为73.22%,略高于旧指南的70.49%,这是基于新指南删除“可疑”判读从而新增了5例FISH阳性结果所致,同样体现了新指南标准的更具明确性和科学性。因为现有的循证医学依据显示HER-2/CEP17比值<2.0,平均HER-2拷贝数/细胞≥4.0且<6.0(0~2+)患者能否从抗HER-2靶向治疗中获益,目前仍未得到充分证明[10-11]。
本组中IHC(2+)与FISH检测的符合率差异有统计学意义,这与新指南取消64例HER-2“可疑状态”判读标准有关,体现了新标准下更为明确的判读结果。新、旧指南间IHC(-/+)和IHC(3+)者与FISH检测的符合率差异均无统计学意义,可能与本组中IHC(-/+)和IHC(3+)样本量较少和旧标准“可疑判读”例数较少有关。本组结果也体现了新指南对旧指南的有效补充与完善,并结合临床实践,使乳腺癌患者用药标准及预后判断更加明确和准确。本组中IHC(-/+)与FISH阴性具有高度的符合率(100%,95.36%)。但IHC(3+)与FISH阳性的符合率较低(73.22%),与IHC(3+)样本量较少[因临床上只要IHC(3+)便可直接用靶向药,而并不推荐再行FISH检测]有关,并且多为5年以前的样本,这与当时样本固定也有关。除此以外,IHC检测结果也受抗原修复方法的影响[12]。有报道显示IHC(3+)伴FISH阳性者靶向用药的预后要好于IHC(3+)但FISH阴性者[11],且有研究认为HER-2拷贝数可为HER-2阳性浸润性乳腺癌患者提供预后信息,HER-2拷贝数高的IHC(3+)和(2+)患者预后较好[13]。据此,我们认为IHC(2+~3+)者都应进一步行FISH检测,以完善诊断,指导治疗和判断预后。
新、旧指南下,ER表达与HER-2基因扩增和HER-2蛋白表达均呈负相关。PR、ER/PR状态与HER-2基因扩增也均呈负相关,与HER-2蛋白表达无相关性,提示ER、PR阴性患者预后较差可能与HER-2高表达及基因扩增有关,ER阴性者同时也与HER-2蛋白表达呈负相关;新指南下Ki-67增殖指数和HER-2基因扩增呈正相关,肿瘤大小和组织学分级与HER-2蛋白表达均呈正相关,与本组之前的报道一致[4-5]。另外,新指南判读结果显示乳腺癌患者年龄、淋巴结转移数与HER-2基因扩增无相关性,与旧指南报道的呈正相关相反,可能的原因为新指南IHC(2+)时的判读标准为“>10%的浸润癌细胞呈现弱~中等强度的、完整细胞膜染色[2]”,取代了旧指南的“>10%的浸润癌细胞呈现不完整和(或)中等强度的细胞膜染色[3]”的判读;另外,新指南对旧指南中FISH判读标准进行了补充和修改,取消了FISH“可疑”的判读,避免了旧指南假阳性判断,使FISH阳性和阴性例数发生了变化。由于本组样本量的局限性,且仅限于四川及川、滇、黔、渝结合部地区患者,这些相关性的证实还有待长期、大量、多中心的回顾性研究来进一步证实与完善。
综上所述,新版指南结合了HER-2/CEP17比值、平均HER-2基因拷贝数及临床实践,通过取消HER-2基因“可疑”判读及IHC对HER-2蛋白结果判读的影响等标准的修改,使临床对HER-2状态的诊断更为明确和合理,对乳腺癌患者靶向用药及预后判断更加精准和完善。
