不同水解酶组合对黄姜细胞壁降解和皂苷释放量的影响及其结构特征分析
2020-11-03喻书诚喻家欣魏蜜郭娟娟
喻书诚,喻家欣,魏蜜,2,郭娟娟
(1. 湖北工程学院特色果蔬质量安全控制湖北省重点实验室/生命科学技术学院, 湖北 孝感 432000;2. 华中科技大学生命科学与技术学院, 湖北 武汉 430074)
0 引言
黄姜,学名盾叶薯蓣(DioscoreaZingiberensisC.H.Wright),为我国特有的药食同源性野生植物资源[1]. 生产加工地主要集中于湖北十堰丹江口、陕西安康等地[2]. 其根状茎含1.1%~16.5%的皂素,是目前世界上最好的激素药物原料[3-4]. 另外,其水溶性甾体皂苷成分对高血脂症、心肌缺血、胸痹、肿瘤等有极为显著的治疗效果[5].
由于黄姜根茎中含有大量淀粉和木质纤维素,传统的直接酸水解生产工艺具有酸用量大、污染严重、提取率低等缺点[6],严重制约了皂素产业的发展,其中的污染问题更是影响到了我国南水北调工程的水源质量,亟待寻求能清洁生产黄姜皂素的工艺技术以摆脱当前困境. 近年来,将酶预处理技术应用于优化皂素的提取生产工艺呈现上升趋势[7-9]. 通过选取合适的酶组合作用,高效降解细胞壁组分以及胞外的颗粒状淀粉,使被包裹皂苷充分释放,进而提升皂素得率. 同时,降低酸用量,减少废水排放,避免环境污染问题[10]. 徐升运等[11]建立的生物酶法提取黄姜皂素,使皂素收率提升了26%,酸用量降低了74.7%. 王焰新等[3]利用糖化酶液化酶联合处理黄姜原料中淀粉,建立了糖化-膜回收-水解(SMRH)清洁生产工艺.
值得注意的是,已有研究表明,不同的酶与酶、底物与酶之间存在协同或抑制作用[12-14]. 但是,不同的水解酶组合及作用次序对皂素得率的影响、以及黄姜细胞壁生物质降解的具体过程与作用机制仍缺乏研究. 因此,本实验以富含木质纤维素的药用植物黄姜为对象,研究不同多糖降解酶组成及作用次序对黄姜细胞壁生物质降解和皂苷分离的影响和内在机制,为指导今后针对性的选取能分泌单一酶或复合酶系的微生物功能菌群联合作用于黄姜生物质,实现黄姜皂素的清洁生产提供理论依据.
1 材料与方法
1.1 材料与试剂黄姜由湖北省十堰市竹溪县康辉生物化工有限责任公司提供;浓硫酸(分析纯) ,开封东大化工有限公司;甲醇(分析纯),国药集团;3,5-二硝基水杨酸(化学纯),上海展云化工有限公司;苯酚(分析纯),麦克林生化科技有限公司;糖化酶(100 000 U/mL)、α-淀粉酶(2 000 U/g)、纤维素酶(1 800 U/mg)、果胶酶(1 000 U/mg)、木聚糖酶(50 000 U/mg)以及黄姜皂素标准品均来自于上海金穗生物科技有限公司.
1.2 仪器与设备紫外-可见光分光光度计,上海菁华科技仪器有限公司;电子天平,上海越平科学仪器有限公司;超纯水处理器,成都渗源科技有限公司;高速离心机,北京时代北利离心机有限公司;超声仪,上海之信仪器有限公司;电磁加热搅拌器,巩义市科华仪器设备有限公司;高效液相色谱仪,美国Agilent公司.
1.3 试验方法
1.3.1 酶处理 低压蒸汽膨化(low pressure steam expansion, LSEP)处理能显著破坏黄姜细胞结构促进皂素释放[15]. 将经LSEP处理的黄姜粉末依次添加酶试剂处理. 所有酶添加量均为150 U/g黄姜干粉. 其中,纤维素酶、果胶酶和木聚糖酶酶促反应在温度50 ℃,pH为5.0的条件下处理20 h;α-淀粉酶酶促反应在温度95 ℃,pH为5.0的条件下处理30 min;糖化酶酶促反应在温度50 ℃,pH为5.0的条件下处理6 h.
P、X、C分别代表果胶酶处理、木聚糖酶处理、纤维素酶处理,PX即为果胶酶、木聚糖酶依次联合处理;XP:木聚糖酶、果胶酶依次联合处理;PC、CP、CX、XC依此类推;PXC:果胶酶、木聚糖酶、纤维素酶依次联合处理;PCX:果胶酶、纤维素酶、木聚糖酶依次联合处理;XPC、XCP、CPX、CXP依此类推;CK:空白对照. 所有处理组包括PXC、PCX、XPC、XCP、CPX、CXP、PX、XP、PC、CP、XC、CX、P、X、C以及CK共16组处理. 将经过上述16组不同酶试剂组合及作用次序的处理定义为TE处理组. 在此基础上,继续添加α-淀粉酶、糖化酶进行糖化液化的处理组为FE处理组.
1.3.2 还原糖测定
1)还原糖测定方法的建立 借鉴王天龙等[16]优化的DNS还原糖测定法. 精密取1 mL样品上清液,加入2 mL配置静止14 d后的DNS试剂,沸水水浴5 min,取出后立即冷却并定容至10 mL,以蒸馏水为空白对照,在540 nm波长处测定吸光度. 实验中将样品酶处理水解液稀释10~20倍进行检测.
2)葡萄糖标准曲线的制作 精确称取无水葡萄糖,用蒸馏水配置成浓度为2、3、4、9、11 mg/mL系列浓度的对照品溶液,采用DNS法测定. 以葡萄糖标准品浓度为横坐标,吸光度OD值为纵坐标,制作还原糖标准曲线. 以OD值(Y)对样品浓度(X)进行线性回归,得还原糖回归方程:y=0.071 6x-0.167 9,其决定系数R2=0.997 6. 用此公式可以准确计算出样品还原糖浓度及含量.
1.3.3 黄姜皂素测定方法
1)色谱条件的建立 色谱柱:C18反相柱(syncronis C18250 mm×4.6 mm),检测波长204 nm,流动相为纯甲醇,柱温30 ℃,流速1 mL/min,进样量10 μL,分析时间13 min.
2)薯蓣皂苷元标准曲线的制作 精密称量薯蓣皂苷元标准品,用甲醇溶解制成0.052 5 mg/mL、0.105 0 mg/mL、0.175 0 mg/mL、0.210 0 mg/mL、0.262 5 mg/mL系列浓度的对照溶液,采用高效液相色谱法测定. 以对照溶液浓度为横坐标,峰面积为纵坐标,制作标准曲线. 以峰面积(Y)对样品浓度(X)进行回归分析,得到方程:y=4 229.6x+69.991其决定系数R2=0.999 4,用此方程可以精准计算出样品薯蓣皂苷元浓度及含量.
1.3.4 黄姜样品表征技术方法
1)环境扫描电镜(SEM)方法 使用蔡司sigma 300电镜. 黄姜渣烘干并研磨,过100目筛,取少量粉末样品放于导电胶上用气鼓吹掉未粘牢的粉末,将样品置于喷金仪内喷金(1 min以内). 将样品台放置于仪器中,抽真空开机观察形貌.
2)X线衍射分析(XRD)方法 黄姜渣烘干并研磨,过100目筛. 将粉末样品放入20 mm×20 mm×0.5 mm的玻璃载样片中,压实压平. 将样片放进舱内,选择1Dscan模式,狭缝2,电压40 V电流150 mA,选择合适的角度和测试速度开始测试.
3)低温氮气吸附-脱附法比表面积测定(BET)方法 使用麦克公司物理吸附仪ASAP2460. 取0.1~0.2 g过100目筛的黄姜粉末,抽真空脱气6 h,装上仪器分析口测试吸脱附曲线. 计算比表面积,孔容孔径.
4)原子力显微镜分析(AFM)方法 仪器为Bruker Dimension Icon AFM,探针型号SCANASYST-AIR(弹性系数0.4 N/m),采用智能扫描模式(Peak-force)扫图. 扫描速率1.0 Hz,扫描像素256×256.
1.3.5 计算方法 含量=(V×C)/m,其中m:黄姜粉末质量;V:样品上清液体积;C:待测指标浓度.
1.3.6 数据分析 所有测量数据至少3个平行样品,以算数平均值±标准差(SD)表示. 用于表征微观结构(SEM、XRD、BET、AFM)的样品,均来自于多组平行样品的混合处理. 方差分析(ANOVA)采用 IBM SPSS Statistics 24进行Duncan检验.P值小于0.05表示差异具有统计学意义.
2 结果分析
2.1 不同多糖水解酶组合及作用顺序对还原糖含量的影响TE处理组样品中还原糖含量及单因素方差分析结果见图1. TE处理组中,PC组与PCX组还原糖百分得率分别为13.601%、13.459%. 单因素方差分析结果表明,这两个处理组中还原糖含量无显著差异(*P>0.05),考虑到酶成本,PC处理组是破坏黄姜细胞壁的最优酶组合. 另外,P处理组样品还原糖含量为12.558%,与最优组PC对比,其还原糖含量水平仅降低1.043%,且通过唯一果胶酶处理的样品,还原糖含量高于多种组合酶处理组,证实果胶酶是水解黄姜细胞壁组分的关键水解酶. 为进一步明确酶作用次序对还原糖的影响,将PCX、CPX与CXP组进行对比、PC组与CP组进行对比,果胶酶优先添加的样品组PCX相较于CPX、CXP组还原糖含量分别提高0.749%、2.253%;PC组较CP组提升0.635%. 因此,在酶处理降解黄姜细胞壁的过程中,果胶酶应最先添加. 另外,PCX组与PC处理组、CPX组与CP组还原糖含量并无显著差异,说明木聚糖酶在提升还原糖含量方面作用不明显.
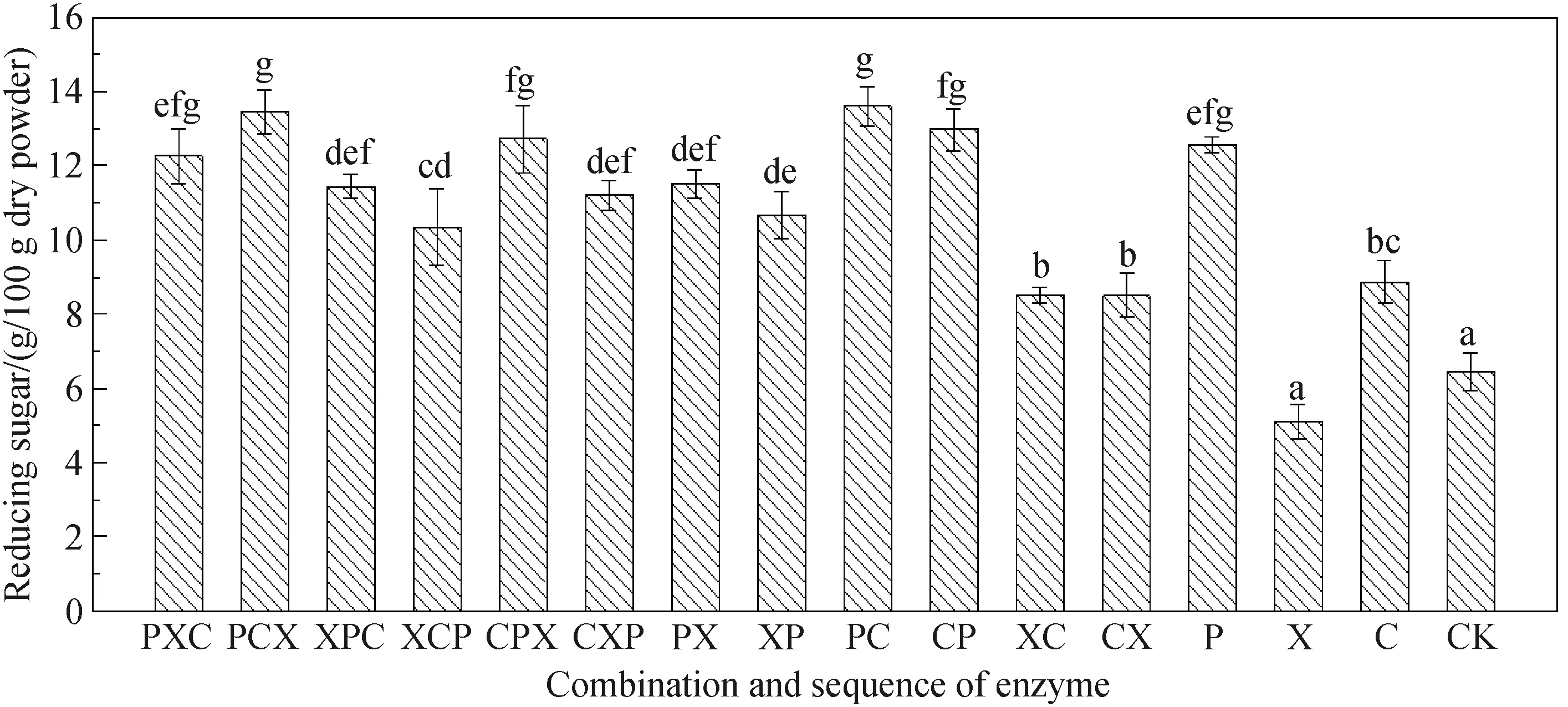
图1 不同酶组成及作用顺序处理样品的还原糖含量
2.2 不同多糖水解酶组合及作用顺序对皂素得率的影响所有FE处理组中黄姜皂素提取率及单因素方差分析结果如图2所示. PCX组、PC组、CPX组以及CP组皂素含量分别为1.550%、1.574%、1.510%和1.547%. 经单因素方差分析,以上4组处理皂素含量差异不具有统计学意义(*P>0.05). 结合它们处理后PC、PCX组还原糖得率显著高于其他组,以及酶成本问题,最终确定PC组为最优处理组. 另外,P处理组皂素含量为1.293%,与最优组PC比较,仅降低0.281%,证明果胶酶也是水解细胞壁释放皂苷的关键水解酶,这点与果胶酶对还原糖提取率的影响效果一致. 同时,PCX与PC组;CP与CPX组两两比较,两者的皂素含量差异不具有统计学意义(*P>0.05),这一结果表明木聚糖酶在促进皂苷的释放上效果不理想.
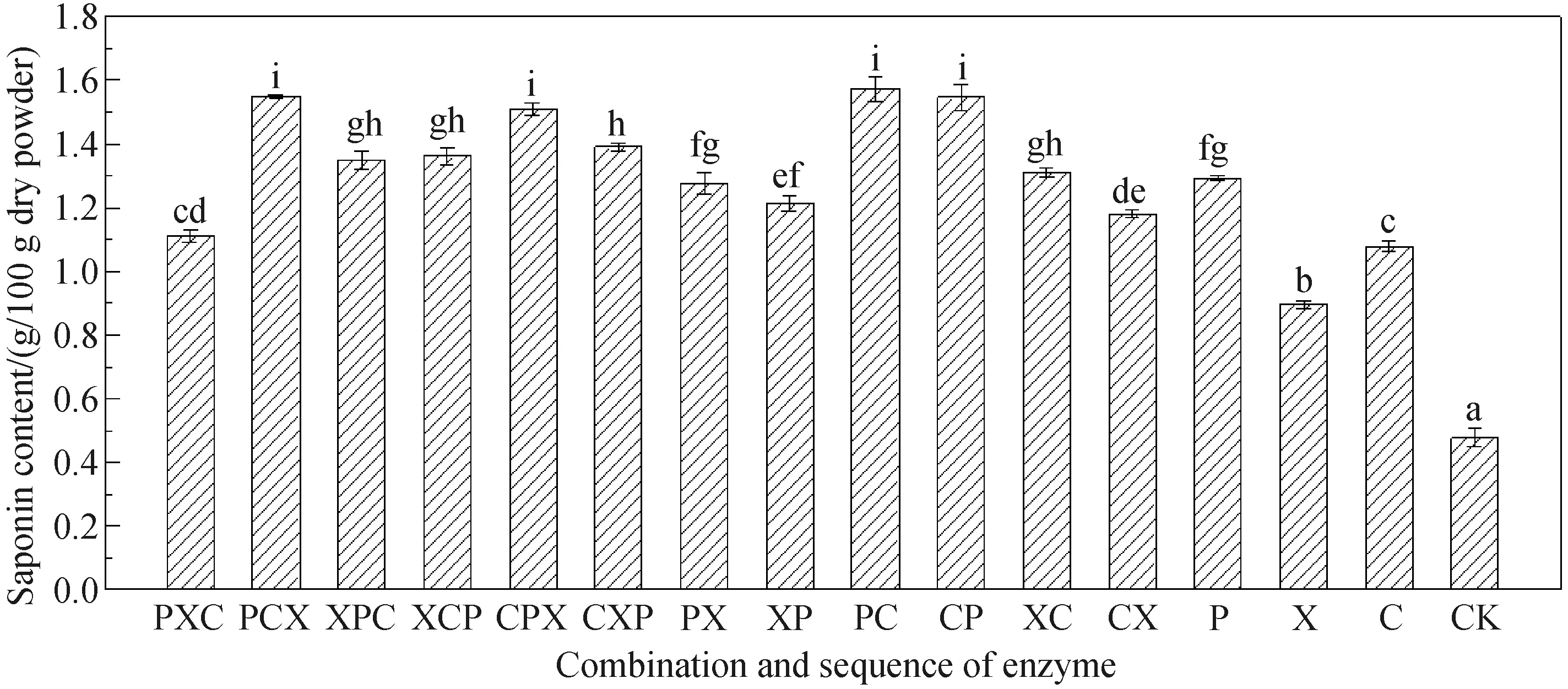
图2 不同酶组合及作用顺序处理样品的黄姜皂素提取率
2.3 TE组处理后黄姜渣微观结构表征
2.3.1 环境扫描电镜(SEM)分析 对经过不同酶处理组处理的黄姜渣进行SEM分析,结果显示未经酶处理的样品中淀粉颗粒与木质纤维素紧密的交织在一起,严重阻碍皂苷的释放和游离(图3,CK);经过木聚糖酶处理后的样品细胞壁组分降解不显著(图3,X),与上文还原糖、皂素的测定中所得结论一致;经纤维素酶处理的样品,淀粉颗粒依然很完整,木质纤维素结构上无明显穿孔(图3,C). 相反地,凡是经果胶酶或果胶酶复配的酶处理组样品中,黄姜细胞壁均出现了明显的孔洞结构,且黄姜淀粉也被降解得更充分. 其中,PCX组与PC组样品中,孔洞结构极为明显,细胞壁结构破坏程度最为显著. 因此,这两个处理组水解产物的得率显著高于其他处理组,这与还原糖测定中所得结论一致.

图3 TE处理组黄姜渣的环境扫描电镜图片
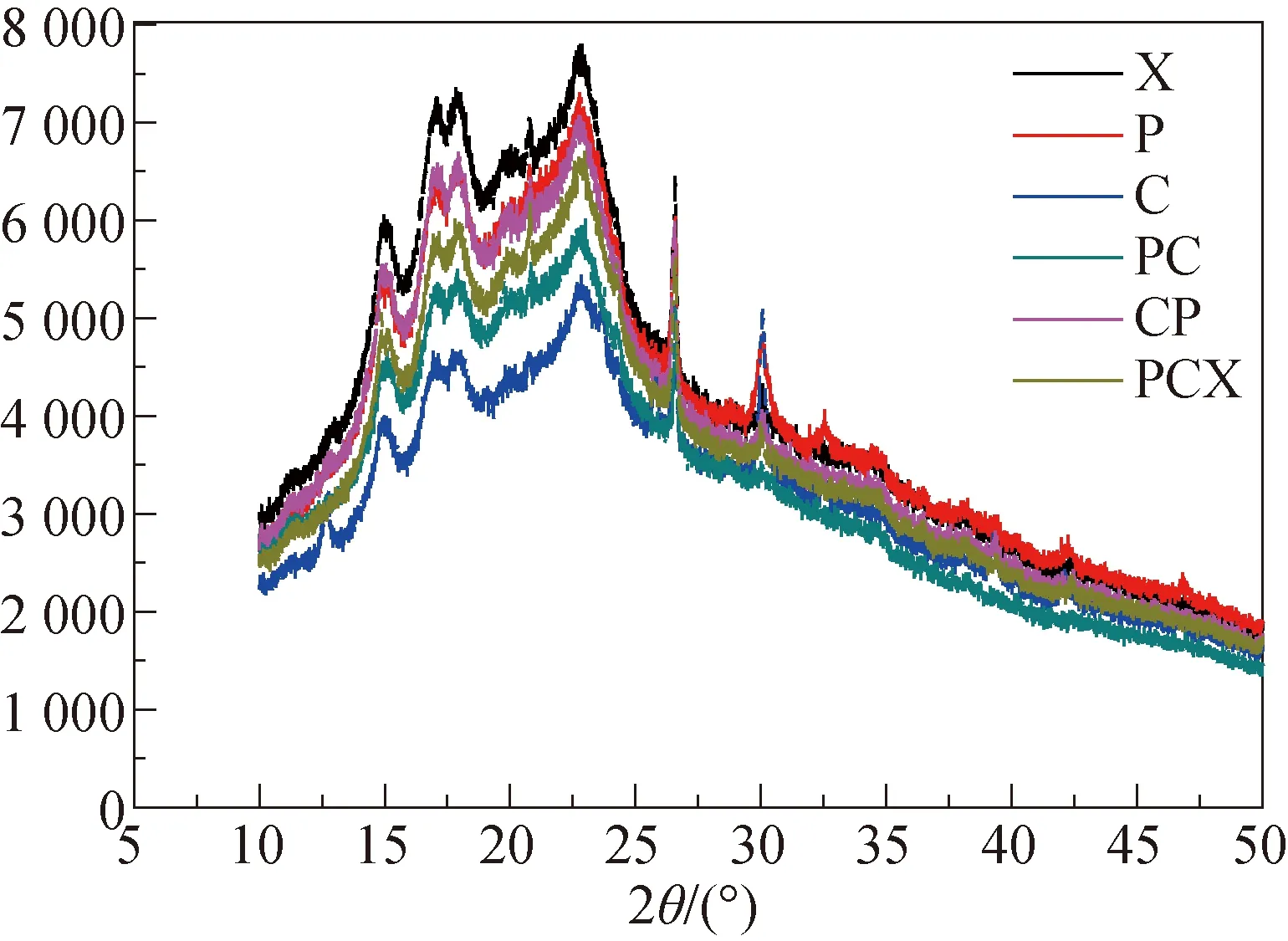
图4 TE处理组黄姜渣X线衍射图谱
2.3.2 X线衍射(XRD)分析 结晶度对物质的降解有极大的影响,高结晶度往往会使物质分子排列得更为紧密,难于降解[17]. 因此,若能降低黄姜细胞壁中各组分的结晶度,将十分有利于被黄姜细胞壁包裹的黄姜皂苷的充分释放. 由图4可知,6种不同处理的黄姜样品在2θ角为15.5°、17.0°、17.8°、22.7°、26.5°、29.9°左右均出现较强衍射峰. 使用软件JADE 6.5分峰拟合法进行相对结晶度计算. 不同处理下黄姜样品的相对结晶度分别为:X:25.09%;P:25.97%;C:25.77%;PC:25.22%;CP:25.59;PCX:25.13%. 单因素方差分析表明,各不同处理组样品之间相对结晶度差异不具有统计学意义(*P>0.05). 因此,通过改变3种酶制剂的组合及作用顺序,对黄姜生物质整体的结晶度影响不大,但是如果是将黄姜生物质中大小组分进行分级测定的话,可能对其结晶度和聚合度的影响会显现出来.
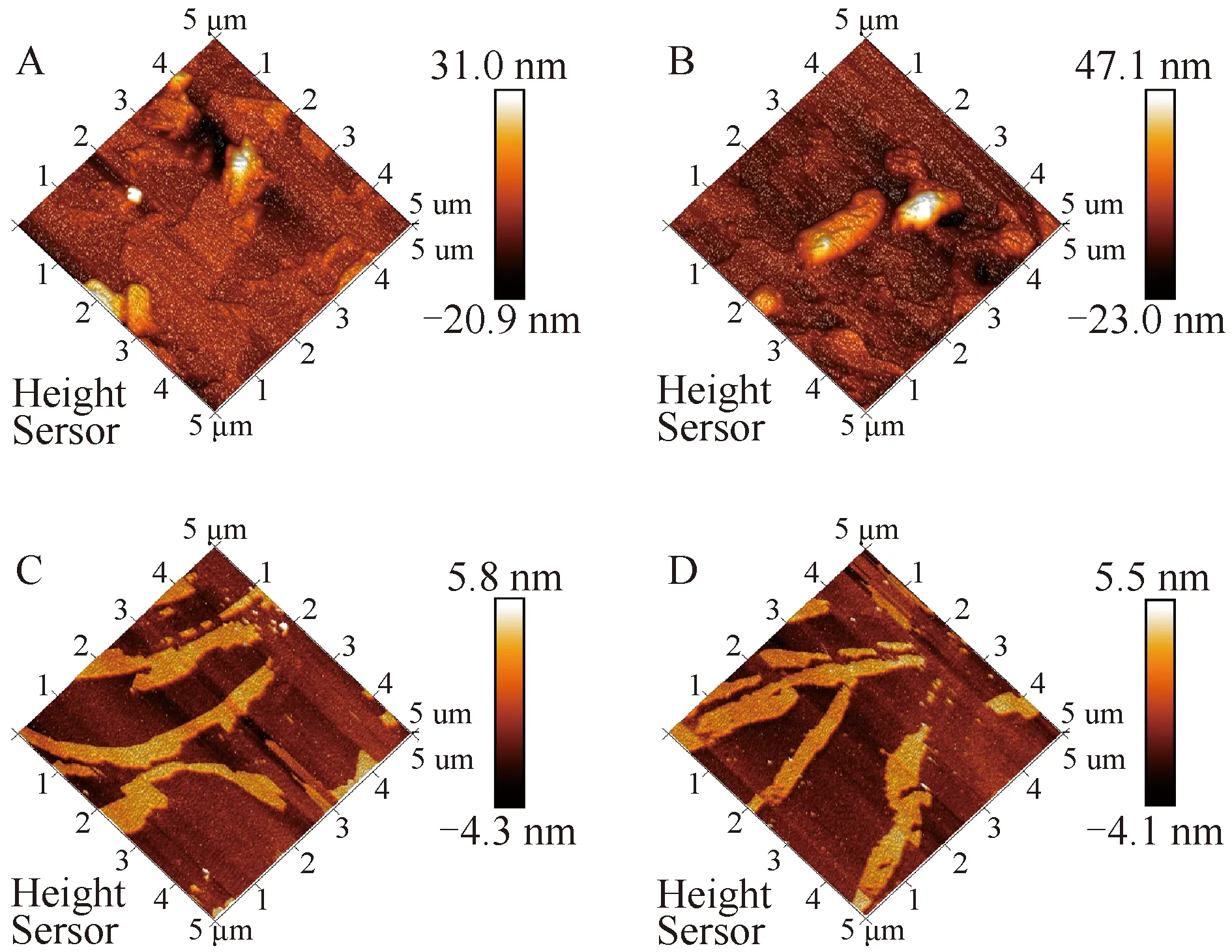
2.3.3 低温氮气吸附-脱附法比表面积(BET)分析 底物比表面积的大小关系到酶分子催化作用的效率,直接影响皂素释放的水平. 本实验将果胶酶(P)参与的几个重要组合(P、PC、PCX)进行BET分析,见表1. 结果表明,P处理组比表面积(8.1 602 m2/g)大于PC组(6.532 4 m2/g)与PCX组(4.708 5 m2/g),且孔径大小顺序依次为P(4.629 5 nm) 表1 TE处理组黄姜渣结构性质 图5 TE处理组黄姜渣表面形貌的原子力显微镜图A、B为经P组处理的黄姜粉末原子力显微照片;C、D为 PCX组处理黄姜粉末原子力显微照片 2.3.4 原子力显微镜(AFM)分析 基于BET分析结果,将比表面积差异最大的两个组合(P、PCX)进行了AFM分析,得到如图5所示扫描范围为5 μm×5 μm的三维形态图. 图中以色度值的高低表示样品表面高度的变化,色度值越高表示高度越高. 从原子力显微图中可以清晰地看见,经过果胶酶处理后的样品沉淀颗粒表面峰谷之间的极差为51.9 nm、70.1 nm(图5,A、B),大于经果胶酶、纤维素酶、木聚糖酶依次处理的样品(10.1 nm、9.6 nm;图5,C、D). 表明,经果胶酶处理的样品沉淀颗粒表面更为粗糙,该结论与BET分析结论一致,推测导致此现象的原因是:在只有果胶酶处理时,果胶酶充分降解了细胞壁与细胞之间粘粘的果胶质,使得细胞之间最大限度地分散促使表面积增加;在果胶酶、纤维素酶和木聚糖酶依次联合处理的情况下,它们最大限度地降解了细胞壁纤维素、果胶质等组分,致使黄姜渣表面的结构反而变得更为平坦,且黄姜细胞壁表面形成的许多细小孔洞逐渐变大、孔隙缩小,孔洞不断相互融合,孔洞结构密集程度降低,导致黄姜渣比表面积比P组更低. 确定酶预处理过程中的关键酶类及最佳酶处理顺序,对优化以生物质资源为原料,提取有效成分的生产工艺有重要意义. Song Young-Ran等[18]通过酶预处理法提取草本植物紫菀的新型多糖研究中,果胶酶处理组得率为3.8%,为最优处理组. Sharma Rakesh等[19]利用单一酶或组合酶处理橄榄以提升橄榄油的产量和质量,确定了果胶酶与纤维素酶1∶1混合加入时,最大采油率为11%. 本研究通过3种酶的不同组合及作用顺序处理黄姜原料,以黄姜还原糖和皂素得率为评价指标,确定了果胶酶是促进黄姜细胞壁生物质降解的关键酶分子,与上述研究报道类似. 另外,本研究还确定了果胶酶与纤维素酶依次处理时,可达到最高的水解糖得率;果胶酶与纤维素酶复合处理时在节约成本的同时可达到最高的皂素提取率,皂素得率为对照组的3.286倍. 通过SEM、XRD、BET、AFM微观结构表征技术能够直观地分析酶组成及作用顺序对黄姜细胞壁的降解情况. Baby Kumaranthara Chacko等[20-21]通过环境扫描电镜分析经不同酶单独或组合作用茴香籽和青椒,发现酶预处理后细胞壁出现大量裂缝,有利于胞内物质的游离. 也有研究表明,通过预处理技术降低结晶度,有利于有效成分的提取. 王文惠等[22]采用氢氧化钠和臭氧两步法对玉米秸秆进行预处理,显著破坏了纤维素的晶体结构,能极大促进纤维素的后续酶解. 在本研究中,XRD分析发现,3种酶的复合处理并不能改变黄姜细胞壁组分的结晶度. 这是因为本研究中各种酶预处理条件温和,没有进行高温或添加酸碱介质等处理. 本研究对比分析了16组不同多糖水解酶酶组合和作用顺序对黄姜生物质细胞壁降解及皂苷释放的影响,结果表明,果胶酶是黄姜还原糖和皂素提取率的关键酶,PC组合是提取还原糖、皂素效率最高且成本最低的处理组. 同时,本研究联合了SEM、XRD、AFM和BET 4种微观结构表征技术来阐明酶分子组合和作用顺序对黄姜细胞壁降解的内在原因. 该研究对不同酶组合处理富含木质纤维素的药用植物资源、降低生产过程对环境的污染、实现生产工艺清洁化及其产物的综合利用提供了参考,对天然产物及其有效成分的清洁生产具有重要意义. 同时也为定向筛选能分泌特定细胞壁降解酶系的微生物的联合处理生物质资源指明了方向,这将是今后本研究需要继续深入开展的工作.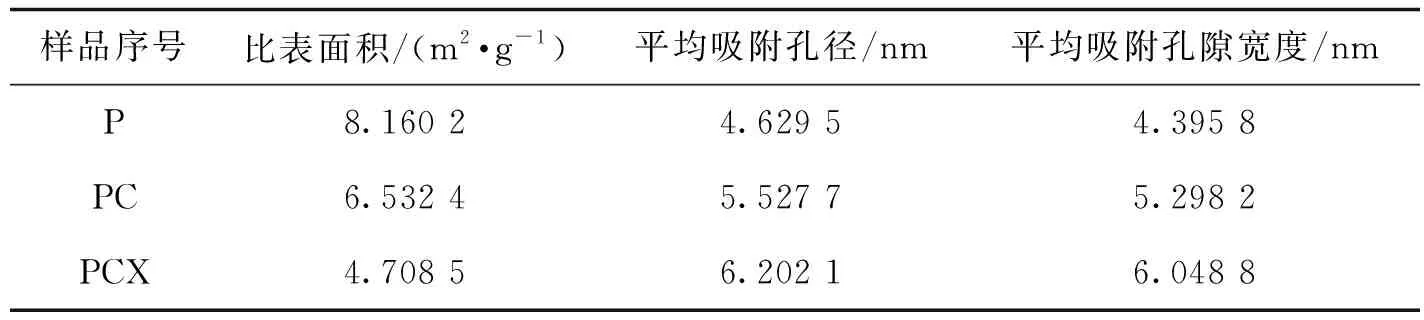
3 讨论与结论
