非靶向代谢组学方法探究母体羊水中先天性心脏病差异代谢物及相关代谢通路*
2020-11-03李雅红孙云张晓娟杨佩颖洪冬洋王艳胡平许争峰蒋涛
李雅红,孙云,张晓娟,杨佩颖,洪冬洋,王艳,胡平,许争峰,蒋涛
(南京医科大学附属妇产医院&南京市妇幼保健院遗传医学中心,南京 210004)
先天性心脏病(congenital heart disease,CHD)是常见的出生缺陷,发病率约为8‰[1]。目前临床上产前检测胎儿CHD主要依赖于超声检测,但其准确性受多种因素影响,仅有约40%的CHD可以被检出[2-3]。CHD具体发病机制不明,对于CHD病理机制的研究还有待更加深入的探讨。
基于羊水样本代谢组学探究CHD的相关研究较少,国内尚未见报道,国外报道鲜见。Graça等[4]通过核磁共振方法分析了12例包含多种畸形胎儿的母体羊水样本(其中包含少数CHD)代谢谱,结果发现畸形胎儿母体羊水代谢谱与正常对照组间存在明显差异,但是该研究所使用的CHD样本例数偏少,且未进行代谢通路的相关分析。本研究旨在通过非靶向代谢组学方法探究CHD潜在标志物和代谢通路,报道如下。
1 对象和方法
1.1研究对象 采用病例-对照研究,收集2012年1月至2013年12月在本院临床遗传实验室检测且经胎儿超声心动图检查诊断为胎儿CHD并转移至我中心的78例孕妇羊水样本作为CHD组,同时收集126例因唐氏筛查高风险或高龄进行羊水穿刺且无核型异常的非CHD胎儿母体羊水样本作为对照组。CHD组包含38例女性胎儿和40例男性胎儿,孕妇年龄22~39岁,中位年龄28岁;对照组包含73例女性胎儿和53例男性胎儿,孕妇年龄21~42岁,中位年龄31岁。所有样本均来自江苏省内单胎妊娠孕妇,具有相同的种族背景,并排除妊娠期相关并发症(如高血压和糖尿病等)。CHD经胎儿超声心动检查诊断,未经任何治疗,并排除CHD以外的其他结构畸形(如泌尿系统畸形、神经系统畸形、脊柱发育异常、唇腭裂等)。本次研究所涉及的CHD类型依据Botto等[5]报道的分类方法行分类,见表1。对照组样本选择正常单胎妊娠样本,即由于高龄或唐氏综合征血清学筛查高风险而进行羊膜腔穿刺及核型分析且结果无异常的样本,出生后经随访无CHD。样本均置于-20 ℃保存。本研究通过南京市妇幼保健院医学伦理委员会审核批准[宁妇伦字(2018)91号],免除知情同意。
1.2仪器及试剂 Pegasus HT气相色谱/飞行时间质谱(GC-TOF-MS)联仪(美国 Leco 公司),CentriVap Complete真空离心浓缩仪、FreeZone 6Plus低温冷冻干燥机(美国Labconco公司),自动进样玻璃瓶(美国Agilent 公司),Rxi-5色谱柱(30 m×0.25 mm×0.25 μm,美国Restek公司),XploreMET自动衍生平台(德国Gerstel公司),超纯水由配备有LC-MS Pak过滤器的Mill-Q Reference系统产生(美国Millipore公司)。甲氧基胺盐酸盐、脂肪酸甲酯(C7-C30,FAMEs)标准品、吡啶和无水硫酸钠(美国Sigma公司),N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA)+三甲基氯硅烷(TMCS) (体积比99∶1)、甲醇、乙腈、己烷、二氯甲烷、氯仿和丙酮(美国Thermo Fisher公司)。
1.3样本制备 待测羊水样本于冰浴下缓慢解冻,4 ℃、3 000×g离心3 min;吸取100 μL上清液置于预冷的EP管中,加入10 μL内标液,轻微混匀,再加入200 μL 预冷的甲醇∶氯仿(体积比3∶1)混合溶液进行提取。4 ℃、14 000×g离心20 min,取200 μL上清液至1.5 mL自动进样玻璃瓶,置于真空离心浓缩仪中旋干5 min,去除氯仿溶剂,再转移至低温冷冻干燥机完全冻干。完全干燥的样本恢复室温后,充入高纯氮气保护,自动压盖保存,置于XploreMET自动衍生平台进行硅烷化衍生。步骤:加入 50 μL甲氧胺盐酸吡啶溶液(20 mg/mL),30 ℃温育2 h,加入 50 μL MSTFA(含保留指数FAMEs),37.5 ℃温育1 h。在此衍生的过程中,衍生好的样本由进样臂自动进样。

表1 CHD分类法
1.4GC-TOF-MS检测 GC-TOF-MS具体分析步骤如下:进样量为1 μL,载气为氦气(99.999 9%),流速恒定为1.0 mL/min;GC温度编程设定为80 ℃等温加热2 min,然后以12 ℃/min的速度,温度由80 ℃上升至300 ℃(4.5 min),然后以40 ℃/min的速度从300 ℃上升至320 ℃(维护1 min);前进样口温度为270 ℃;传输线温度为270 ℃。MS具体设置:电子轰击电离(-70 eV);检测质量核质比为50~500 m/z;离子源温度为220 ℃;采集速率为25 spectra/s;探测器电压为-1 450 V。
1.5数据分析 GC-TOF-MS生成的原始数据由ADAP-GC 2.0处理,包括自动基线去除、平滑、峰识别和去卷积、质量控制、矫正。将保留指数和质谱数据与JiaLib代谢物数据库中已知结构的质谱数据比对并进行物质鉴定[6-7]。使用SIMCA 14.0多变量统计软件(瑞典Umetrics公司)进行正交偏最小二乘判别分析(orthogonal partial least square discrimination analysis,OPLS-DA)。使用多维统计分析方法评估CHD与对照组代谢物的差异,变量重要性投影(variable importance in the projection,VIP)值>1.0认为差异有统计学意义[8]。使用SPSS 22.0统计学软件(美国Ibm公司) 进行Mann-WhitneyU检验,以P<0.05为差异有统计学意义。同时满足多维统计VIP>1和单维统计分析P<0.05的代谢物被认为是可靠的差异代谢物。应用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库进行差异代谢物代谢通路富集分析[9]。使用R语言进行ROC曲线分析。
2 结果
2.1模式识别和差异代谢物分析 CHD组与对照组之间存在明显分离(R2Y=0.563,Q2Y=0.433,图1A),回归曲线在Y轴的截距为-0.29(图1B)。羊水样本中共检测出265种代谢物,其中有178种代谢物被成功鉴定。在该178种代谢物中氨基酸、有机酸、碳水化合物、核苷酸、脂质、吲哚、脂肪酸的比例分别为 30%、25%、19%、7%、3%、3%和3%,此外还有10%的其他类型代谢物。多维分析结果显示,43种代谢物在CHD患者中呈差异表达,且这些代谢物在单维分析中也得到验证。差异代谢物包括29种氨基酸或不同氨基酸比例、4种碳水化合物、1种核苷酸、6种有机酸、1种磷酸盐、1种维生素和吲哚乙酸,见表2。
2.2CHD相关代谢通路分析 与对照组相比,CHD组多条代谢途径受到影响,包括丙氨酸、天冬氨酸和谷氨酸代谢,缬氨酸、亮氨酸和异亮氨酸代谢,精氨酸代谢,苯丙氨酸、酪氨酸和色氨酸代谢,谷胱甘肽代谢,谷氨酰胺和谷氨酸代谢等见图2。
2.3VSD与TOF间差异代谢物分析结果 VSD与TOF之间有2种代谢物存在显著差异,分别为苏氨酸(P=0.018)和核糖醇(P=0.037),其中苏氨酸在VSD中含量较高,而核糖醇在VSD中含量较低,见图3。
2.4VSD和TOF检测标志物分析结果 在发现的43种差异代谢物中,有6种差异代谢物用于检测VSD的曲线下面积(area under the cure,AUCROC)大于0.70,分别为谷氨酸/焦谷氨酸比值(AUCROC=0.90)、谷氨酸(AUCROC=0.84)、谷氨酰胺/谷氨酸比值(AUCROC=0.83)、苯丙氨酸(AUCROC=0.81)、异亮氨酸(AUCROC=0.76)和别异亮氨酸(AUCROC=0.73)。苯丙氨酸检测VSD的敏感性最高(100%),谷氨酸和异亮氨酸次之(均为81.8%)。谷氨酸/焦谷氨酸比值用于检测VSD的特异性最高,为97.5%,其次为谷氨酰胺/谷氨酸比值(90%)。就检测TOF而言,尿酸、谷氨酸/焦谷氨酸比值和天冬酰胺具有较大的AUCROC,分别为0.86、0.85和0.79,其中尿酸和天冬酰胺具有高敏感性,均为100%,但特异性较低,分别为72.5%和67.5%,而谷氨酸/焦谷氨酸比值兼顾敏感性(83.3%)和特异性(82.5%)。见表3。
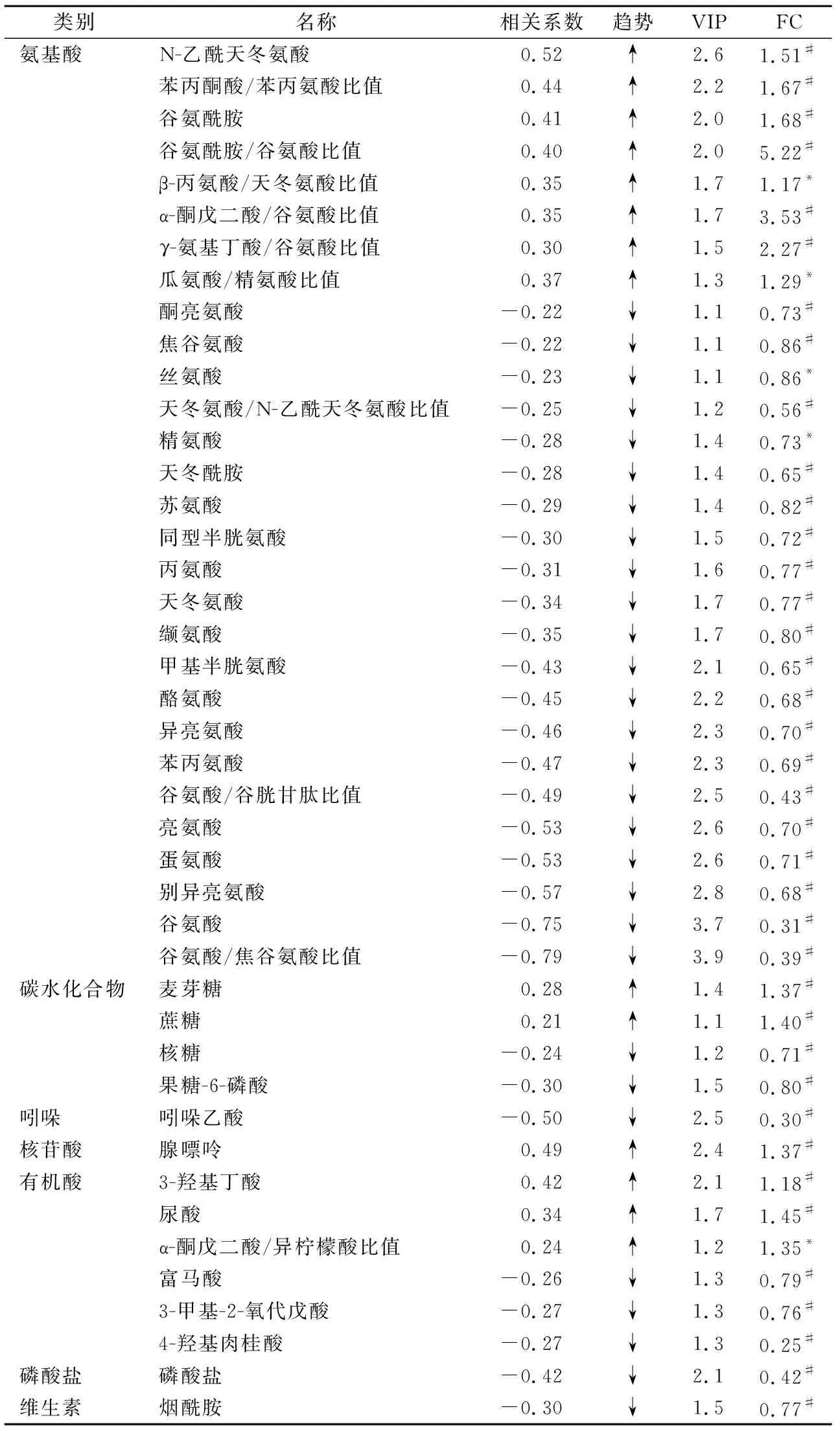
表2 2组间差异代谢物及其在CHD中表达的变化
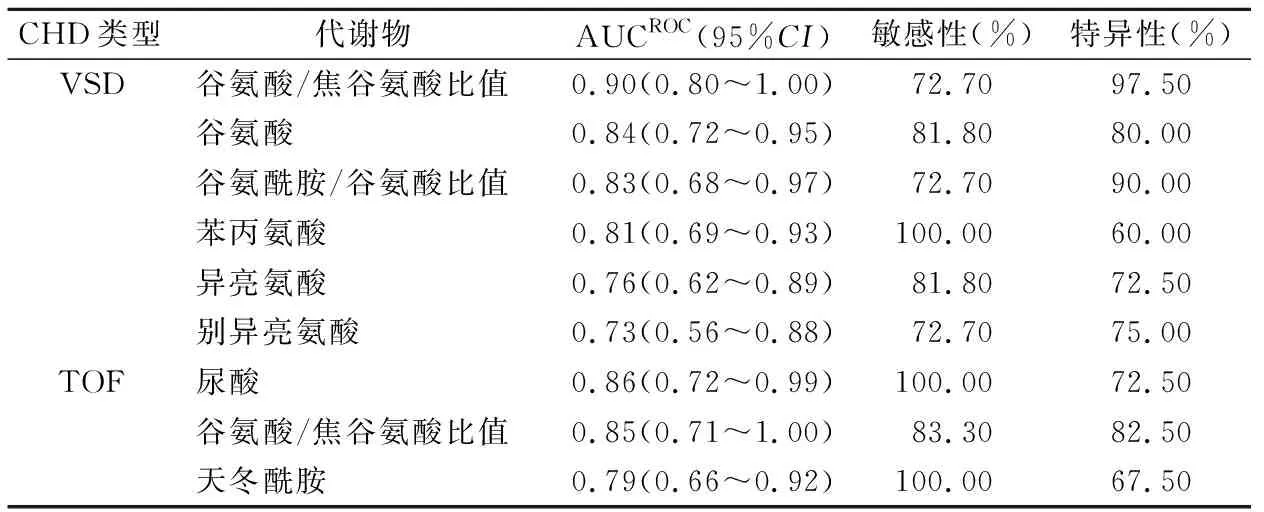
表3 不同代谢物检测VSD和TOF的 ROC曲线分析结果
3 讨论
目前,CHD的检测主要依赖于胎儿超声心动图,但存在检出率较低的问题。本研究以羊水样本为研究对象,探讨了CHD代谢谱的差异,结果共发现43个可靠差异代谢物和16条差异代谢通路。同时,我们选择病例数相对较多的VSD和TOF进行代谢物比较,发现这2种CHD之间苏氨酸和核糖醇存在差异,这表明不同类型的CHD之间代谢物也存在一定的差异。在本研究报道的43种差异代谢物中,有7种代谢物与Graça等[4]的研究结果一致,分别是丙氨酸、谷氨酸、谷氨酰胺、亮氨酸、苯丙氨酸、酪氨酸和缬氨酸,本研究与其研究的样本均为羊水,表明这些差异代谢物非常可靠。
本研究还探讨了VSD和TOF潜在检测标志物。结果发现在43种差异代谢物中,谷氨酸/焦谷氨酸比值检出VSD的准确性最高(AUCROC为0.90),而谷氨酸、谷氨酰胺/谷氨酸比值和苯丙氨酸检出能力为中度,AUCROC分别为0.84、0.83和0.81,其中苯丙氨酸检测的敏感性最高(100%),而谷氨酸/焦谷氨酸比值的特异性最高(97.50%)。此外,本研究还对TOF的检测标志物进行了探讨,结果显示尿酸和天冬酰胺检测TOF最敏感(100%),谷氨酸/焦谷氨酸比值次之(83.3%),其中谷氨酸/焦谷氨酸比值的特异性相对较高。有文献报道,胎儿超声心动图检测VSD和TOF的检出率分别为56.6%和82.4%[10-11]。可见,本研究发现的VSD和TOF检测标志物的敏感性均高于胎儿超声心动图检查结果。
CHD中参与氮代谢的多条代谢通路被严重扰动,包括谷氨酸、谷氨酰胺、精氨酸和谷胱甘肽等代谢通路。Salabei等[12]发现谷氨酰胺可通过调节细胞内α-酮戊二酸水平增加心肌祖细胞增殖。精氨酸是一氧化氮合酶(NOS)的底物,而NO可通过血管依赖性或独立作用调节心脏功能,包括增殖和血管生成等[13]。谷胱甘肽是一种保护细胞免受氧化损伤的抗氧化剂,与心脏重塑和功能障碍有密切关系[14]。本研究结果证实,这些代谢通路与CHD血管生成及心脏重塑等密切相关。
本研究也存在不足之处。第一,使用的为羊水样本,检测存在限制;第二,未进行靶向代谢组学验证;第三,每种类型的CHD例数太少,未能深入探究各种CHD类型之间的代谢差异以及CHD检测标志物的差异。在后续的工作中,我们将对现有结果进行验证,并收集更多的CHD病例,以分析不同类型CHD之间检测标志物的差异。
