3例胎儿染色体非整倍体无创产前筛查假阴性病例分析*
2020-11-03王杰董弘武丽琼郭志远安槿张丽春徐睿廷王晓华贾跃旗
王杰,董弘,武丽琼,郭志远,安槿,张丽春,徐睿廷,王晓华,贾跃旗
(1.内蒙古自治区妇幼保健院a.遗传优生科,b.超声医学科,呼和浩特010020;2.内蒙古大学省部共建草原家畜生殖调控与繁育国家重点实验室,呼和浩特 010021)
1997年卢煜明等[1]发现母体血浆中存在胎儿游离DNA(cffDNA),为胎儿染色体非整倍体的无创产前筛查(non-invasive prenatal screening, NIPS)开辟了新的方向。与传统的产前筛查相比,NIPS具有更高的敏感性和特异性。一项荟萃(meta)分析结果表明,NIPS对于T21、T18和T13的检出率分别为99.0%、96.80%和92.1%,假阳性率分别为0.08%、0.15%和 0.2%[2]。另有研究发现,部分假阴性结果与低胎儿浓度和嵌合体有关,但也有一些病例尚未得到解释[3]。由于假阴性更容易引起临床误诊,因此研究假阴性的原因具有重要的临床意义。
本研究对3例经NIPS检测结果为低风险,后经产前及产后跟踪分析诊断为假阴性的病例进行回顾性分析及进一步的检测,评估NIPS发生假阴性的影响因素,并对比不同测序平台及加大测序深度后对假阴性样本的检出效果,总结NIPS在临床应用中的局限性,为检测低风险孕妇的遗传咨询和临床管理提供实验依据。
1 材料与方法
1.1研究对象 收集2018年7月至2019年7月在内蒙古自治区妇幼保健院行NIPS检测提示为低风险的19 242例孕妇,年龄18~47岁,中位年龄32岁,孕周12~37周,平均孕周19周;所有孕妇在1年之内无输血、移植、免疫治疗等异体细胞输入史。后经本院遗传优生科产前及产后染色体核型分析诊断为假阴性病例3例。本研究经内蒙古自治区妇幼保健院伦理委员会审核批准(No.2019-007-1),所有研究对象均知情同意。
1.2主要仪器及试剂 Sorvall ST16R 冷冻离心机、Qubit3.0荧光定量仪、Ion Proton高通量测序仪(美国Thermo Fisher公司),GSL-120全自动染色体核型分析系统(德国Laica公司),Agena MassARRAY飞行时间质谱、COMPLETE GENOTYPING REAGENT SET检测试剂盒(美国Agena公司),QIAamp DNA Blood Mini Kit(德国Qiagen公司),胎儿染色体非整倍体21三体、18三体和13三体检测试剂盒(半导体测序法,中山大学达安基因公司),MGISEQ-500测序仪、胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(联合探针锚定聚合测序法)、染色体拷贝数变异(copy number variations,CNVs)检测试剂盒、测序反应通用试剂盒(联合探针锚定聚合测序法)均购自武汉华大基因科技公司,真空采血管(北京康为世纪公司)。
1.3妊娠管理 NIPS检测为低风险的孕妇经遗传咨询并进行孕期超声跟踪,如胎儿超声检查提示异常人群,于孕18~22周借助于羊膜腔穿刺技术获得羊水细胞进行染色体核型分析,>23周者用脐静脉穿刺技术采集脐带血进行染色体核型分析。孕期无异常者持续跟踪至胎儿出生,如发现特殊面容或符合T21、T18或T13超声异常指征的新生儿,采集外周血进行染色体核型分析检测,并对其孕期影像学检测结果进行回顾性分析。
1.4假阴性样本的实验室质量控制
1.4.1样本混样排查 对样本送检单、知情同意书、检测过程的原始记录及质控记录进行整体回顾,核对送检单上样本编号、姓名的一致性,同时回顾同批次送检样本检测结果,评估混样可能。使用备份白细胞样本、备份血浆文库进行质谱检测,评估检测样本与备份白细胞样本的一致性。
1.4.2备份样本复测 启用备份血浆采用相同的方法进行二次复测,评估2次检测结果的一致性;更换不同检测试剂盒,使用Ion Torrent半导体测序平台进行检测,评估检测方法、测序仪、数据算法的一致性;使用扩展性无创产前筛查(NIPS-Plus)增加测序量(有效数据量≥25 M)、提高测序深度、优化算法评估检测结果的一致性。
1.4.3母体背景排查 使用备份母体白细胞进行染色体微缺失微重复检测(CNV-Seq),排查母体存在微缺失或微重复对检测结果的影响。
1.4.4胎盘嵌合排查 采集假阴性病例胎盘样本,提取基因组DNA进行CNV-Seq,对胎盘组织中染色体情况进行排查。
1.5NIPS(Complete Genomics测序平台) 空腹抽取孕妇孕期外周静脉血5 mL,置于游离DNA专用真空采血管(EDTA-K2抗凝)中,按照本实验室建立的NIPS标准化操作方法[4]进行,经4 ℃、1 600×g离心10 min,取上清液,16 000×g离心10 min去沉淀,收集血浆置于-20 ℃暂存,后转入-80 ℃长期保存。应用联合探针锚定聚合测序法,按照胎儿染色体非整倍体(T21、T18、T13)检测试剂盒说明书操作,并借助于BGI500测序平台进行测序,利用高分辨率成像系统及生物信息系统转换得到待测序列。所得序列经与人参考基因组(如GRCh37/hg19)比对,确定每一测序reads染色体的定位,计算得出标准化Z值。综合运用Y染色体估算法和seqFF估算法,评估样本中胎儿游离DNA比例[5]。当样本满足度量标准(有效数据量≥3.5 M,无扩增偏倚,cffDNA比例≥3.5%)时根据标准化Z值评估检测结果,若Z值的绝对值≥3,提示高风险;Z值介于±3之间,结果为低风险。
1.6NIPS (Ion Torrent半导体测序平台) 根据标准规范及本实验室标准化Ion Torrent半导体测序平台规程[4]进行操作,获得定量后的文库,单个样本终浓度为100 pmol/L,获得pooling文库,再经过乳液PCR扩增并上机测序,获得原始数据。经数据分析后得出最终标准化Z值,采用DNA片段大小估算胎儿DNA浓度[6],当样本满足度量标准(有效数据量≥3.0 M,无扩增偏倚,cffDNA比例≥5%),根据标准化Z值评估检测结果,若Z值的绝对值≥3,提示高风险;Z值介于±3之间,结果为低风险。
1.7NIPS-Plus检测 按照胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(联合探针锚定聚合测序法)说明书操作,采用BGI500测序平台进行测序,通过高分辨率成像系统采集光信号,光信号经过数字化处理后,使用RUPA算法将原始reads比对至hg19/GRCh37参考基因组,经数据分析后得出最终标准化Z值,样本满足度量标准(有效数据量≥25 M,无扩增偏倚,cffDNA比例≥3.5%)。根据标准化Z值评估检测结果,若Z值的绝对值≥3,提示高风险;Z值介于±3之间,结果为低风险。
1.8脐静脉穿刺与外周血染色体核型分析 在超声引导下无菌采集>23周的孕妇脐带血2 mL(肝素抗凝),采集新生儿静脉血2 mL(肝素抗凝)。根据标准规范及本实验室标准化脐带血/外周血培养规程[7]进行操作,使用Trypsin-Giemsa染色法制备染色体G带。Leica GSL-120全自动扫描显微镜和图像分析系统观察高倍显微镜下每份样品至少50个中期相(400~500带分辨率水平),如果有嵌合现象,增加计数分裂相至100个。根据人类细胞遗传学国际命名体制(ISCN)2016版标准进行核型分析诊断,核型评估工作由2名有资质的高级实验室人员独立完成。
1.9拷贝数变异(copy number variations,CNVs)检测 按照QIAamp DNA Blood Mini Kit说明书提取基因组DNA。采用Nanodrop 2000微量紫外分光光度计测定吸光度(A260/280 nm)值,计算DNA浓度及纯度,取A260/280 nm比值为1.8~2.0的样本用于后续试验。将50 ng DNA切割成300 bp大小的片段,通过末端标记法、接头连接和PCR扩增的方式建立DNA文库。使用BGISEQ-500测序平台进行大规模平行测序,生成35 M有效数据量。
应用Burrows-Wheeler算法,以hg19基因组序列为参照,唯一比对到基因组的序列数据量为2.8~3.2 M。根据Decipher、DGV、千人基因组以及OMIM等公共数据库对CNV进行查询,然后根据美国医学遗传学学会(The American College of Medical Genetics and Genomics,ACMG)2015年指南[8]对其致病性进行评估解读。变异被划分为致病、可能致病、致病性未知(VUS)、可能良性或良性。
1.10飞行时间质谱检测 使用Agena MassARRAY飞行时间质谱对母体白细胞及备份血浆文库进行34个单核苷酸多态性(SNP)位点(rs9951171、rs987640、rs985492、rs891700、rs7520386、rs740598、rs722290、rs6444724、rs590162、rs560681、rs521861、rs4789798、rs3780962、rs321198、rs2833736、rs2831700、rs2830795、rs2811231、rs279844、rs2567608、rs2291395、rs214955、rs1872575、rs1736442、rs1554472、rs1523537、rs1498553、rs1478829、rs13218440、rs13182883、rs1109037、rs10768550、rs1031825、rs1004357)的比对,以排除混样可能。如果样本之间有≤3个位点不符合,则判断来源于同一个样本的可能性大;如果样本之间有>3个位点不符合,则判断混样可能性大。
2 结果
2.13例孕妇、新生儿检测结果与干预措施 孕妇1:34岁,孕3产1,孕12+1周超声筛查提示胎儿颈后透明带厚度2.6 mm;孕13周血清学筛查结果提示21三体综合征临界风险,风险值1/766;孕14+6周NIPS检测结果提示低风险,胎儿浓度4.016%,体质指数(BMI)=24.74;随访至孕19+1周,超声提示胎儿双侧脉络丛囊肿(左侧1.3 cm×0.7 cm;右侧1.2 cm×0.8 cm),单脐动脉;孕22+1周,胎儿双顶径5.6 cm,心脏声像改变,右室双出口(SDS)主动脉瓣下室缺,完全型房室间隔缺损,后颅窝池增宽,双手疑似重叠指。经脐静脉穿刺核型分析检测结果为47,XN,+18(图1A),后终止妊娠。
孕妇2:38岁,孕2产1,未进行孕早期胎儿颈项透明层(NT)检测,未行血清学筛查检测;孕16+1周、孕21+2周超声检测未发现胎儿明显异常;孕22+5周NIPS检测结果提示低风险,胎儿浓度6.129%,BMI=24.60。于孕38+6周足月剖宫产1女,Apgar评分9分,精神反应较好,面容表现为眼距宽、低耳位、颈蹼,左右手通贯掌,小指双指节。超声结果提示动脉导管未闭,房间隔多发小缺损,卵圆孔未闭,三尖瓣中量反流,二尖瓣少量反流,肺动脉高压。经外周血染色体核型分析检测后结果为47,XN,+21(图1B)。
孕妇3:29岁,孕2产1,血清学筛查结果为低风险,孕期超声提示单脐动脉,孕21周NIPS检测结果为低风险,胎儿浓度21.686%,BMI=20.70。新生儿出生后外周血染色体核型分析检测结果为47,XN,+21(图1C)。
2.2实验室质量控制排查结果 3例NIPS假阴性样本经核对,样本检测过程未见异常。经飞行时间质谱检测比对的母亲白细胞与文库DNA的34个SNP位点,判断为3例样本文库和白细胞来源一致,未发生标本混样。
2.3NIPS复测结果
2.3.1Complete Genomics与Ion Torrent半导体测序平台NIPS检测结果 3例样本经取备份血浆样本分别使用Complete Genomics NIPS复测、半导体测序平台NIPS检测后,检测结果与Complete Genomics首次检测结果一致,均为低风险(表1)。相应CNVs图示未见异常。

表1 Complete Genomics与Ion Torrent半导体测序平台NIPS检测结果
2.3.2Complete Genomics测序平台NIPS与NIPS-Plus检测结果 3例血浆样本分别进行NIPT-Plus检测,检测结果与NIPS首次检测及复测结果一致,均为低风险(表2)。Complete Genomics测序平台进行的3次测序均未发现CNVs。
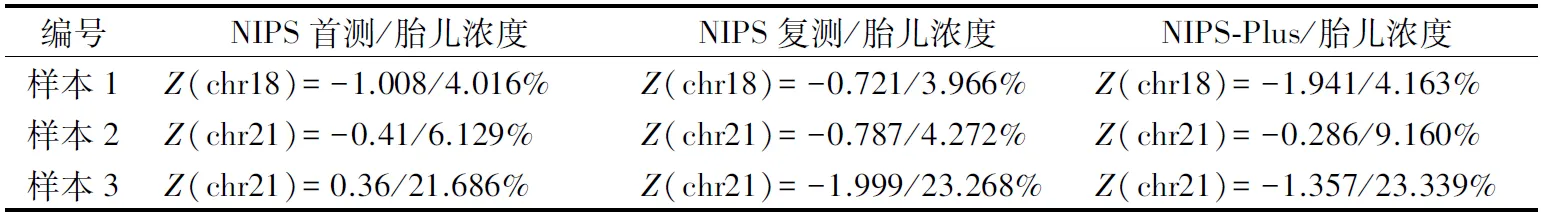
表2 Complete Genomics测序平台NIPS与NIPS-Plus检测结果
2.4母体白细胞及胎盘样本CNVs检测结果 3例样本使用孕妇孕期备份白细胞样本进行CNVs检测,未发现有1 M以上的缺失/重复。获取样本2胎盘胶囊制品(4粒),经CNVs检测提示胎盘样本存在chr21三体嵌合,异常比例分别为25%、25%、25%、24%。见图2。未能取得样本1和样本3的胎盘样本。
3 讨论
近年来,NIPS与侵入性产前诊断结果不符的情况时有报道,目前认为与生物学有关的假阳性因素主要包括CNVs、母体嵌合(maternal mosaicism)、限制性胎盘嵌合体(confined placental mosaicism,CPM)、双胎消失综合征(the vanishing twin syndrome)和孕妇患有恶性肿瘤[9]。相反,DNA浓度过低、嵌合体、胎儿细胞和染色体异常而胎盘染色体正常、母体CNVs、检测Z值的统计学波动是可能造成假阴性的主要原因[10]。但是对于增加测序深度及更换不同测序平台是否会对检测效果出现影响目前尚未见报道。本研究中3例NIPS假阴性样本首先经飞行时间质谱检测发现样本文库和白细胞来源一致,未发生标本混样。
本研究中3例NIPS假阴性病例通过使用Ion Torrent半导体测序平台复测,结果仍为低风险,表明使用不同测序平台对于避免假阴性结果作用有限。近几年发展起来的NIPS-Plus技术将有效数据量提升至≥25 M,进一步优化算法,以实现对更多染色体微缺失微重复的检测。本研究对3例假阴性样本使用NIPS-Plus技术检测,结果显示增加测序深度后未能避免假阴性的发生。孕妇血浆中胎儿DNA含量是影响NIPS准确性的重要参数,胎儿DNA含量较低的样本中可能会出现假阴性结果[6]。对样本1、样本2检测结果进一步分析,发现胎儿DNA含量均偏低(小于10%)。对样本2采集到的胎盘胶囊制品检测,提示存在24%~25%的21三体嵌合,且其胎儿浓度为6.129%,导致用于21三体检测的有效胎儿分数减少(<2.2%),低于NIPS方法的检测阈值(3.5%)[11]。目前对于使用不同检测平台对比的研究较少,在本研究中不同检测平台(Complete Genomics测序平台/Ion Torrent半导体测序平台)使用相应DNA浓度算法未能避免该假阴性的发生。有学者发现,NIPS可检出异常细胞的嵌合率为29%以上的18和21三体嵌合样本,但10%以下嵌合或低胎儿游离DNA浓度会导致假阴性结果[12]。综合上述因素,考虑胎儿浓度与嵌合率均偏低是导致样本2假阴性的原因。
本研究的局限性在于样本量偏少,且未能取得样本1和样本3的胎盘样本,无法排除限制性胎盘嵌合的可能性。考虑到样本1的cffDNA浓度较低,推测可能是造成NIPS检测假阴性的一个重要因素。但样本3在cffDNA浓度比例较高的情况下,依旧出现检测假阴性,可能存在更多的未知原因。这提示在临床中对NIPS检测结果进行咨询的时候,需要适当考虑cffDNA浓度因素。对于NIPS低风险病例,应超声定期随访,如发现超声持续异常,建议进一步遗传咨询和产前诊断,在一定程度上能避免有明显畸形的NIPS假阴性胎儿的出生。同时有效保存孕妇生产后胎盘样本将有助于更好地分析判断假阴性出现的原因。
