高考化学实验题的创新设计和解题策略
2020-11-02王方李凤
王方 李凤

【摘要】化学是以实验为基础的科学,无论是在平时的教学中,还是在高考题中,实验都占据着举足轻重的位置。近年来的高考化学实验题更加注重创新性和独特性,重点考查考生的知识掌握情况和化学核心素养。本文结合最新的高考实验题,对该类题型的创新点和解题策略进行深入分析,并总结一些特点和规律。
【关键词】高考化学 实验题 创新设计 解题策略
【中图分类号】G633.8【文献标识码】A【文章编号】1992-7711(2020)27-169-02
实验是高中化学知识学习的有效方法,也是化学试题的良好载体。2020年《考试大纲》中强调高考更加注重化学学科的特质、认识问题的视角以及化学学科独有的思想和方法,会增加题目的思考容量,更能体现考生的学习潜能、灵活运用所学知识解决实际问题的能力。纵观近几年的全国及地方高考题,实验题的考察逐步趋向于往“新情境”、“新仪器”、“新内容”等创新的方向发展,因此不仅要求学生掌握基本的化学理论知识、实验操作技能和基本方法,还要求学生能够举一反三,从课本上的内容出发,进行合理的知识迁移和重组,突破题目的创新点,方能顺利地解决问题。本文以2020年全国及地方高考化学卷的实验题为例,详细分析了题目中的创新设计和解题策略。
一、实验原理探究的创新
【创新设计】采用电化学装置探究不同物质氧化性或还原性的相对强弱,利用原电池中电子的转移方向来判断电子的得失情况。
【解题策略】本题区别于传统的“以强制弱”的判断方法,利用原电池原理探究不同化合价铁的氧化还原能力,需要考生能够从氧化性和还原性的本质出发,从得失电子的难易程度来进行分析,才能得出正确结论。在上述原电池装置中,左边烧杯中有铁电极及FeSO4溶液,由(3)知电流表显示电子由铁电极流向石墨电极,说明左边烧杯中为负极即失电子的极,由(4)知一段时间后铁电极溶液中c(Fe2+)增加了0.02mol/L,说明负极电极反应为Fe -2e-= Fe2+,由此说明Fe的失电子能力强于溶液中的Fe2+,即还原性强于Fe2+;右边烧杯中为正极即得电子的极,由(4)知石墨电极上未见Fe析出,即Fe2+未得电子,得电子的是Fe3+,因此电极反应为Fe3++e-=Fe2+,说明Fe3+的得电子能力要强于溶液中的Fe2+,即氧化性强于Fe2+,从而得出第(5)问的正确答案。
二、实验过程和方法的创新
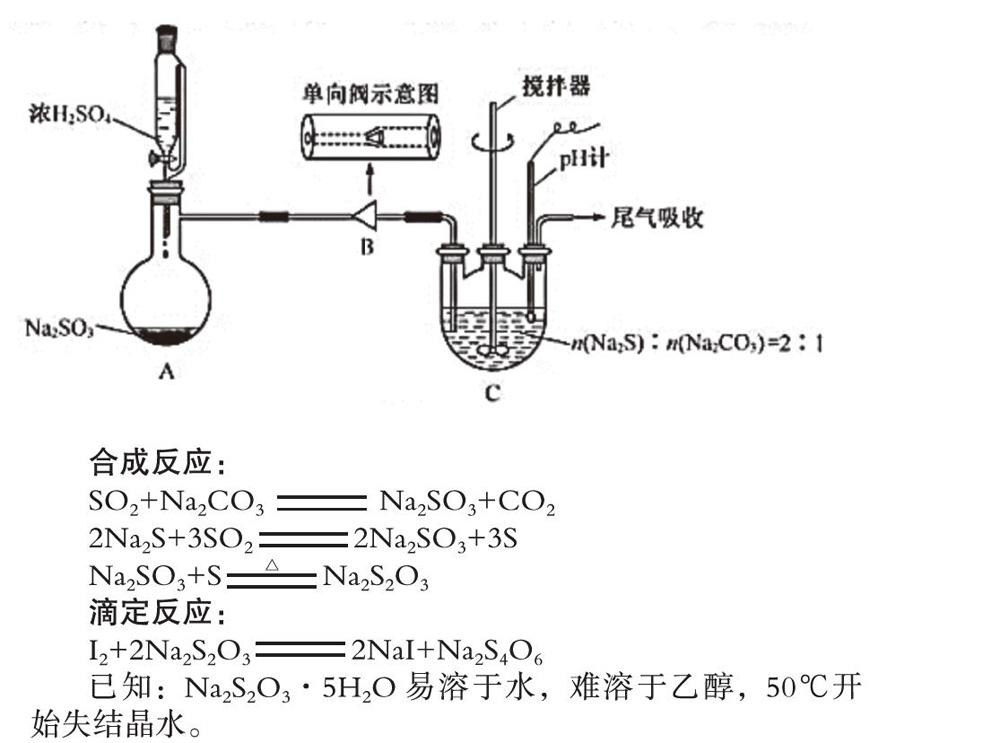
请回答:
(1)步骤Ⅰ单向閥的作用是 ;装置C中的反应混合溶液pH过高或过低将导致产率降低,原因是 。
【创新设计】利用单向阀实现防倒吸的目的,操作简单易行;利用pH计监测反应体系的pH,防止pH过高或过低,保证实验的成功率。
【解题策略】本题利用一系列的反应制备Na2S2O3·5H2O,需要制备并吸收利用SO2气体,从安全性的角度考虑,考生要联想到防倒吸这一关键性的操作,但题中没有采用传统的悬空式、肚容式、储液安全瓶式等传统的防倒吸装置,而是将气体通过单向阀通入反应液中,结合单向阀的特性,不难想到单向阀的主要作用是防倒吸;同时在反应装置中采用pH计来监测反应溶液的pH,因此pH过高或过低都可能会对反应产生不利的影响,结合题目中的已知条件可知,pH过高时,即通入SO2气体较少,可能会导致反应物Na2CO3、Na2S反应不充分,pH过低时,即通入SO2过多时,需考虑到硫代硫酸钠酸性条件下不稳定易歧化生成SO2和S的特性进行回答。
三、产品纯化处理的创新
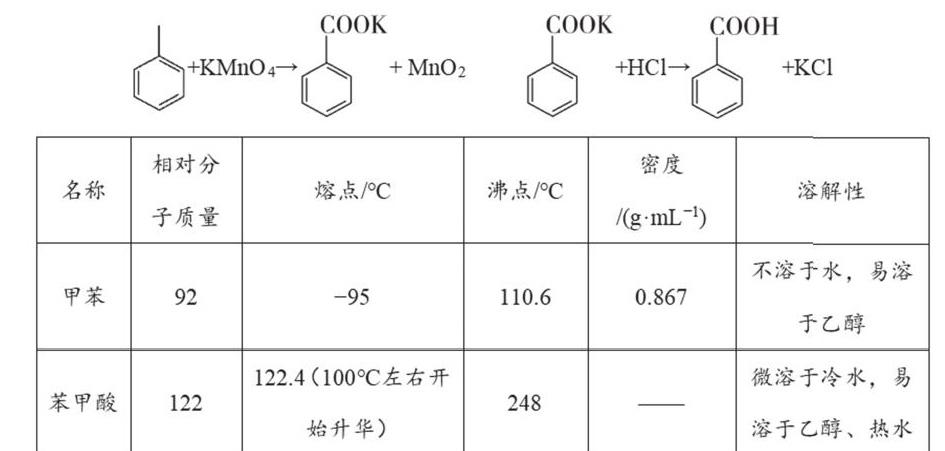
例3 【2020全国Ⅱ卷节选】苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g.
回答问题:
(3)加入适量饱和亚硫酸氢钠溶液的目的是 ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理 。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是 。
【创新设计】反应停止之后,从冷凝管上口加入亚硫酸氢钠溶液,然后趁热过滤,并合并滤液和洗涤液,冷却后加浓盐酸酸化至苯甲酸晶体析出,用冷水洗涤,放在沸水浴上干燥得到粗产品。
【解题策略】从题中所给方程式和表格中可得出有关苯甲酸的关键性信息:弱酸,易升华,微溶于冷水,易溶于乙醇和热水。在第一步的制备过程中需要采用高锰酸钾作为氧化剂,得到苯甲酸钾,然后采用浓盐酸酸化才能得到苯甲酸,此时考生要联想到高锰酸钾和浓盐酸在常温下就可发生反应产生有毒气体Cl2,为了避免该副反应发生,在加入盐酸前要加入一些还原性物质消耗掉高锰酸钾,因此第(3)问中饱和亚硫酸氢钠溶液的目的是去过量的高锰酸钾,避免在用盐酸酸化时,产生氯气,草酸作为一种还原性较强的物质,也可以起到类似的作用,发生反应为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;第(4)问中用热水洗涤滤渣MnO2可以尽可能的将残留在滤渣上的苯甲酸洗下来并合并到滤液中,减少产品的损失;第(5)问中干燥苯甲酸晶体采用沸水浴,而不是直接加热,保证温度不会过高,否则可能会导致苯甲酸晶体的升华。
四、产品纯度计算的创新
例4 【2020山东高考化学卷节选】某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 cmol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL.
样品中所含H2C2O4·2H2O(M=126g·mol-1)的质量分数表达式为 。
下列关于样品组成分析的说法,正确的是 (填标号)。
A. =3时,样品中一定不含杂质
B. 越大,样品中H2C2O4·2H2O含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
【创新设计】样品及杂质均含有还原性较强的离子,简单的氧化还原滴定难以确定样品的纯度,因此在测定样品纯度时分两步进行滴定,需要利用电子守恒列方程进行计算,同时需要根据计算结果对影响产品纯度的因素进行分析。
【解题策略】在第Ⅰ步中,样品溶于稀H2SO4后,会生成H2C2O4,同时溶液中还含有Fe2+,两者都可以消耗KMnO4,其中的变化关系为H2C2O4→CO2、Fe2+→Fe3+、MnO4-→Mn2+,不妨设样品中的FeC2O4·2H2O为x mol,Fe2(C2O4)3为y mol,H2C2O4·2H2O为 z mol,则生成的H2C2O4为(x+3y+z)mol,Fe2+为 x mol,消耗KMnO4为cV1×10-3 mol,根据电子守恒可列式2(x+3y+z)+ x = 5 cV1×10-3,設为①式;在第Ⅱ步中,将Fe3+完全还原为Fe2+,再次用KMnO4溶液滴定,其中的变化关系为Fe2+→Fe3+、MnO4-→Mn2+,其中Fe2+为(x+2y)mol,消耗KMnO4为cV2×10-3 mol,根据电子守恒列式x+2y = 5 cV2×10-3,设为②式,联立①式和②式,即可解得z为 mol,进而求出H2C2O4·2H2O的质量分数为 ×100%;关于样品的组成,根据上述式子可知 =3:时,H2C2O4·2H2O含量为0,但无法确定Fe2(C2O4)3是否存在,所以A选项错误; 越大时,H2C2O4·2H2O的质量分数越大,B正确;铁元素的含量主要是通过第二步的滴定确定的,第一步的滴定不影响铁元素含量的计算,C错误;若所用KMnO4溶液实际浓度偏低,则消耗KMnO4的体积会偏大,导致计算出的铁元素的含量偏大,D正确,因此正确答案为BD.
五、小结
综上所述,高考化学实验题越来越注重科学性、可行性、安全性、简约性,具有以下特点:①情境陌生;②题目信息呈现多样化(图、表、方程式或其他化学用语);③问题贴合实际而非凭空想象;④考察信息的吸收和整合能力、分析和解决问题的能力、实验和探究能力、计算能力等多种能力。作为教师在平常的教学中,要注重创设情境,引导学生进行探究和思考,利用已学知识灵活处理新情境下的实际问题,切实提高学生的化学核心素养。
【参考文献】
[1]李翠红.高中化学实验试题解题策略[J].数理化解题研究,2019(19):94-95.
[2]梁文轩.高考化学实验题的考察热点及解题套路[J].中学生数理化,2019(4):34-40.
