豆清多肽发酵液不同超滤组分抗氧化及抑菌活性
2020-11-02尹乐斌周娟何平李立才赵良忠
尹乐斌 *,周娟,何平,李立才,赵良忠
1. 邵阳学院食品与化学工程学院(邵阳 422000);2. 豆制品加工技术湖南省应用基础研究基地(邵阳 422000)
豆清液是传统豆制品生产蹲脑和压榨过程中产生的废水[1],有研究表明每生产1万 t大豆,可产生9.7万 t的豆清液。随着近年来豆制品行业的飞速发展,以及国家、人民环保意识的增强,豆清液直接排放所带来的环境污染和资源浪费的问题越来越受到关注,豆制品加工废水资源化利用成了必然的趋势。研究表明,传统豆清液综合利用主要集中在活性成分提取[2-4]、豆清发酵液凝固剂开发[5-7]以及豆清液产品开发[8-10]等,在很大程度上促进了豆清液综合利用的发展,但是一直处在摸索探究阶段。近年来,在贵州地区也出现了利用豆清液发酵制备酸汤的研究,为豆清液综合利用提供了新的思路,也得到了行业内的认可,具有较大的应用前景[11]。
豆清多肽发酵液是豆清液经过特定的菌种发酵得到的含豆清多肽的豆清液,是在豆清液微生物发酵的研究基础上,为增加豆清液的附加值而拓展的豆清液综合利用新途径。此次试验通过超滤的方式,将豆清多肽发酵液进行分级,分别测定不同组分的体外抗氧化活性及抑菌活性,并与未发酵的豆清多肽进行比较,以期以最简单的方式了解不同超滤组分的生理活性功能,为进一步开发豆清多肽类产品提供理论依据和方法参考。
1 材料与方法
1.1 主要原料与试剂
豆清液(收集于实验室);乳酸菌(实验室分离鉴定);N, N-亚甲基双丙烯酰胺、丙烯酰胺(国药集团化学试剂有限责任公司);十二烷基硫酸钠(SDS)、甘氨酸、β-巯基乙醇(北京鼎国生物技术有限责任公司);三羟甲基氨基甲烷(Tris,天津市光复精细化工研究所);溴酚兰、考马斯亮蓝R-250:生工生物工程(上海)股份有限公司;TEMED;过硫酸铵(西陇科学股份有限公司);2,2-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)[2,2’-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]、1, 1-二苯基-2-苦肼基自由基(1, 1-Diphenyl-2-picrylhydrazyl free radical,DPPH):上海如吉生物科技发展有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
培养箱;SW-CJ-2FD双人单面(垂直)净化工作台(江苏通净净化设备有限公司);UV2900紫外-可见分光光度计(上海恒平科学仪器有限公司);SCIENTZ-18N冷冻干燥机(宁波新芝生物科技股份有限公司);微滤机组(配制10 kDa,5 kDa,3 kDa和800 Da的超滤膜,上海摩速科学器材有限公司);Czone系列抑菌圈测量及菌落计数仪(杭州迅数科技有限公司)。
1.3 试验方法
1.3.1 豆清多肽发酵液制备
在已有的研究基础上,将新鲜豆清液经过高压蒸汽灭菌(121 ℃,20 min)后将实验室已有乳酸菌种:鼠李糖乳杆菌3-1(Lɑctobɑcillus rhɑmnosusstrain 3-1)、玉米乳杆菌5-1(Lɑctobɑcillus zeɑestrain 5-1)、副干酪乳杆菌5-2(Lɑctobɑcillus cɑseistrain 5-2),按1︰1︰1的比例接种到豆清液中,菌种添加量为豆清液体积的4%,在37 ℃下发酵12 h,得到豆清多肽发酵液。
1.3.2 超滤分离
将豆清多肽发酵液和未发酵的豆清液分别离心(4 000 r/min,15 min),然后分别通过纤维膜和10 kDa,5 kDa,3 kDa和800 Da的超滤膜,设置压力60 MPa,室温下进行回流超滤。样液初始体积为1 500 mL,首先通过纤维膜过滤不溶性物质,然后通过10 kDa的超滤膜,当截留液体积剩下200 mL时,收集截留液,将滤过液继续通过5 kDa的超滤膜,当截留液剩下200 mL时,收集截留液,将滤过液继续通过3 kDa的超滤膜,依次类推由大到小经过超滤膜。分别收集>10 kDa,5~10 kDa,3~5 kDa,800 Da~3 kDa和<800 Da的组分。将收集的不同组分样品冷冻干燥,于-20 ℃保存备用。
1.3.3 SDS-聚丙烯酰氨凝胶电泳
采用不连续体系垂直板电泳对发酵和未发酵的豆清多肽相对分子质量分布进行分析,电泳浓缩胶的浓度为5%,分离胶浓度为12%。凝胶厚度为1 mm。在泳道中分别加入10 μL Marker未发酵和发酵豆清多肽冻干粉供试品溶液各30 μL,开始电泳。设置浓缩电泳电压80 V、分离胶电泳电压120 V,待溴酚蓝染液完全迁移出凝胶后停止电泳。用0.05%的考马斯亮蓝G-250染液染色30 min,用脱色液(水-乙醇-冰乙酸体积比为60︰30︰10)进行脱色,到条带清晰为止,重复3次。
1.3.4 体外抗氧化活性测定方法
OH自由基清除率测定参考Smirnoff等[12]的方法;ABTS自由基清除率测定参考Re等[13]的方法;DPPH自由基清除率测定参考Moyo等[14]的方法。
1.3.5 抑菌活性测定
抑菌活性的测定采用牛津杯法,通过不同超滤组分抑菌圈大小判断其对大肠杆菌及金黄色葡萄球菌的抑制效果。菌悬液制备:将供试大肠杆菌和金黄色葡萄球菌从固体斜面培养基上接种至平板上,于37 ℃培养24 h,连续转接两代。在无菌条件下,取活化好的菌株,用接种环分别挑取1环已活化好的菌种放入9 mL无菌生理盐水中,振荡摇匀,制成一系列菌悬液,浓度为107~108CFU/mL,备用[15]。用移液枪吸取100 μL菌悬液于平板中,用涂布棒涂布均匀,无菌操作,在培养基表面垂直放上牛津杯(内短6 mm、外径8 mm、高10 mm),轻轻加压,使其与培养基接触无空隙,在杯中加入100 μL豆清多肽的不同超滤组分样品,勿使其外溢,每个样品重复3次[18],在37 ℃培养箱中培养24 h,观察抑菌圈大小,采用全自动菌落分析仪,测量每个培养皿中抑菌圈的直径,取平均值。无菌水作为空白对照[16-17]。
1.4 数据处理
试验数据运用Origin 9.0进行处理分析,运用SPSS软件进行统计分析,每组试验平行3次,取平均值。
2 结果与分析
2.1 发酵与未发酵SDS-聚丙烯酰氨凝胶电泳结果
凝胶电泳的结果如图1所示。对比Marker可知,未发酵豆清多肽在20~31 kDa以及31~45 kDa之间出现条带,但大部分成弥散状态,这可能是制备豆腐的过程中大豆的浸泡时间较长,大豆的内源蛋白酶对其蛋白质的分解作用相关[19],而发酵过后的豆清多肽没有条带,说明发酵对蛋白质有降解作用,发酵过后多肽的相对分子质量减小,这与刘丽莎等[20]的研究结果相似。
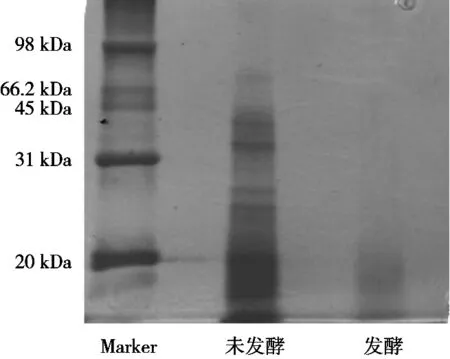
图1 发酵与未发酵SDS-聚丙烯酰氨凝胶电泳结果图
2.2 不同超滤组分体外抗氧化结果
2.2.1 不同超滤组分对DPPH自由基清除效果比较
DPPH是一种稳定的氮中心自由基,由于其具有单电子,其醇溶液在517 nm具有明显的吸收峰,当DPPH中单电子与其他抗氧化中的单电子配对时,517 nm处吸光度降低,由于这种变化与接受电子数量呈定量关系,所以DPPH常被用作体外抗氧化的分析试剂[21]。从DPPH的清除效果来看,发酵和未发酵的样品均对DPPH自由基表现出一定的清除活性(图2和表1)。从不同超滤组分上看,无论是发酵还是未发酵样品,800 Da~3 kDa组均比其他组分的清除活性要强,在统计学上有显著差异(p<0.05),这与周婷婷等[22]的研究结果5 kDa以下相对分子质量的大豆多肽自由基清除能力较强结果一致。对比发酵和未发酵样品可以发现,经过发酵以后样品的DPPH清除活性在一定程度上有所提高,这可能与低相对分子质量的多肽含量增加,更多能与自由基结合的活性位点暴露出来有一定的关系。

图2 不同超滤条件对样品DPPH清除活性

表1 不同超滤条件发酵与未发酵DPPH清除效果EC50值
2.2.2 不同超滤组分对ABTS自由基清除效果比较
2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐,与过二硫酸钾反应,生成绿色的ABTS自由基,在734 nm处有特征吸收峰,当ABTS溶液与具有抗氧化活性的物质反应时,体系颜色降低,在734 nm处的吸光度降低,由于其反应灵敏、操作简单,也经常被用作体外抗氧化活性的评定标准[23]。如图3所示,从不同超滤组分分析,在800 Da~3 kDa相对分子质量范围内的样品表现出较强的ABTS自由基清除活性,比同类型其他组分样品清除活性强,但同一类型(发酵和未发酵)不同超滤组分之间对ABTS清除能力强弱没有发现规律。比较同一组分发酵和未发酵超滤样品的清除活性可以得出,经过发酵部分组分的清除效果有所提高(>10 kDa,3~5 kDa和<800 Da),但是5~10 kDa和800 Da~3 kDa组分样品发酵和未发酵的EC50值没有显著差异(p>0.05),见表2。
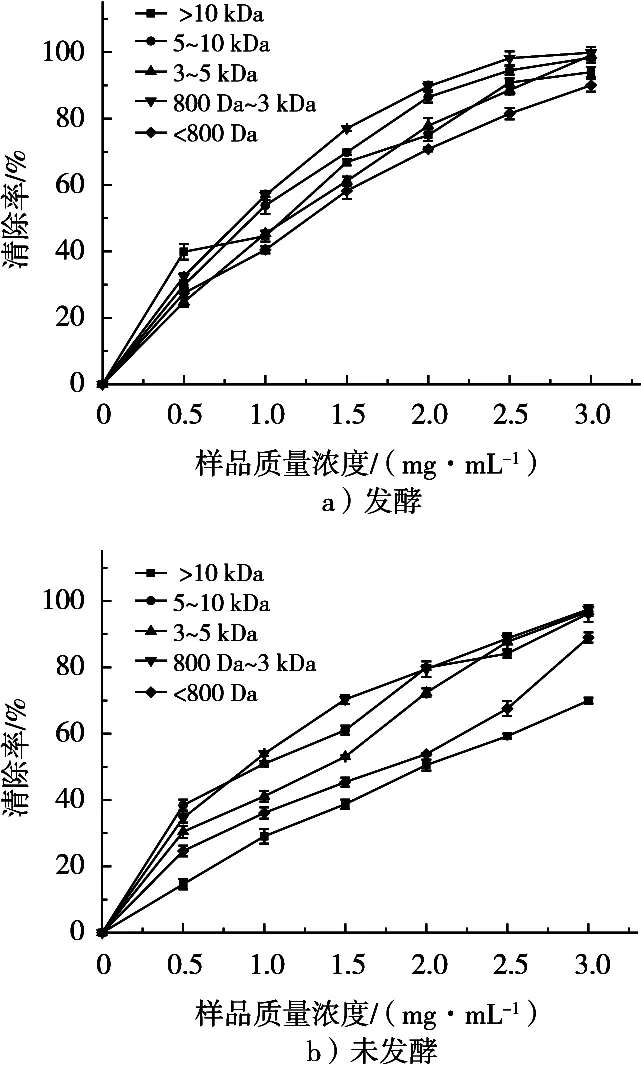
图3 不同超滤条件对样品ABTS清除活性
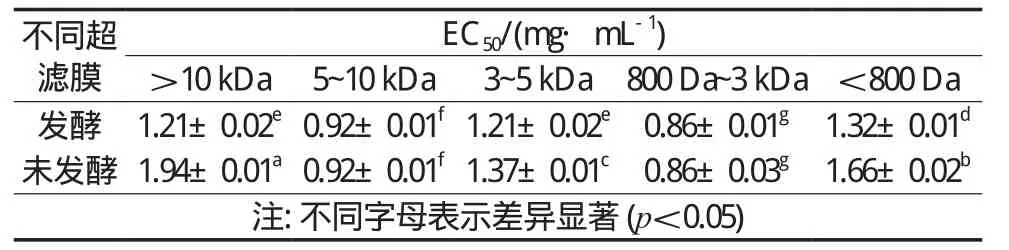
表2 不同超滤条件发酵与未发酵ABTS清除效果EC50值
2.2.3 不同超滤组分对OH自由基清除效果的比较
OH自由基是生物体内最重要的活性氧自由基之一,是活性氧中对生物体毒性最强,危害最大的一种自由基,与细胞辐射损伤、肿瘤、衰老等密切相关[24-25]。因此,OH自由基的清除效果常被作为体外抗氧化活性的重要考察标准。从表3可以看出,发酵和未发酵组分对OH自由基均表现出较强的清除效果,活性最强的组分当其清除活性达到50%时,样品的浓度为1.06±0.02 mg/mL。从不同超滤组分来看(图4),800 Da~3 kDa的组分依然表现出最强的清除活性,与其他组分存在显著差异(p<0.05),不同组分之间的清除效果依然没有规律;但是通过比较,在800 Da~5 kDa之间,表现出相对分子质量越小,清除活性越强的规律,这与郁晓敏等[26]的研究结果抗氧化性和稳定性最好的大豆肽组分的相对分子质量在1 200~1 400 Da之间结果相似。比较发酵与未发酵各组分的OH自由基清除活性可以看出,经过发酵以后,各组分的清除效果均有所提高,提高最大的组分(>10 kDa)其EC50浓度降低了2.3 mg/mL,可能的原因与发酵使多肽与自由基结合的基团暴露出来有关。
2.3 不同超滤组分抑菌活性分析
2.3.1 不同超滤组分对大肠杆菌的抑制效果分析
豆清液在发酵过程中乳酸菌利用豆清液中的营养物质,一方面水解大分子蛋白质,另一方面产生有机酸,特别是乳酸,使得发酵后不同的豆清液组分具有一定的抑菌效果,另外发酵过程中抑菌素产生也是使发酵液具有抑菌效果的原因[27]。对比发酵和未发酵的抑菌效果可以得出,发酵过后各组分均对大肠杆菌存在一定的抑菌活性,在平板中出现了比较明显的抑菌圈,但是未发酵的样品几乎未出现抑菌圈,在添加3~5 kDa及5~10 kDa未发酵样品的牛津杯周围的细菌生长状况还比其他地方的细菌生长状况要好,说明未发酵的3~5 kDa及5~10 kDa样品可能对大肠杆菌的生长状况有促进作用。比较发酵样品不同超滤组分的抑菌圈直径大小(表4)可以得出,>10 kDa的组分抑菌圈最小,800 Da~3 kDa的组分抑菌圈最大。当超滤膜孔径大于800 Da时,各组分之间存在随着膜孔径减小,各组分对大肠杆菌的抑制活性增强的趋势,但<800 Da的组分对大肠杆菌的抑制活性小于800 Da~3 kDa的组分,与3~5 kDa无显著差异。
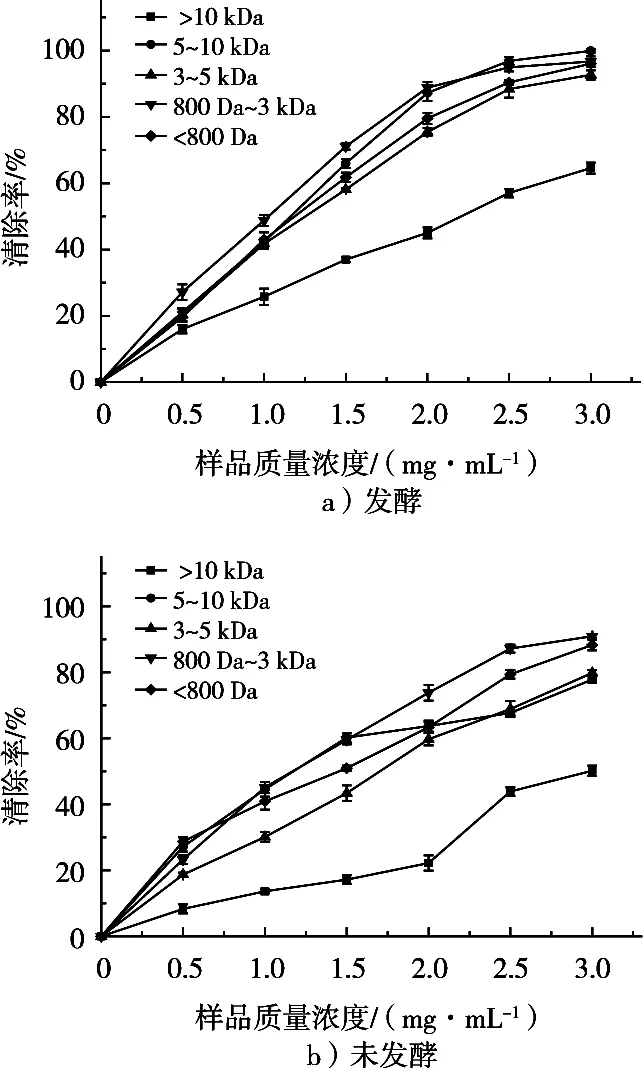
图4 不同超滤条件对样品OH自由基清除活性

表3 不同超滤条件发酵与未发酵OH自由基清除效果EC50值
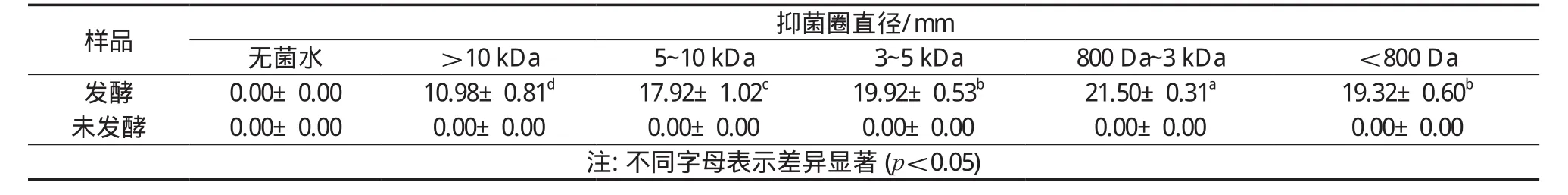
表4 不同超滤组分发酵与未发酵样品对大肠杆菌抑菌圈直径
2.3.2 不同超滤组分对金黄色葡萄球菌的抑制效果分析
金黄色葡萄球菌是革兰氏阳性菌,其细胞壁主要由肽聚糖和磷壁酸组成,抑菌机制和革兰氏阴性菌有一定的差异。不同超滤组分对金黄色葡萄球菌的抑制效果和大肠杆菌有一定的区别。虽然不同超滤组分的豆清多肽发酵液对金黄色葡萄球菌有一定的抑制效果,平板上面出现了较明显的抑菌圈,但是抑菌圈中间有一部分细菌又有重新生长的趋势。从抑菌圈直径大小(表5)分析,800 Da~10 kDa之间各组分没有显著差异,>10 kDa的部分表现出的抑菌活性较其他组分要稍弱一些。这可能与相对分子质量较大的组分将抑菌类物质包裹,无法发挥作用有关。未发酵的样品对金黄色葡萄球菌未表现出抑制活性。具体原因还需要进一步探讨。
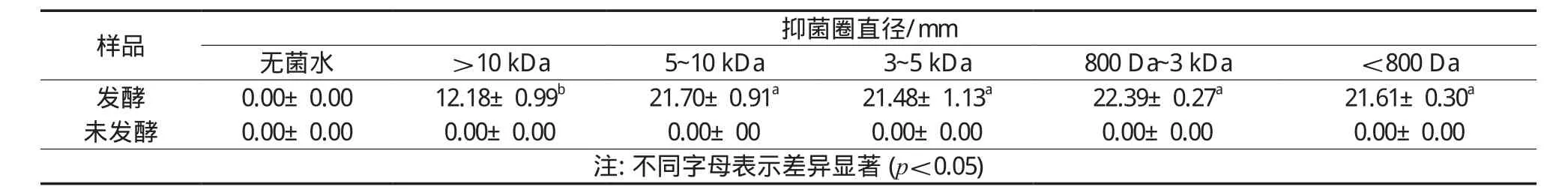
表5 不同超滤组分发酵与未发酵样品对金黄色葡萄球菌抑菌圈直径
3 结论
1) 通过乳酸菌发酵的方式得到了豆清多肽发酵液,通过SDS-聚丙烯酰胺凝胶电泳对发酵后得到的豆清多肽和未发酵豆清液中的多肽物质进行比较分析,结果表明,未发酵的豆清多肽相对分子质量分布在20~45 kDa之间,经过发酵后多肽相对分子质量在20 kDa以下,说明发酵使豆清液中蛋白质发生了降解。
2) 通过超滤技术对豆清多肽发酵液和新鲜豆清液进行了分离处理,得到>10 kDa,5~10 kDa,3~5 kDa,800 Da~3 kDa和<800 Da的组分。对发酵和未发酵样品的DPPH,ABTS,和OH自由基的清除效果进行了比较分析,发现发酵和未发酵的样品各组分均对这几种自由基显示出较强的清除活性,经过发酵以后清除活性在一定程度上有所增强,其中发酵的800 Da~3 kDa组分样品表现出最强清除活性。
3) 对发酵和未发酵不同超滤组分的抑菌活性进行探究,结果表明,经过发酵的样品对大肠杆菌和金黄色葡萄球菌均有抑制效果:对大肠杆菌的抑制效果,800 Da~3 kDa的组分效果最好;对金黄色葡萄球菌的抑制效果,<10 kDa的组分没有显著差异。
