微波-超声辅助双水相提取藜麦皮皂苷工艺
2020-11-02杨洁高佳丽辛燕花鞠韬赵二劳
杨洁*,高佳丽,辛燕花,鞠韬,赵二劳
1. 忻州师范学院化学系(忻州 034000);2. 忻州师范学院生物系(忻州 034000)
藜麦(Chenopodium quinoɑWilld.)为藜科藜属双子叶一年生草本植物,其种子营养全面而独特,被联合国粮农组织认定的唯一一种单体植物即可满足人体基本营养需求的食物,誉为“未来的超级谷物”和“有机谷类之王”[1]。藜麦原产于南美洲安第斯山区,中国1987年开始引种,现山西、青海、陕西、四川和宁夏等地已规模化种植[2],资源较为丰富。藜麦皮是藜麦生产加工中的副产品,多被用作饲料或废弃,既造成资源的浪费,又污染环境。研究表明,藜麦皮中含有皂苷,具有抗氧化、调节免疫[3]、抗炎性[4]、抗肿瘤[5]和抑菌[6-7]等多种功能活性,在医药、食品、保健品等领域中具有广泛的应用前景。因此,研究藜麦皮中皂苷的提取,对于藜麦皮的高值化利用、有效拉长藜麦产业链、提高藜麦的经济价值具有重要的实际意义。
已有一些藜麦皮中皂苷的提取研究报道,如许效群等[8]研究藜麦麸皮中皂苷的乙醇回流提取,杨洁等[9]研究藜麦皮皂苷的微波辅助乙醇提取,但相关研究很不充分,且未见超声-微波联合辅助提取的研究报道。基于双水相体系提取皂苷优势,研究超声-微波辅助双水相提取藜麦皮中皂苷,采用单因素试验结合响应面法优化其提取工艺,为藜麦皮中皂苷的有效开发应用提供科学依据。
1 材料与方法
1.1 材料与试剂
藜麦皮(山西华青藜麦产品开发有限公司)。石油醚脱脂后,烘箱中60 ℃烘干,粉碎过60目筛,密封保存备用。
1.2 仪器与设备
XH-200A电脑微波固液相合成/萃取工作站(北京祥鹄科技发展有限公司);KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司);V-1100D型紫外可见分光光度计(上海美谱达仪器有限公司);AL204型电子天平(梅特勒-托利多仪器上海有限公司)。
1.3 试验方法
1.3.1 标准曲线曲线绘制
参考文献[10]的方法,准确称取5.0 mg齐墩果酸标准品,甲醇溶解定容至100 mL,得质量浓度0.05 mg/mL的齐墩果酸标准溶液。分别准确移取齐墩果酸标准溶液0.20,0.40,0.60,0.80,1.00,1.20和1.40 mL于10 mL具塞试管中,挥干溶剂,都加入0.2 mL 5%香草醛-冰醋酸溶液、0.8 mL高氯酸,加塞摇匀,于70℃水浴反应15 min,取出后用冰水浴冷却5 min,加入5 mL冰醋酸稀释,摇匀,静置10 min。以试剂空白为参比,波长546 nm处测其吸光度。以吸光度A为纵坐标,齐墩果酸浓度c(mg/mL)为横坐标,绘制标准曲线,得回归方程A=63.171 4c-0.037 7,R2=0.999 2。
1.3.2 藜麦皮中皂苷测定及测定
准确称取1.0 g藜麦皮,按试验设计进行微波-超声辅助双水相提取,提取结束后静置分层,取上清液定容为50 mL。
准确移取一定体积提取液,按1.3.1中方法测定其皂苷浓度,并按式(1)计算皂苷提取率。
标准配送式变电站采用面向间隔与功能的模块化设计原则,形成“预制舱式二次组合设备+预制式组合二次设备+预制式智能控制柜”的模块化设计方案[1]。标准配送式变电站站内二次设备模块主要包括预制舱式二次组合设备、预制式智能控制柜、预制式组合二次设备,其中公用二次设备采用模块化二次组合设备,布置于装配式建筑物内;各电压等级及主变间隔二次设备采用预制舱式二次组合设备,布置于配电装置场地;合并单元、智能终端等二次设备选用预制式智能控制柜,与汇控柜一体化布置于配电装置场地[2]。

1.4 单因素试验
固定其他条件不变,分别考察醇水比值(0.65,0.70,0.75,0.80和0.85)、料液比(1︰30,1︰40,1︰50,1︰60和1︰70 g/mL)、加盐(磷酸氢二钾)量(1.5,2.5,3.5,4.5和5.5 g)、微波功率(400,50,500,550和600 W)、微波时间(1.0,1.5,2.0,2.5和3.0 min)、微波温度(30,40,50,60和70 ℃)、超声功率(240,280,320,360和400 W)、超声时间(5,10,15,20和25 min)和超声温度(20,30,40,50和60 ℃)对皂苷提取率的影响。
1.5 响应面法优化藜麦皮皂苷提取工艺
根据单因素试验结果,选取对皂苷提取率影响较大的醇水比值、料液比、加盐量、微波功率4个因素为自变量,以皂苷提取率(Y)为响应值,采用Design Expert 8.0.6软件设计响应面试验。试验因素及水平见表1。

表1 Box-Behnken响应面试验因素和水平
2 结果与分析
2.1 单因素试验
2.1.1 醇水比值对皂苷提取率的影响
醇水比值对皂苷提取率的影响见图1。藜麦皮皂苷提取率随醇水比值增加而先增后降。醇水比值0.75时,皂苷提取率达最大。这可能与藜麦皮皂苷的极性有关,醇水比值0.75时与藜麦皮皂苷极性相当,有利于皂苷的溶出。因此,选择醇水比值0.75。
2.1.2 料液比对皂苷提取率的影响
料液比对皂苷提取率的影响见图2。藜麦皮皂苷提取率在一定范围内随着料液比减小而增大,料液比1∶60(g/mL)时,藜麦皮皂苷提取率达最大;料液比小于后,随料液比减小提取率略有减小。其原因可能是随料液比减小,溶剂量增大,有利于皂苷的溶出,提取率增大;料液比达到一定值后,藜麦皮中皂苷已基本溶出,再增加溶剂量,也不能增加皂苷溶出量,导致提取率减小。因此选择料液比1∶60(g/mL)。
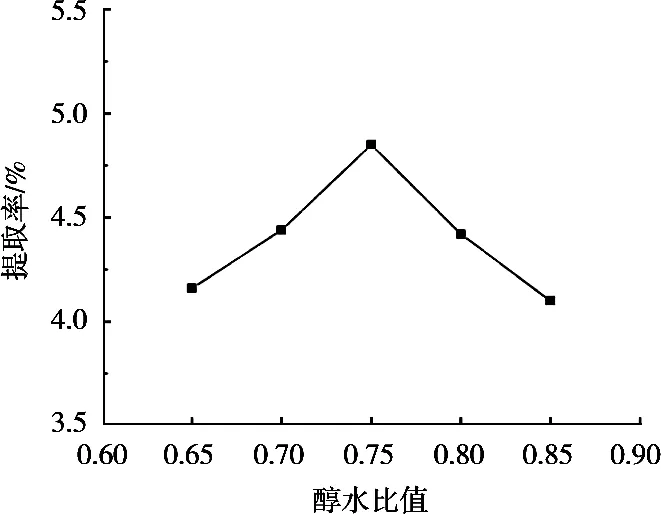
图1 醇水比值对提取率的影响

图2 料液比对提取率的影响
2.1.3 加盐(磷酸氢二钾)量对皂苷提取率的影响
加盐(磷酸氢二钾)量对皂苷提取率的影响见图3。随加盐量增加藜麦皮皂苷提取率先增后降。加盐量3.5 g时,藜麦皮皂苷提取率达最;加盐量大于3.5 g后,随着加盐量增大皂苷提取率减小。其原因可能是加盐量增加,水相体积增加,使得上相乙醇相浓度增大,有利于皂苷溶出;加盐量过大时,水相可能产生一定盐析效应使提取率下降[11]。因此,选择加盐量为3.5 g。
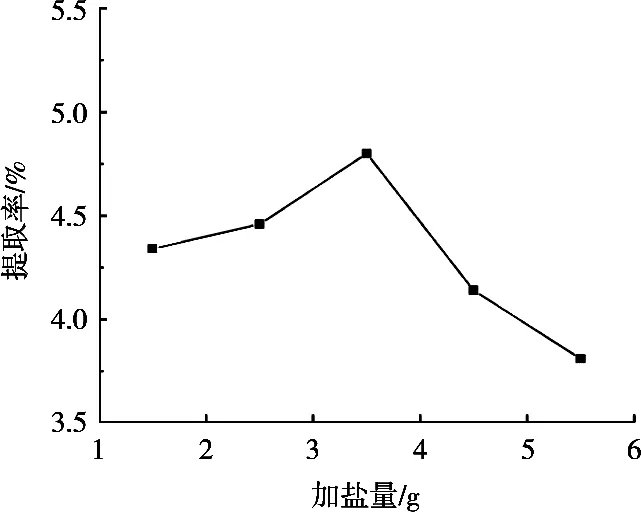
图3 加盐量对提取率的影响
2.1.4 微波功率对提取率的影响
微波功率对提取率的影响见图4。微波功率小于450 W,随微波功率增加皂苷提取率增加;微波功率450 W时,皂苷提取率达最大;微波功率大于450 W后,随微波功率增大皂苷提取率下降。其原因可能是微波功率过小,皂苷溶出不完全,增加微波功率,有利于皂苷溶出,但微波功率过高会破坏皂苷结构[12],导致提取率降低。因此,选择微波功率为450 W。
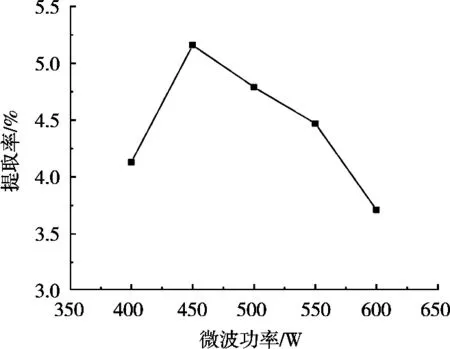
图4 微波功率对提取率的影响
2.1.5 微波时间对皂苷提取率的影响
微波时间对皂苷提取率的影响见图5。微波时间1.5 min时,藜麦皮皂苷提取率达最大。微波时间大于1.5 min后,随微波时间增加皂苷提取率降低。可能原因是随微波时间增加,会使部分皂苷氧化降解,导致皂苷提取率降低[13]。因此,选择微波时间为1.5 min。

图5 微波时间对提取率的影响
2.1.6 微波温度对皂苷提取率的影响
微波温度对皂苷提取率的影响见图6。藜麦皮皂苷提取率随微波温度增加先增后降,微波温度达到40 ℃时,皂苷提取率最大,之后随微波温度增大而减小。其原因可能是微波温度升高,有利于分子扩散,加快皂苷的溶出,但温度过高,会使部分皂苷分解,导致提取率下降[13]。因此选择微波温度为40 ℃。
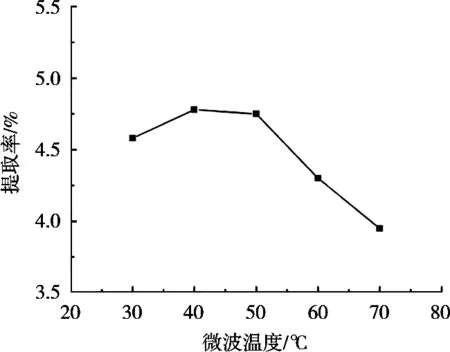
图6 微波温度对提取率的影响
2.1.7 超声功率对皂苷提取率的影响
超声功率对皂苷提取率的影响见图7。藜麦皮皂苷提取率随超声功率增加而增大,超声功率的增加有利于皂苷的提取。但总体而言,在试验的超声功率范围内,随超声功率增大,皂苷提取率变化不大。因此,选择超声功率为400 W。
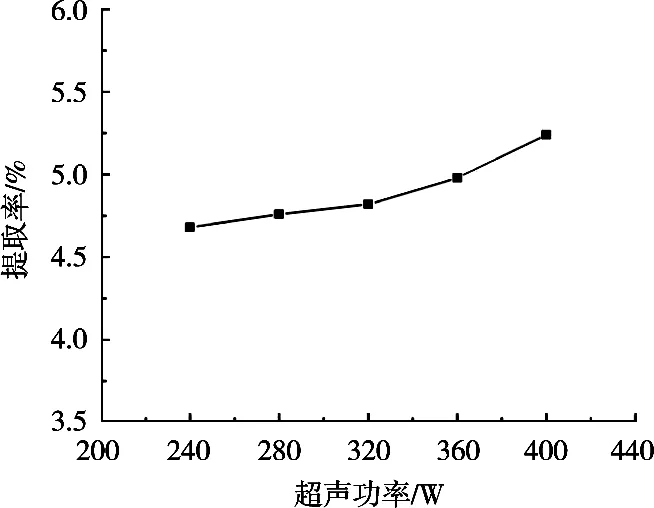
图7 超声功率对提取率的影响
2.1.8 超声时间对皂苷提取率的影响
超声时间对皂苷提取率的影响见图8。藜麦皮皂苷提取率随超声时间延长增加,超声时间达到10 min时,皂苷提取率达最大;随着超声时间延长而减小。可能是由于超声时间短,皂苷溶出不完全,提取率低,但时间过程会破坏某些皂苷类成分结构,导致提取率下降[13]。因此,选择超声时间为10 min。
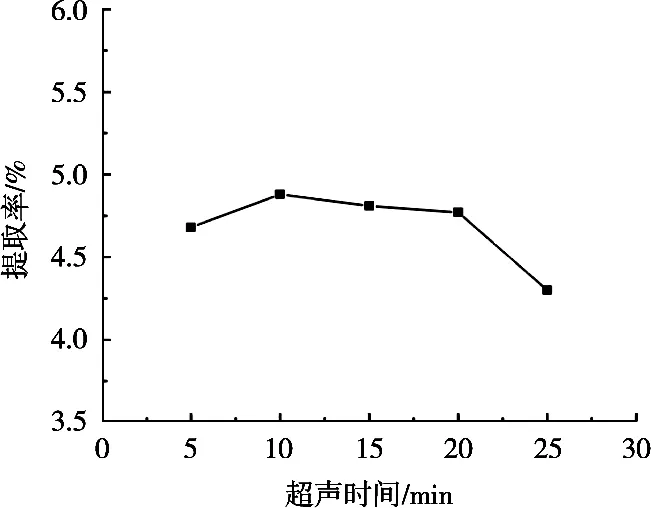
图8 超声时间对提取率的影响
2.1.9 超声温度对皂苷提取率的影响
超声温度对皂苷提取率的影响见图9。藜麦皮皂苷提取率随超声温度升高而增大,在超声温度50 ℃时,藜麦皮皂苷提取率达到最大,之后随超声温度升高,过高温度会破坏皂苷结构,导致提取率降低。因此选择超声温度为50 ℃。
2.2 响应面试验
2.2.1 响应面试验方案与结果
根据单因素试验结果,固定超声功率400 W,超声时间10 min,超声温度50 ℃,微波时间1.5 min,微波温度40 ℃,选择对提取影响较大的醇水比值、料液比、加盐量和微波功率4因素,进行四因素三水平响应面分析试验。响应面试验方案与结果见表2。回归方程的方差分析见表3。
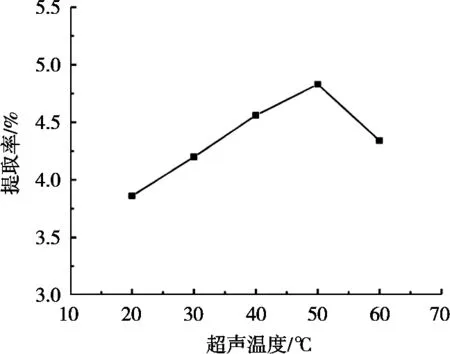
图9 超声温度对提取率的影响
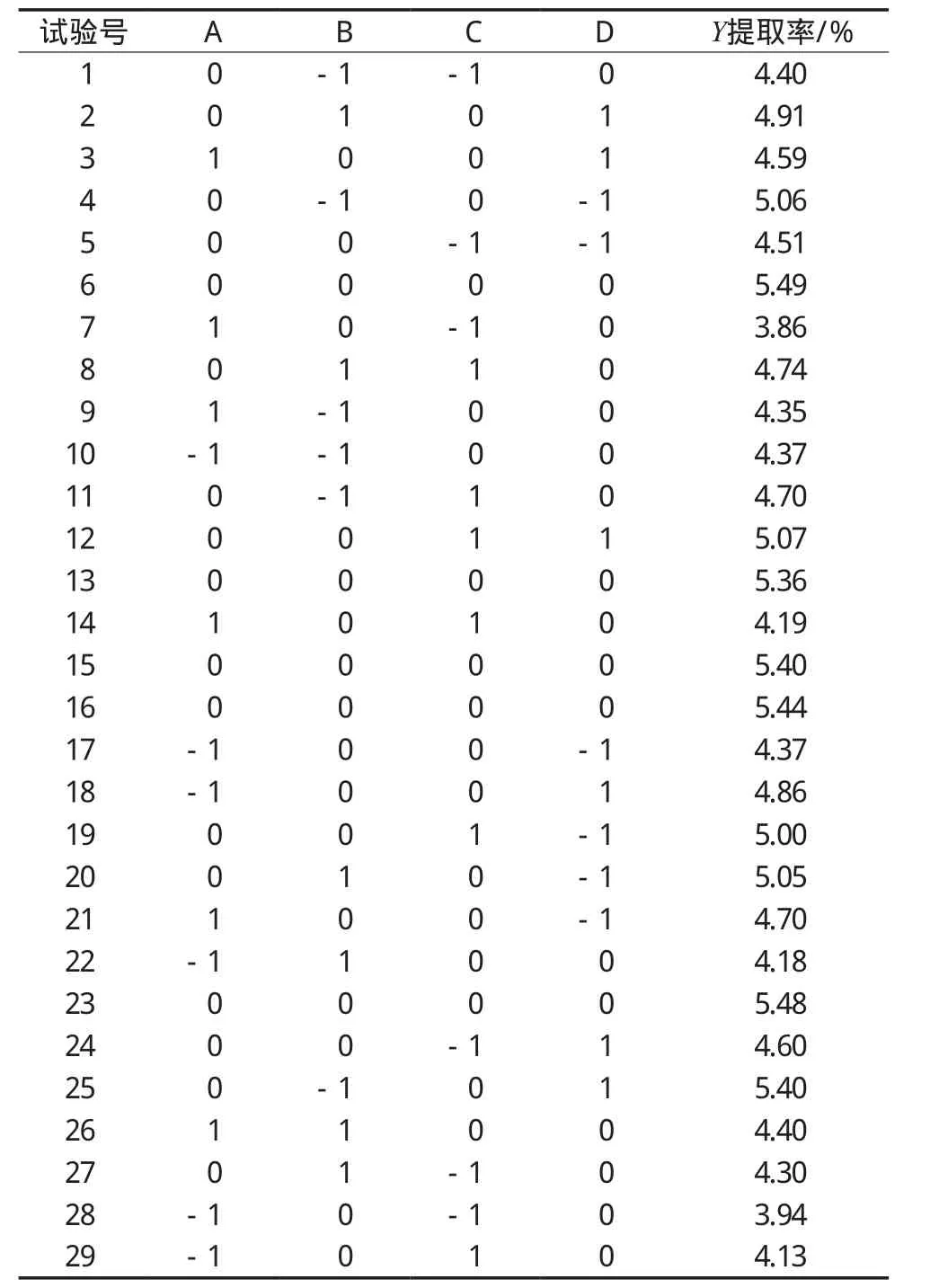
表2 响应面试验设计与结果
2.2.2 二次多项回归方程及方差分析
利用Design Expert 8.0.6软件对表2数据进行二次多元回归拟合,得皂苷提取率(Y)与醇水比值(A)、料液比(B)、加盐量(C)和微波功率(D)的回归方程为:Y=5.43+0.020A-0.058B+0.19C+0.062D+0.060AB+0.035AC-0.15AD+0.035BC-0.12BD-5.000E-003CD-0.79A2-0.30B2-0.61C2-0.022D2。
由表3方差分析可知,模型回归极显著(p<0.01),失拟项不显著(p>0.05),且模型R2=0.988 1,调整相关系数R2Adj=0.976 2,说明试验误差小,该模型拟合程度良好,能很好地描述试验结果。变异系数CV=1.59%,说明试验操作稳定,可信度高[14]。由各项方差分析结果可知影响藜麦皂苷提取率的因素大小顺序为加盐量>微波功率>料液比>醇水比值,且加盐量的一次项达到极显著水平(p<0.01),料液比、微波功率的一次项达到显著水平(p<0.05);除微波功率外,其他因素的二次项对皂苷提取率的影响均为极显著(p<0.01)。表明各因素对皂苷提取率的影响不是简单的线性关系。
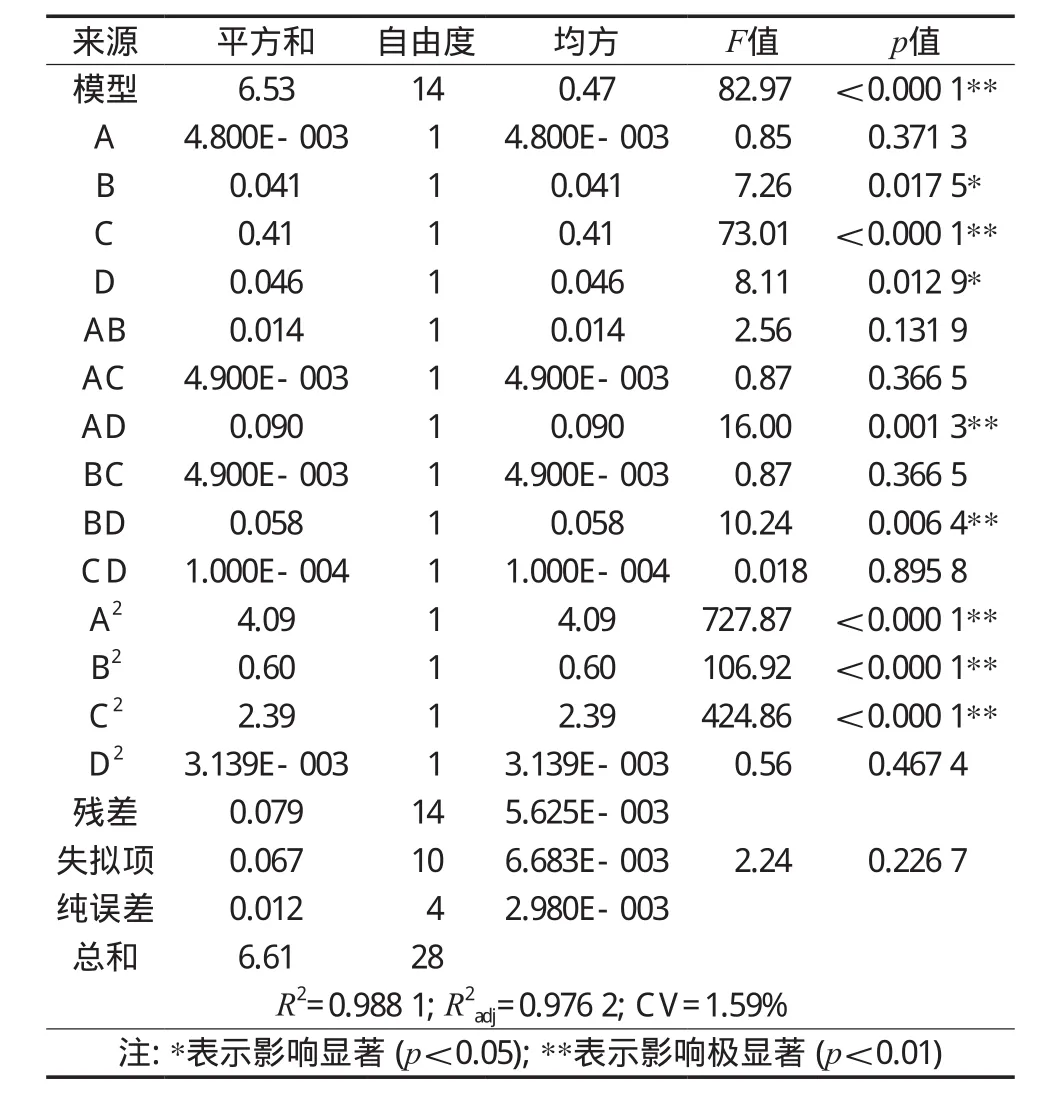
表3 方差分析
2.2.3 各因素交互作用分析
利用Design Expert 8.0.6软件作二因素响应面图,研究影响藜麦皮皂苷提取率的各因素交互作用,结果见图10~图15。响应面曲面倾斜度越高,即坡度越陡,等高线越椭圆,交互作用越显著[15],显见,醇水比值和微波功率、料液比和微波功率之间交互极显著(p<0.05),这与模型的方差分析结果一致。

图10 料液比与醇水比值对藜麦皮皂苷提取率影响的交互作用曲面图

图11 加盐量与醇水比值对藜麦皮皂苷提取率影响的交互作用曲面图
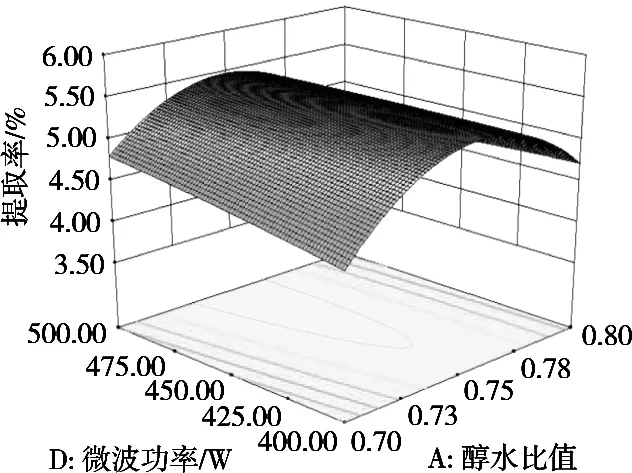
图12 微波功率与醇水比值对藜麦皮皂苷提取率影响的交互作用曲面图
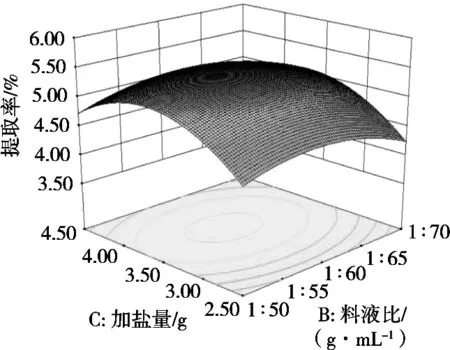
图13 加盐量与料液比对藜麦皮皂苷提取率影响的交互作用曲面图
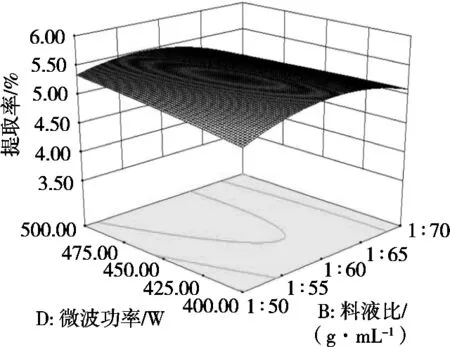
图14 微波功率与料液比对藜麦皮皂苷提取率影响的交互作用曲面图
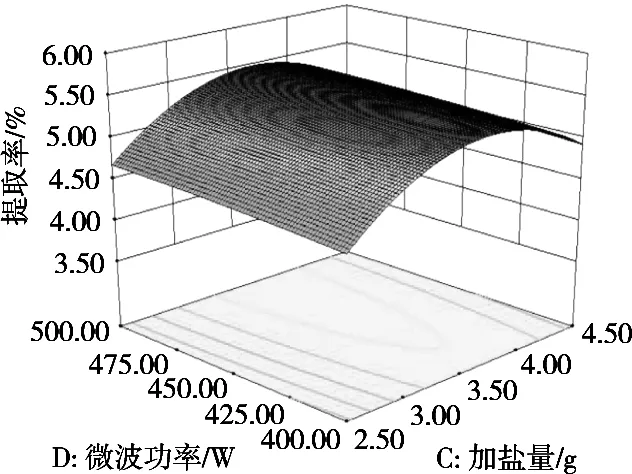
图15 微波功率与加盐量对藜麦皮皂苷提取率影响的交互作用曲面图
2.3 验证试验
由Design Expert 8.0.6软件求解回归方程,得到微波-超声协同辅助双水相提取藜麦皮皂苷最佳工艺条件为:醇水比值0.75,料液比1∶58.30 g/mL,加盐(磷酸氢二钾)量3.63 g,微波功率496.23 W。此时藜麦皮皂苷理论预测提取率为5.51%。考虑实际操作的方便性,将最佳工艺条件调整为:醇水比值0.75,料液比1︰58 g/mL,加盐(磷酸氢二钾)量3.63 g,微波功率500 W,进行3次平行试验,测得藜麦皮皂苷平均提取率为5.53%,与理论预测值接近,无显著性差异(p>0.05),表明该工艺稳定、可靠。
3 结论
试验以皂苷提取率为指标,通过单因素试验结合响应面分析的方法优化微波-超声辅助双水相提取藜麦皮皂苷的工艺条件。结果表明,影响藜麦皂苷提取率的因素大小顺序为:加盐量>微波功率>料液比>醇水比值。且加盐(磷酸氢二钾)量对藜麦皂苷提取影响极显著(p<0.01),料液比和微波功率对藜麦皂苷提取影响显著(p<0.05)。响应面法优化的最佳工艺条件为:醇水比值0.75,料液比1︰58.30(g/mL),加盐(磷酸氢二钾)量3.63 g,微波功率496.23 W。此工艺下,藜麦皮皂苷理论预测提取率为5.51%。考虑试验操作的方便性,最终确定的最佳工艺条件为:醇水比值0.75,料液比1︰58(g/mL),加盐(磷酸氢二钾)量3.63 g,微波功率500 W。此工艺条件下,藜麦皮皂苷3次平均提取率为5.53%。与理论预测值接近,无显著性差异(p>0.05)。表明工艺稳定、可靠。试验为藜麦皮皂苷的提取应用提供科学依据。
