糖尿病性白内障患者术后发生角膜水肿的预测模型
2020-11-02兰长骏
田 靖,兰长骏,廖 萱,林 佳
0 引言
糖尿病会对代谢、角膜形态造成影响,是引起眼部疾病的主要原因之一,且糖尿病病程越长,白内障发生风险越高[1]。与传统小切口手术相比,白内障超声乳化手术凭借创口小、手术时间短、恢复快的优势广泛用于白内障的临床治疗,但术后易出现角膜水肿等并发症,使术后恢复及视力改善受到较大影响[2]。与年龄相关性白内障相比,糖尿病性白内障患者的病情进展更快,术后并发症发生风险更高,考虑与长期高血糖状态对患者视网膜、眼底等造成一定影响有关。近年有关糖尿病性白内障超声乳化术后角膜水肿的影响因素受到临床关注,明确角膜水肿的影响因素是减少术后角膜水肿的重要举措。已有研究发现,角膜水肿的影响因素较多,且对角膜水肿发生风险的影响程度也不同[3],建立囊括角膜水肿各种影响因素的科学预测模型以预测术后角膜水肿发生风险对于确保糖尿病性白内障的手术效果具有重要意义。本研究纳入312例糖尿病性白内障患者为研究对象,探讨糖尿病性白内障患者术后发生角膜水肿的危险因素并构建预测模型,现报道如下。
1 对象和方法
1.1 对象选取本院2017-01/2019-12收治的糖尿病性白内障患者312例312眼,其中男164例,女148例;年龄37~83(平均67.21±6.87)岁;晶状体核硬度Emery分级:Ⅰ级47眼(15.1%),Ⅱ级51眼(16.3%),Ⅲ级94眼(30.1%),Ⅳ级116眼(37.2%),Ⅴ级4眼(1.3%)。纳入标准:(1)糖尿病病程超过5a,均采取择期超声乳化白内障摘除联合人工晶状体(IOL)植入手术;(2)单眼发病;(3)无角膜炎、角膜接触镜配戴史、眼外伤及眼手术史;(4)临床资料完整;(5)对治疗方案知情同意并签署知情同意书。排除标准:(1)先天性、外伤性白内障患者;(2)伴精神障碍者;(3)伴恶性肿瘤者;(4)术中出现虹膜损伤、后囊破裂等并发症者;(5)伴全身免疫性疾病者;(6)长期服用免疫抑制剂者。本研究经本院伦理委员会审批通过。
1.2 方法所有患者均行超声乳化白内障摘除联合IOL植入术,手术均由同一位经验丰富的医师完成。根据术后1wk内裂隙灯显微镜检查是否出现角膜水肿,将患者分为角膜水肿组与非角膜水肿组。比较两组患者性别、年龄、吸烟史、饮酒史、糖尿病病程、高血压病史、青光眼病史、角膜营养不良、慢性葡萄膜炎、晶状体核硬度Emery分级、前房深度(前房深度≤2.5mm为浅前房、前房深度>2.5mm为正常)、术中超声能量和有效超声时间、IOL材料和IOL植入位置、术后1d的角膜内皮细胞数量和六边形细胞比例。角膜内皮细胞检查方法:采用非接触式角膜内皮检测仪对中央区和手术切口区角膜内皮进行照相,中央区检查时嘱受检者注视镜头内灯源进行照相,切口区检查时于仪器左下角做红色标识,叮嘱受检者注视该红色标识,使镜头对准手术切口区即11∶00位区域。每眼连续拍照3次,以最清晰的照片为准使用微机系统进行分析。
角膜水肿评定及分级标准:(1)评定标准:术后出现角膜上皮水肿、角膜内皮局限性混浊及上皮水肿或角膜基质弥漫水肿。(2)分级标准:1)0级:角膜透明,无水肿;2)1级:角膜内皮面光滑,虹膜纹理清晰,局部薄雾状水肿;3)2级:角膜内皮面粗糙,虹膜纹理较模糊,浅灰色水肿;4)3级:角膜内皮面龟裂,虹膜纹理模糊,弥散性灰白水肿;5)4级:眼内结构不清,角膜乳白色水肿。
统计学分析:采用SPSS 19.0软件进行数据分析。计数资料n(%)表示,组间整体比较采用χ2检验,P<0.05为差异有统计学意义,进一步两两比较采用分割卡方,校正检验水准为α’=0.017。应用逐步Logistic回归分析确定糖尿病性白内障患者术后角膜水肿的危险因素,入选标准为P<0.05。根据危险因素的回归系数得到危险权重构建危险评分体系,绘制ROC曲线分析危险评分模型对糖尿病性白内障患者术后角膜水肿的预测价值。
2 结果
2.1 术后角膜水肿发生情况本研究纳入糖尿病性白内障患者312例312眼,术后角膜水肿发生率为19.9%(62/312)。角膜水肿分级:1级38眼(61.3%)、2级13眼(21.0%)、3级8眼(12.9%)、4级3眼(4.8%)。
2.2 术后发生角膜水肿的影响因素分析本研究纳入患者中角膜水肿组患者62例62眼,非角膜水肿组患者250例250眼,两组患者性别、吸烟史、饮酒史、角膜营养不良、术后六边形细胞比例的差异均无统计学意义(P>0.05)。角膜水肿组年龄>60岁、糖尿病病程>10a、有高血压病史、有青光眼病史、伴慢性葡萄膜炎、晶状体核硬度Emery分级Ⅳ~Ⅴ级、术前浅前房、术中超声能量≥15%、术中有效超声时间≥8s、IOL材料为PMMA、IOL植入位置为囊袋内、术后角膜内皮细胞数量丢失≥10%的患者占比明显高于非角膜水肿组,见表1。
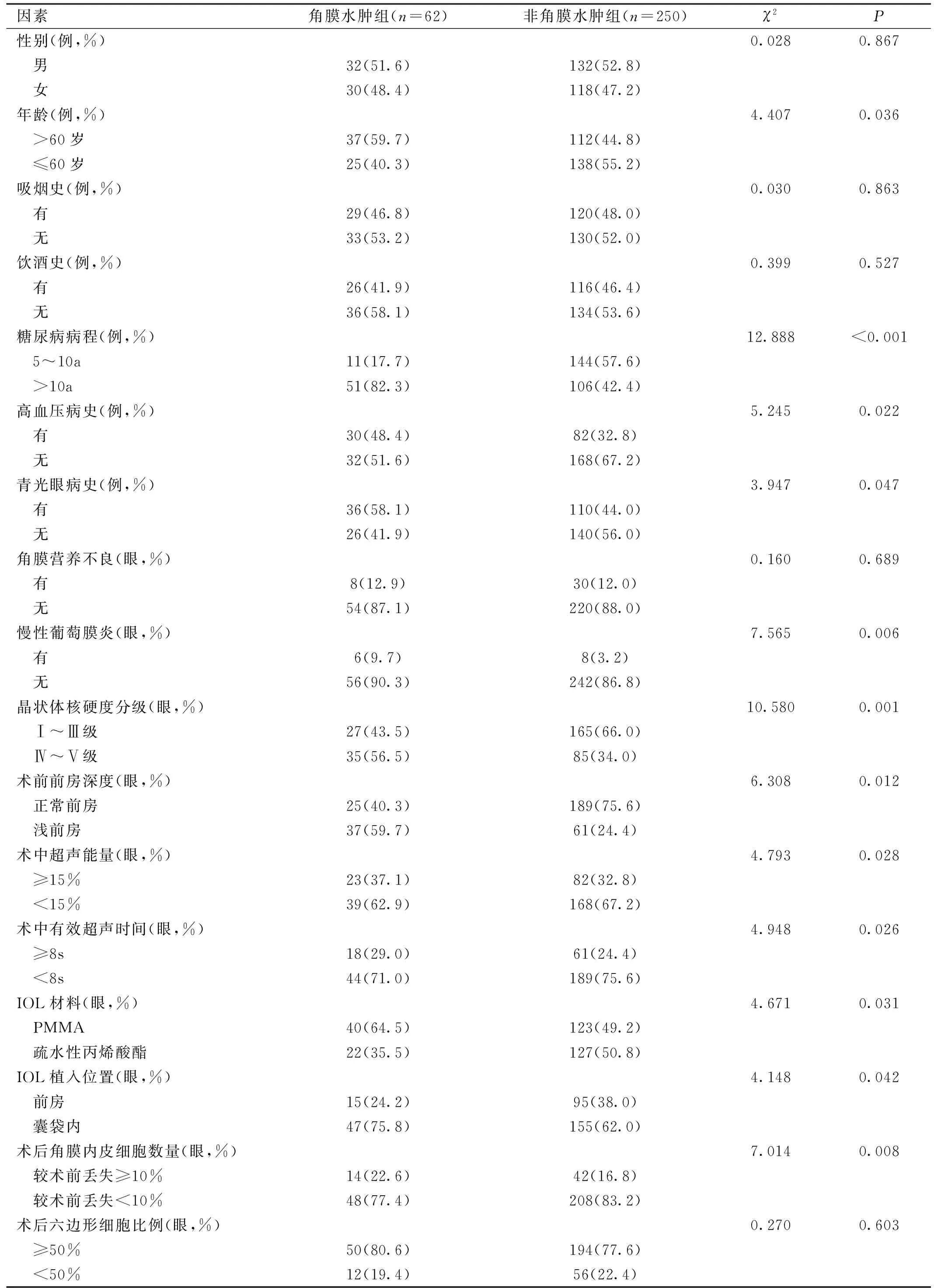
表1 术后发生角膜水肿的影响因素
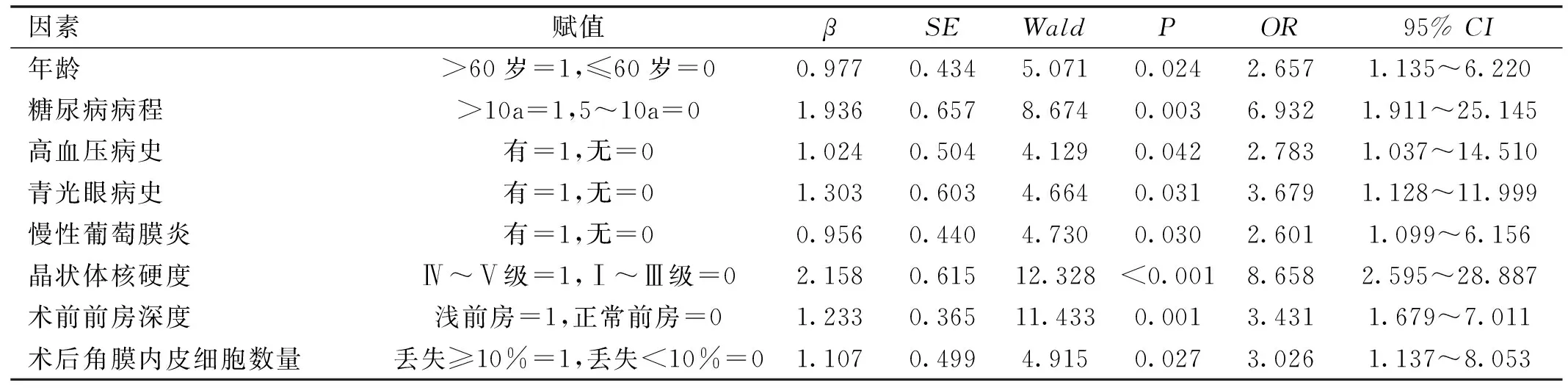
表2 糖尿病性白内障患者术后角膜水肿的逐步Logistic回归分析
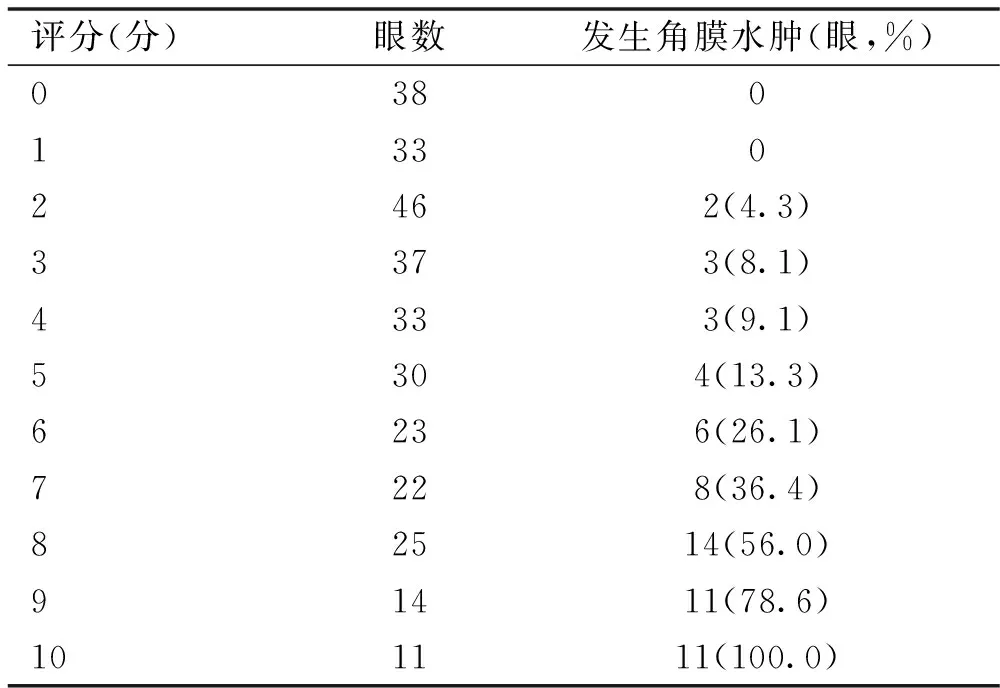
表3 不同评分患者的分布情况及角膜水肿发生率
2.3 术后发生角膜水肿的危险因素分析将单因素分析中有统计学意义的因素作为自变量,以术后角膜水肿作为因变量(是=1,否=0)进行逐步Logistic回归分析,结果显示年龄>60岁(OR=2.657,95%CI:1.135~6.220)、糖尿病病程>10a(OR=6.932,95%CI:1.911~25.145)、高血压病史(OR=2.783,95%CI:1.037~14.510)、青光眼病史(OR=3.679,95%CI:1.128~11.999)、慢性葡萄膜炎(OR=2.601,95%CI:1.099~6.156)、晶状体核硬度Ⅳ~Ⅴ级(OR=8.658,95%CI:2.595~28.887)、术前浅前房(OR=3.431,95%CI:1.679~7.011)、术后角膜内皮细胞数量(OR=3.026,95%CI:1.137~8.053)是糖尿病性白内障患者术后发生角膜水肿的危险因素(P<0.05),见表2。
2.4 构建危险评估模型将逐步Logistic回归分析所选出的危险因素中最小的标准化β值所对应的变量赋分为1,其它变量的标准化β值除以最小值后四舍五入取整数[4],得到相应的整数分值后构建危险评分体系,其中年龄>60岁、高血压病史、青光眼病史、慢性葡萄膜炎、术前浅前房、术后角膜内皮细胞丢失≥10%:1分;糖尿病病程>10a、晶状体核硬度Ⅳ~Ⅴ级:2分。该评分系统总分0~10分。分析所有患者的临床资料,并根据危险评分体系进行评分,分析不同评分的患者分布情况及术后角膜水肿发生率。结果显示,评分越高,角膜水肿发生率也越高,其中0分和1分的患者中,无患者发生角膜水肿;10分患者的角膜水肿发生率为100%,见表3。
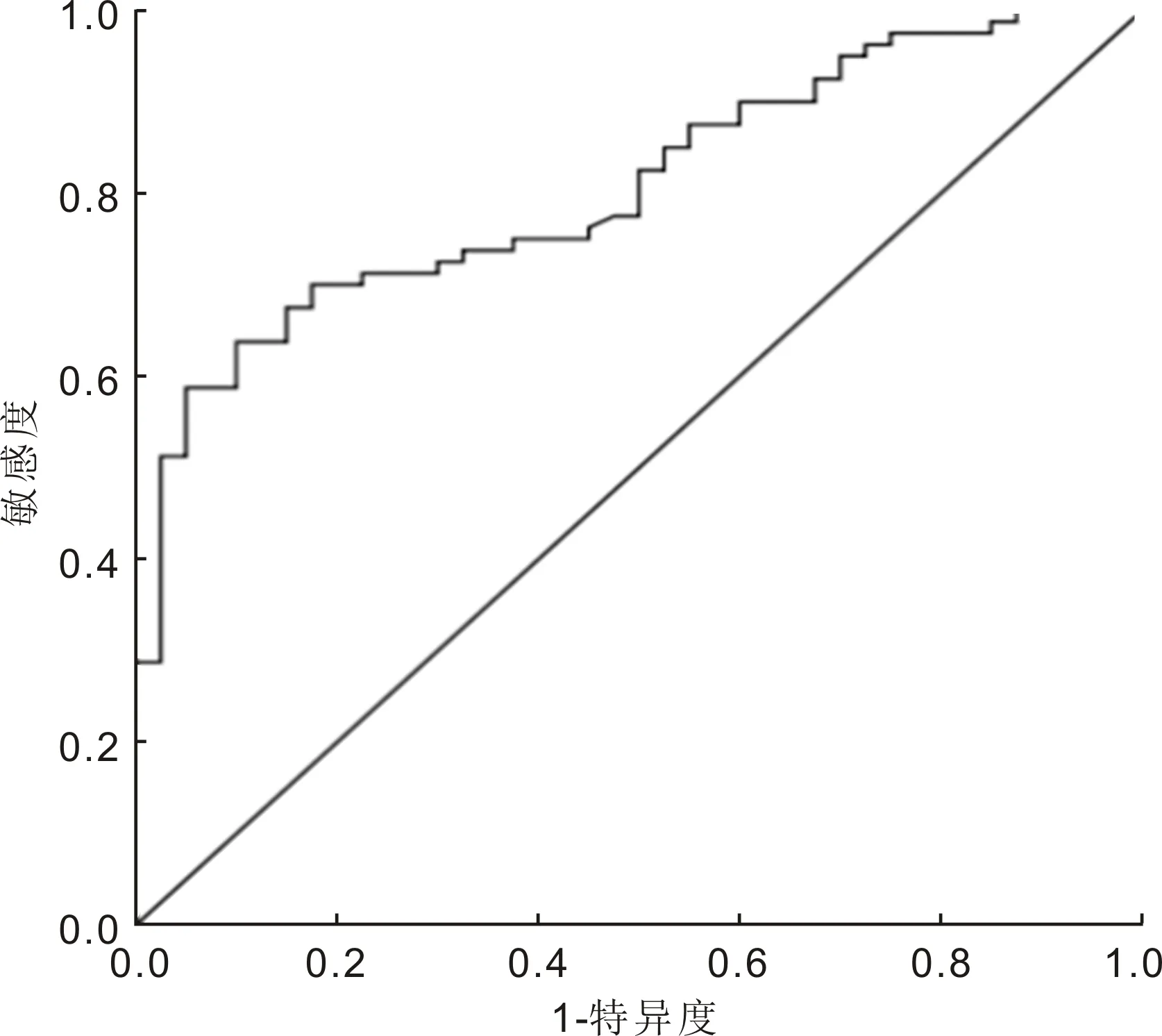
图1 危险评估模型预测糖尿病性白内障患者术后角膜水肿的ROC曲线。
2.5 危险等级分层根据表3结果,并结合临床实际经验,对低危、中危、高危人群的分值区间进行定义:总分0~4分为低危组,总分5~7分为中危组,总分8~10分为高危组。低危组、中危组、高危组患者角膜水肿发生率分别为4.3%(8/187)、24.0%(18/75)、72.0%(36/50),差异有统计学意义(χ2=114.69,P<0.001),其中中危组患者角膜水肿发生率高于低危组(χ2=23.293,P<0.017),高危组高于中危组(χ2=28.169,P<0.017)和低危组(χ2=119.676,P<0.017),见表4。
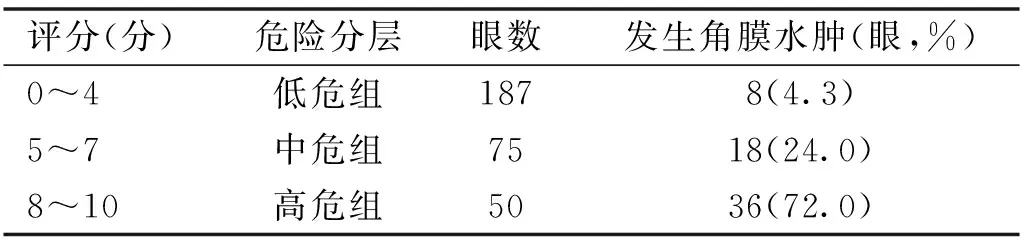
表4 不同危险等级分层的角膜水肿发生率
2.6 危险评估模型的预测价值验证绘制危险评估模型预测糖尿病性白内障患者术后发生角膜水肿的ROC曲线,以危险评分总分作为自变量,以术后角膜水肿作为因变量(是=1,否=0)。结果显示ROC曲线下面积0.848(95%CI:0.772~0.934),以8.94分为最佳临界值,此时的敏感度和特异度分别为85.3%和80.2%,Hosmer-Lemeshow拟合优度检验r=4.4,P=0.479,见图1。
3 讨论
角膜是屈光系统的重要组成部分,术后角膜水肿的发生可能损害患者视力,影响手术效果。虽然短期内部分轻微角膜水肿可自愈,但多数角膜水肿患者仍出现视力损害,如何减少糖尿病性白内障患者术后发生角膜水肿引起临床关注。
本研究入选的糖尿病性白内障患者均采取超声乳化白内障摘除联合IOL植入手术,术后角膜水肿发生率为19.9%(62/312),与既往报道的15%~25%相符。通过单因素比较及逐步Logistic回归分析发现,年龄>60岁、糖尿病病程>10a、高血压病史、青光眼病史、慢性葡萄膜炎、晶状体核硬度Ⅳ~Ⅴ级、术前浅前房、术后角膜内皮细胞数量是糖尿病性白内障患者术后角膜水肿的危险因素(P<0.05)。白内障属于不可逆疾病,进展情况与年龄有关。角膜内皮细胞会随着年龄的增长而逐渐丢失,年龄越大,角膜内皮细胞密度越低,尤其六角形细胞占比降低,且角膜内皮细胞形态也会发生变化,增加了术后角膜水肿的发生风险[5]。长期处于高血糖状态,会使房水代谢受到一定程度的影响。高血压可通过对患者眼压的影响增加超声乳化白内障摘除联合IOL植入术患者术后并发症的风险,眼压>21mmHg时术后并发症风险相对增大[6]。但眼压的影响因素较多,如合并青光眼、伴前房无菌性炎症、高血压等均可能影响血眼屏障而增加眼压,因此对合并高血压的患者积极降压非常重要。国外研究发现,糖尿病性白内障患者的角膜内皮细胞数量与非糖尿病性白内障患者相比减少约18%,且角膜内皮细胞减少这一现象在病程超过10a的患者中尤为明显[7]。高丰等[8]研究也显示,病程>10a的患者中央角膜厚度(581.72±3.17μm)显著高于病程<5a的患者(569.41±4.01μm)和5~10a的患者(557.21±3.51μm),病程>10a的患者角膜内皮细胞计数为2092.58±52.36个/mm2,显著低于病程<5a的患者(2401.42±26.74个/mm2)和5~10a的患者(3015.37±34.92个/mm2),这一结果说明随着病程的延长,糖尿病角膜病变患者的中央角膜厚度明显增大,而角膜内皮细胞计数明显减少。闫爱民等[9]研究也发现,白内障超声乳化术对糖尿病患者角膜内皮细胞的影响与病程有较大关联,病程>10a的白内障患者术后1、3mo的中央角膜内皮细胞密度、中央角膜内皮六边形细胞均显著少于病程≤10a的患者。因此,糖尿病病程越长,角膜内皮细胞结构和数量受到的影响越大,术后发生角膜水肿的风险越高。高血压是全身性疾病,可对全身器官造成不良影响。高血压患者的角膜内皮细胞结构组成与非高血压患者相比存在显著差异,在显微镜下可发现高血压患者角膜内皮细胞中六边形细胞比例显著减少、变异系数增加,角膜内皮细胞的稳定性下降,更易在术中丢失,使术后发生角膜水肿的风险增大[10-11]。但本研究中六边形细胞比例并未入选角膜水肿的影响因素,考虑与本研究角膜水肿患者以1级为主,2级、3级和4级患者均较少,角膜损伤对角膜细胞形态的影响较轻,因此六边形细胞比例并未受到明显影响有关,与谢田华等[12]研究结论一致。
青光眼易引起虹膜缺血,使血眼屏障功能受到影响,此外抗青光眼药物、手术损伤等综合作用也会造成角膜内皮细胞丧失约8%~25%,从而增加术后角膜水肿的发生风险[13]。慢性葡萄膜炎患者本身存在角膜内皮细胞密度下降和角膜内皮细胞损伤,因此术后角膜水肿发生风险会升高。本研究中角膜水肿组有22.6%(14/62)的患者术后角膜内皮细胞丢失≥10%,高于非角膜水肿组的16.8%(42/250),术后角膜内皮细胞丢失情况与曹端荣等[14]报道接近,提示角膜内皮细胞过度丢失会增加术后角膜水肿的发生风险。角膜内皮细胞数量受到多种因素影响,如年龄增大、角膜内皮受损等均会造成角膜内皮细胞丢失,引起角膜失代偿,从而造成角膜内皮屏障功能和内皮细胞钠泵功能障碍,使Na+-K+-ATP酶代谢活性降低,最终造成角膜水肿。
术中超声能量和有效超声时间对术后角膜水肿也有一定影响,但这种影响取决于晶状体核硬度,晶状体核硬度越高(Ⅳ~Ⅴ级),所需超声能量和有效超声时间往往也会升高,超声乳化能量的释放所产生的能量和热量对角膜内皮细胞造成的损伤也会越严重,因此晶状体核硬度越高,术后角膜水肿发生风险也会随之升高[15-16]。同时手术过程中仪器探头的震动也会造成机械性损伤并产生羟基自由基,损伤角膜内皮细胞。李谟汉等[17]对292例患者进行研究后同样得出结论,晶状体核硬度较大会影响术后角膜水肿。前房深度是角膜后至晶状体前的距离,术前浅前房意味着超声乳化手术的操作空间较小,不利于手术操作,从而增加术中能量和机械损伤,增加术后角膜水肿的风险[18]。赵庆一等[19]根据不同的前房深度将患者分为正常组和浅前房组,在同样条件下进行白内障手术,术后发现浅前房组患者角膜内皮细胞丢失情况相对更为严重[20],与本研究结论一致。
本研究明确糖尿病性白内障患者术后角膜水肿的危险因素后,为建立预测模型,根据危险因素的回归系数设定不同危险因素的评分,并结合所有患者的实际情况划分不同评分的患者分布,发现随着危险评分总分的升高,术后角膜水肿发生率也更高。当评分≥9分时,术后角膜水肿发生率≥78.6%。结合临床经验划分危险分层,总分0~4分为低危组,总分5~7分为中危组,总分8~10分为高危组。为验证这一模型对术后角膜水肿的预测价值,绘制ROC曲线,发现危险评分总分预测术后角膜水肿的ROC曲线下面积达0.848(95%CI:0.772~0.934),敏感度和特异度分别为85.3%和80.2%。该模型的优势在于直接根据各种危险因素的权重进行不同评分的赋值,根据患者实际情况即可确定所处的危险分层,从而明确术后角膜水肿发生风险,是一种简单、易操作的预测模型,有利于尽早评估术后角膜水肿发生风险,从而为重点人群的监控和防治提供参考。但需强调的是,该预测模型是针对糖尿病性白内障采取超声乳化白内障摘除联合IOL植入手术患者的危险因素所构建的模型,因此也只适用于该类患者,其他类型白内障(如年龄相关性白内障)患者术后角膜水肿的预测模型的建立有待后续探讨。
综上所述,根据糖尿病性白内障患者术后角膜水肿的危险因素构建的危险评分模型对术后角膜水肿有较大预测价值,且简单方便,适合临床应用。
1严宏, 宾玥. 糖尿病患者白内障手术的综合治疗策略. 中华实验眼科杂志 2019; 37(10): 769-772
