沉默GFAP基因调控高糖诱导的视网膜微血管内皮细胞增殖与凋亡
2020-11-02焦亮亮朱文魁罗翠平雷建平
焦亮亮,朱文魁,罗翠平,雷建平
0 引言
糖尿病是一种日益普遍的慢性疾病,主要由缺乏胰岛素、高血糖、血脂异常和神经血管损伤引起,可损害各个器官系统,影响患者生活质量,并带来严重的经济负担[1-2]。糖尿病视网膜病变是1型和2型糖尿病的常见并发症,在临床上相对于传统药物,新生物标志物会更有利于提高糖尿病视网膜病变的预后。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是星形胶质细胞的重要中间丝蛋白,其可用来标记中枢神经胶质细胞各个阶段的变化[3-4],且在糖尿病视网膜病变中具有调控作用,但是具体的作用机制仍有待研究。转化生长因子-beta(TGF-β)信号通路在人类的很多疾病中均表现出活性异常升高[5-6],其中包括糖尿病视网膜神经病变[7],TGF-β1和转录因子Smad2、Smad3、Smad4是TGF-β信号级联传递的关键蛋白[8-9]。但是GFAP在糖尿病视网膜病变中的功能机制与TGF-β信号通路之间的关系尚且未知。本研究拟以高糖诱导的人视网膜微血管内皮细胞(hRMECs)为研究对象,检测慢病毒介导的GFAP基因沉默对高糖诱导hRMECs细胞增殖和凋亡的影响,分析GFAP、TGF-β信号通路关键基因的表达,以揭示GFAP在糖尿病视网膜病变中的功能,为GFAP用于糖尿病视网膜病变的生物治疗提供理论依据。
1 材料和方法
1.1 材料细胞:人视网膜微血管内皮细胞(hRMECs)购自美国Angio-Proteomie公司。主要试剂:D-甘露醇购自Merck公司;DMEM培养基购自Gibco公司;胎牛血清购自杭州四季青公司;TGF-β信号通路特异性激活剂SRI-011381(纯度:98%)、CCK-8试剂盒购自美国Glpbio公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙啶(PI)试剂盒购自碧云天公司;鼠抗人GFAP(sc-33673)、TGF-β1(sc-130348)、Smad2(sc-101153)、Smad3(sc-101154)单克隆蛋白抗体以及山羊抗鼠IgG二抗(sc-516102)购于美国Santa Cruz公司。主要仪器设备:荧光定量PCR仪(7500型)购于美国ABI公司;流式细胞仪(型号CytoFLEX)购于美国Beckman公司。
1.2 方法
1.2.1 细胞培养将hRMECs用含有10%胎牛血清的DMEM培养基培养于37℃、5%CO2的恒温细胞培养箱中,每2~3d传代一次,取生长状态良好的对数生长期细胞用于实验研究。
1.2.2 细胞处理与分组(1)将正常培养的hRMECs用5、30mmol/mL葡萄糖、30mmol/mL D-甘露醇处理24h,分别标记为NG+hRMECs组、HG+hRMECs组、高渗对照组。(2)将高糖诱导(30mmol/mL葡萄糖作用24h)的hRMECs随机分为sh RNA组、sh GFAP组,分别将sh RNA(5’-GCAGCAACTGGAGGATCTAGA-3’)、sh GFAP(5’-AGGAATTAAGAGAAGCAACAT-3’)目的片段进行pGCL-GFP载体质粒重组构建和病毒包装,用LipofectamineTM2000试剂盒将其转染至高糖诱导的hRMECs中,转染48h后,用qRT-PCR法和Western blot检测基因沉默效率,基因沉默成功后用于后续实验研究,流式细胞术检测细胞凋亡率。(3)将稳定沉默GFAP的高糖诱导的hRMECs随机分为sh GFAP+DMSO组、sh GFAP+SRI-011381组,分别用DMSO、SRI-011381处理24h,采用Western blot检测TGF-β信号通路相关蛋白的表达,流式细胞术检测细胞凋亡率。
1.2.3 qRT-PCR法检测细胞中GFAP mRNA的表达收集细胞,按照RNA抽提试剂盒、逆转录试剂盒说明书要求操作提取RNA,并快速将其反转录为cDNA。根据qRT-PCR试剂盒说明书操作进行GFAP mRNA检测。以GAPDH为内参,用2-△△Ct法计算GFAP mRNA的相对表达量。引物信息:GFAP上游引物5’-CTGAATTCTGCTGGCTTCAAGG-3’,下游引物5’-CTAAGCTTGCTGTGCGTTGCGG-3’;GAPDH上游引物5’-GTCAGCCGCATCTTCTTTTG-3’,下游引物5’-GCGCCCAATACGACCAAATC-3’。
1.2.4 Western blot检测细胞中相关蛋白的表达收集细胞,用RIPA裂解液在冰上裂解30min,12000r/min离心10min,取上清转移至EP管中,沸水煮沸10min进行变性。将上清液用5×SDS上样缓冲液稀释,电泳后用转膜仪将蛋白转移至PVDF膜,5%脱脂奶粉封闭2h,洗膜,加入一抗(鼠抗人GFAP、TGF-β1、Smad2、Smad3单克隆蛋白抗体,工作浓度1∶400~1∶1000),4℃孵育过夜,洗膜,加二抗(山羊抗鼠辣根过氧化物酶标记的IgG抗体,1∶1000),4℃ 2h。加发光液,曝光。
1.2.5 CCK-8法检测细胞增殖能力收集分组处理后的细胞并调整至细胞密度为105个/mL的悬液,接种至96孔板,每孔100μL,37℃、5%CO2的条件下培养24、48、72h。取出后每孔加入20μL CCK-8溶液,于酶标仪490nm波长下测吸光度值(A450)。细胞的增殖能力与吸光度值呈正比,可用于评估细胞的增殖能力。
1.2.6 Annexin V-FITC/PI双染法检测细胞凋亡收集细胞,用结合缓冲液调整细胞密度至106个/mL,每孔加入100μL细胞液,再加入Annexin V-/FITC(5μL)、PI(10μL)避光反应15min,结束后,上流式细胞仪分析凋亡情况。
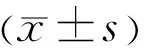
2 结果
2.1 GFAP在高糖诱导的hRMECs中的表达采用Western blot和qRT-PCR检测高糖诱导的hRMECs中GFAP蛋白和mRNA的相对表达水平,结果显示,与NG+hRMECs组相比,HG+hRMECs组细胞中GFAP蛋白和mRNA表达水平均显著升高(P<0.05,图1,表1),表明GFAP在高糖诱导的人视网膜血管内皮细胞中表达明显升高。
2.2 沉默GFAP的高糖诱导的细胞模型建立采用Western blot和qRT-PCR检测经慢病毒介导沉默GFAP的高糖诱导的hRMECs中GFAP蛋白和mRNA的相对表达水平,结果显示,与sh RNA组相比,sh GFAP组细胞中GFAP蛋白和mRNA表达水平均显著降低(P<0.001,图2,表2),表明成功建立慢病毒介导沉默GFAP的高糖诱导的人视网膜血管内皮细胞模型。
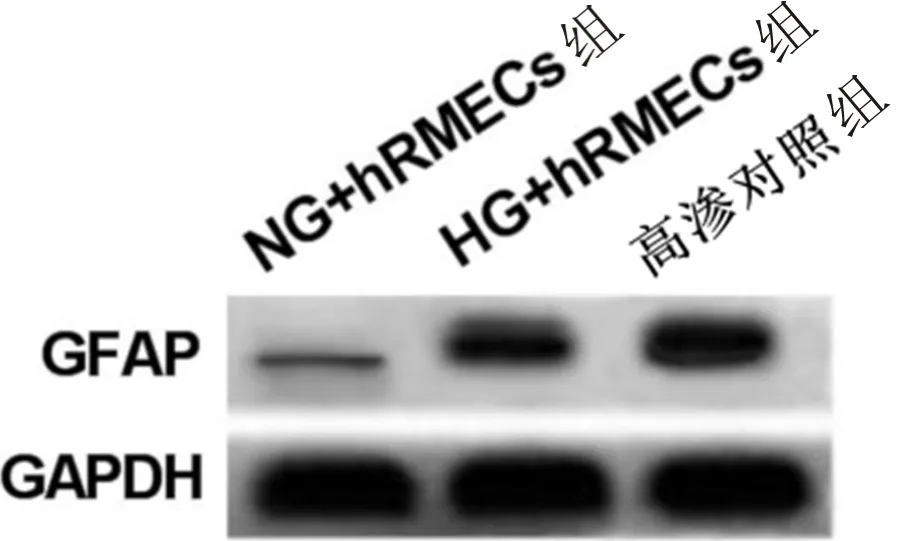
图1 高糖诱导的hRMECs中GFAP蛋白的表达。
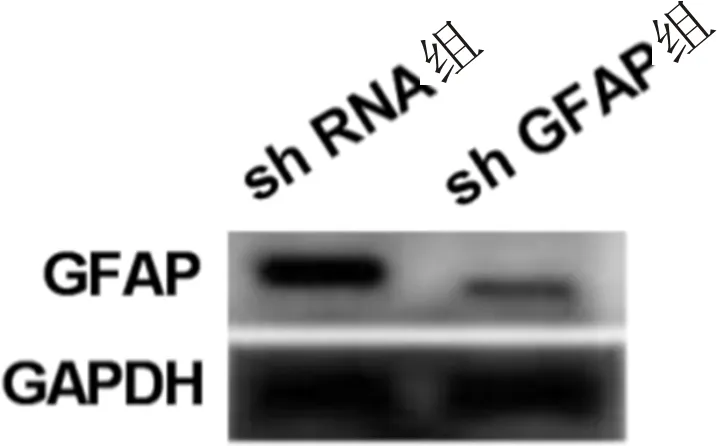
图2 沉默GFAP的高糖诱导的细胞中GFAP蛋白的表达。
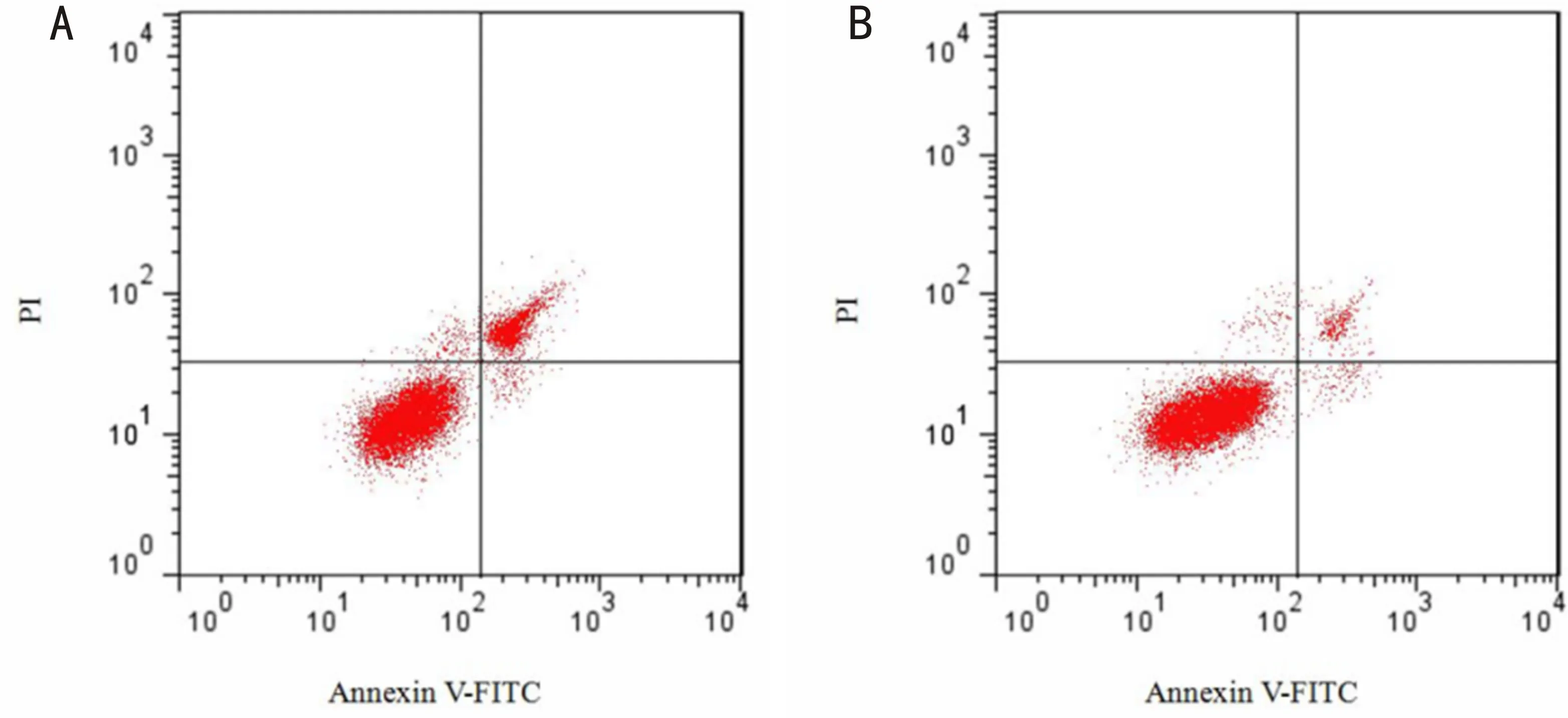
图3 沉默GFAP对高糖诱导的hRMECs凋亡的影响 A:sh RNA组;B:sh GFAP组。
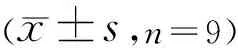
表1 GFAP在高糖诱导的hRMECs中的表达
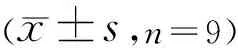
表2 GFAP在沉默GFAP的高糖诱导的hRMECs中的表达
2.3 沉默GFAP对高糖诱导的hRMECs增殖和凋亡的影响采用CCK-8法检测沉默GFAP对高糖诱导的hRMECs增殖的影响,结果显示,与sh RNA组相比,48、72h时,sh GFAP组细胞的增殖能力均显著升高(P<0.001,表3)。采用流式细胞术检测沉默GFAP对高糖诱导的hRMECs凋亡的影响,结果显示,与sh RNA组相比,sh GFAP组细胞凋亡率显著降低(P<0.001,图3,表3)。上述结果表明,沉默GFAP可促进高糖诱导的人视网膜血管内皮细胞增殖,抑制其凋亡。
2.4 沉默GFAP对高糖诱导的hRMECs中TGF-β信号通路的影响采用Western blot检测经慢病毒介导沉默GFAP的高糖诱导的hRMECs中TGF-β信号通路相关蛋白的相对表达水平,结果显示,与sh RNA组相比,sh GFAP组细胞中TGF-β1、Smad2、Smad3蛋白表达水平均显著降低(P<0.001,图4,表4),表明沉默GFAP可抑制高糖诱导的人视网膜血管内皮细胞中TGF-β信号通路的活性。
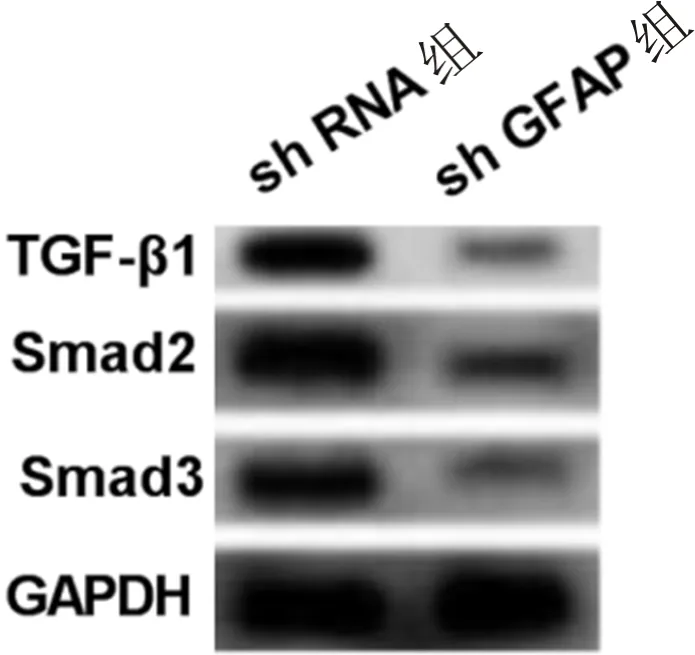
图4 TGF-β信号通路相关蛋白的表达。
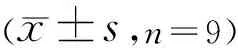
表3 沉默GFAP对高糖诱导的hRMECs增殖和凋亡的影响
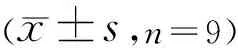
表4 TGF-β信号通路相关蛋白表达的影响
2.5 激活TGF-β信号通路逆转沉默GFAP对高糖诱导的细胞增殖和凋亡的调控作用Western blot检测结果显示,与sh GFAP+DMSO组相比,sh GFAP+SRI-011381组细胞中TGF-β1、Smad2、Smad3 的蛋白表达量均显著升高
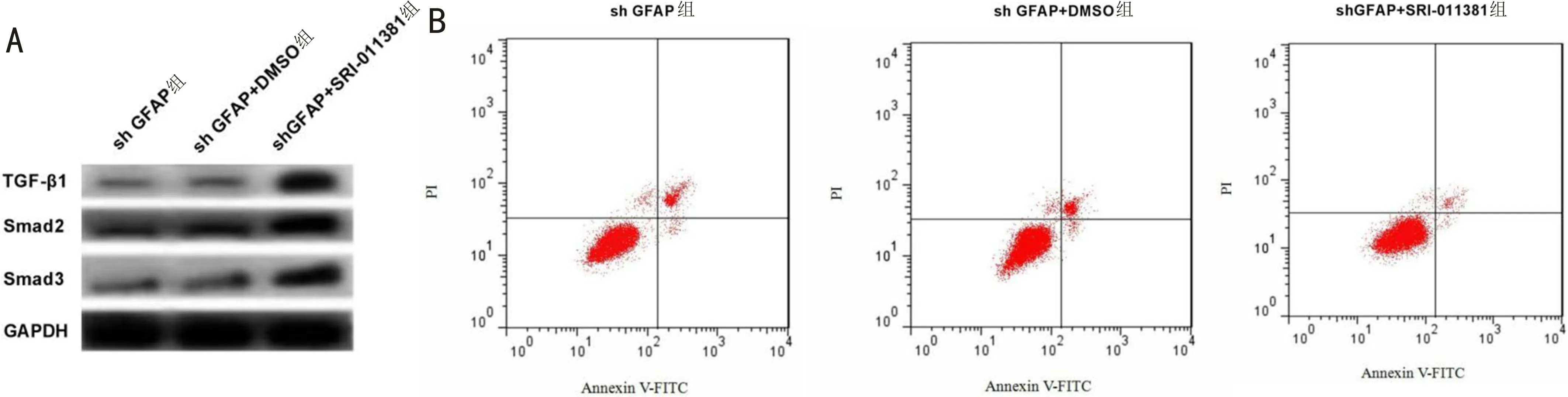
图5 激活TGF-β信号通路逆转沉默GFAP对高糖诱导的hRMECs的调控作用 A:Western blot检测TGF-β信号通路相关蛋白的表达;B:流式细胞术检测细胞凋亡率。
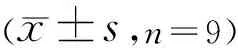
表5 激活TGF-β信号通路逆转沉默GFAP对高糖诱导的hRMECs的调控作用
(P<0.05,图5A,表5)。CCK-8检测结果显示,与sh GFAP+DMSO组相比,48、72h时,sh GFAP+SRI-011381组细胞增殖能力均显著降低(P<0.05,表5)。流式细胞术检测结果显示,与sh GFAP+DMSO组相比,sh GFAP+SRI-011381组细胞凋亡率显著升高(P<0.05,图5B,表5)。上述结果表明,激活TGF-β信号通路可逆转沉默GFAP对高糖诱导的视网膜血管内皮细胞的增殖促进及凋亡抑制作用。
3 讨论
糖尿病视网膜病变被认为是全世界失明的主要原因之一,寻找新的治疗策略以防止其进展成为该领域科学研究的重点。GFAP在糖尿病视网膜病变的早期、后期均出现表达异常,其在疾病的进展中占有重要地位[10-11]。早在2007年,Zhang等[12]已报道,在高糖诱导的大鼠视网膜病变中GFAP的表达明显升高,且牛磺酸可通过降低高糖诱导的GFAP上调而发挥减缓大鼠早期糖尿病视网膜病变的作用。近期,Bahr等[13]在糖尿病视网膜病变的研究中也报道,GFAP的表达水平异常升高,且度洛西汀可通过下调GFAP在糖尿病视网膜病变中发挥治疗作用。但是GFAP在糖尿病视网膜病变中的功能及机制仍有待探索。本研究在体外建立了高糖诱导的hRMECs细胞模型,通过qRT-PCR和Western blot检测了其中GFAP的表达,结果显示,GFAP的表达水平明显升高。进一步研究中,通过慢病毒介导GFAP基因稳定沉默的高糖诱导的hRMECs细胞模型,为深入研究GFAP在糖尿病视网膜病变中的功能奠定基础,也为本课题组后续的实验研究进行铺垫。本研究通过CCK-8法、流式细胞术检测细胞的增殖和凋亡发现,沉默GFAP的高糖诱导的hRMECs细胞增殖明显上调,细胞凋亡明显下调,该结果揭示了GFAP沉默在高糖诱导的hRMECs细胞中的增殖促进和凋亡抑制作用,提示GFAP抑制剂在糖尿病视网膜病变中的治疗价值,为GFAP生物制剂的开发提供参考。不足的是,本研究结果并未在动物体内进行验证。此外,本研究发现,沉默GFAP后,TGF-β信号通路关键基因TGF-β1、Smad2、Smad3的蛋白表达水平均明显降低,揭示了沉默GFAP可抑制高糖诱导的hRMECs中TGF-β信号通路的活性,推测TGF-β信号通路可能与GFAP在糖尿病视网膜病变中的功能相关。
TGF-β信号通路的异常在人类的多数疾病中均可表现,包括心血管疾病、免疫疾病和胚胎发育异常、肿瘤等[14]。Lou等[15]在糖尿病视网膜病变的研究中发现,在糖尿病视网膜病变大鼠模型中TGF-β信号通路关键基因TGF-β1、p-Smad3的表达均显著升高,即TGF-β信号通路活性异常升高。Li等[16]研究也报道,上调TGF-β1信号通路的活性可作为长链非编码RNA心肌梗死相关转录物(LncRNA-MIAT)抑制人视网膜色素上皮细胞增殖的作用机制。虽然,GFAP在神经损伤、脑缺血-再灌注损伤和胶质瘤中均通过调控TGF-β信号通路发挥作用[17-18],但是在糖尿病视网膜病变中该通路是否会发挥同样的功能有待验证。本研究检测了激活TGF-β信号通路后慢病毒介导沉默GFAP基因的高糖诱导的hRMECs的增殖和凋亡情况发现,激活TGF-β信号通路逆转了沉默GFAP对高糖诱导的hRMECs的增殖促进、凋亡抑制作用,提示在高糖诱导的hRMECs中不仅GFAP可正向调控TGF-β信号通路的活性,相反,TGF-β信号通路的活性也可以逆向反作用于GFAP在高糖诱导的hRMECs中的表达和功能。上述研究结果为GFAP在糖尿病视网膜病变中的生物价值开发提供了理论参考。
综上所述,沉默GFAP可促进高糖诱导的人视网膜微血管内皮细胞的增殖并抑制凋亡,发挥保护作用,其作用机制与调控TGF-β信号通路的活性相关,为糖尿病视网膜病变的治疗提供了新的理论参考。
