骨髓间充质干细胞玻璃体腔移植对大鼠青光眼模型视神经的保护作用
2020-11-02田洪益谢碧华罗清礼
田洪益,谢碧华,罗清礼
0 引言
青光眼(glaucoma)是老年人群中常见的眼科疾病,具有不可逆性[1]。青光眼的特征是视网膜神经节细胞(retinal ganglion cells,RGCs)的进行性退化和不能分裂或再生,被视为神经干细胞生成性疾病,与其他疾病如阿尔茨海默氏症或帕金森病一样,最终由神经功能缺陷引起[2]。青光眼的临床治疗主要有药物和手术治疗,但其治疗效果不是很理想,不能有效阻止视网膜神经节细胞凋亡[3]。间充质干细胞(mesenchymal stem cells,MSCs)是一种能够自我更新的多能干细胞,具有多向分化潜能和免疫调节作用,包括脐带间充质干细胞、骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)等[4]。其中,骨髓间充质干细胞是具有自我更新的非造血干细胞,具有多系分化潜能,能够分化为多种细胞谱系,如:脂肪细胞、成骨细胞、表皮细胞等[5-6]。因此,本实验研究骨髓间充质干细胞玻璃体腔移植是否对大鼠青光眼模型有改善作用,是否对视网膜神经节细胞有保护作用。
1 材料和方法
1.1 材料35只体质量180~220g Lewis大鼠购自中国科学院上海斯莱克实验动物有限公司。IMDM培养基和胎牛血清购自美国Gibco公司。Percoll分离液、PBS溶液、茜素红S、油红O和葡聚糖四甲基罗丹明购自美国Sigma公司。pGFP-N试剂购自美国Clontech公司。CD29抗体、CD45抗体、CD44抗体、CD90抗体、CD106抗体和CD14抗体购自美国Abcam公司。HE试剂盒购自北京中杉金桥公司。RIPA裂解液购自北京索莱宝公司。IGF1抗体、BDNF抗体、β-actin抗体和山羊抗兔(鼠)IgG二抗购自美国Cell Signaling Technology公司。PVDF膜购自美国Millipore公司。
1.2 方法
1.2.1 细胞培养取5只雄性Lewis大鼠,采用麻醉处死,立即用75%乙醇浸泡,移入超净工作台内,固定大鼠四肢于工作台面的泡沫板上。酒精棉球擦拭,无菌条件下用灭菌消毒后的镊子和剪刀分离出大鼠股骨,剔除骨头表面肌肉,PBS溶液冲洗两遍。将股骨两端剪断,用2mL无菌注射器吸取IMDM培养基冲出股骨中的骨髓于离心管中,反复冲洗几次。将冲出的骨髓吹打成悬液,1000r/min离心5min,弃上清。IMDM培养基重悬细胞,将悬液加入到装有等体积Percoll分离液的离心管中,用吸管吹打成细胞悬液,2000r/min,离心20min。吸取中间骨髓基质细胞层(白色混浊状),IMDM培养基洗3次。用含15%胎牛血清、100U/mL青霉素、100U/mL链霉素的IMDM培养基重悬。以1×106/mL接种于细胞培养瓶中,置于37℃、5%CO2的培养箱中培养。48h后弃去培养基,PBS溶液冲洗2~3次去除未贴壁细胞,加入完全培养基继续培养。以后每3d换液1次,以保证细胞所需的营养成分,并于倒置显微镜下观察细胞生长的形态变化。
1.2.2 骨髓间充质干细胞的体外分化对于成骨分化,将骨髓间充质干细胞在含有100nmol/mL地塞米松,0.05mmol/mL抗坏血酸-2-磷酸和10mmol/mL β-甘油磷酸酯的完全培养基中培养4wk,进行成骨分化。通过用2%茜素红S(pH 4.1~4.3)染色评估。对于成脂分化,通过在含有0.5mmol/mL异丁基-甲基黄嘌呤,100nmol/L地塞米松,10mg/mL胰岛素和200μmol/mL吲哚美辛的完全培养基中培养骨髓间充质干细胞,进行脂肪形成分化2wk。通过用0.5%油红O染色细胞内脂滴来显示脂肪形成分化。
1.2.3 流式细胞术在第3代后,收获骨髓间充质干细胞。每1mL细胞悬液中加入20μL 抗体(CD29抗体、CD45抗体、CD44抗体、CD90抗体、CD106抗体、CD14抗体),室温、避光孵育30min后,1000r/min离心5min,弃去上清液。PBS清洗细胞后加入培养基重悬细胞,使用FACS Calibur仪器进行流式细胞术分析。用Cell Quest软件分析数据。
1.2.4 动物分组及给药将30只Lewis大鼠饲养在有锯屑垫料的标准塑料笼中,室内温度为21℃±2℃,动物可以不受限制地获得食物和水,保持12h光照/12h黑暗循环,并且在实验之前使大鼠适应环境至少2wk。将大鼠分别随机分为3组:(1)对照组:建模后第7d向玻璃体腔内注射3μL PBS溶液;(2)青光眼模型组:建模后第7d向玻璃体腔内注射3μL PBS溶液;(3)骨髓间充质干细胞组:在建模后第7d向玻璃体腔内注射3μL骨髓间充质干细胞悬浮液(含有1×105个细胞),连续给药30d。
1.2.5 模型制作按照文献[7]进行青光眼模型制作。Lewis大鼠经戊巴比妥钠全身麻醉,将每只大鼠的左眼为实验眼(青光眼),右眼为对照眼。实验前测量每只眼的眼内压,在裂隙灯下,从532nm二极管激光器向左眼施加0.75W脉冲(直径50μm,0.5s),经过50个激光脉。在第7、14、21、30d测双眼眼内压,实验眼内压比对照眼内压大于10mmHg(1mmHg=0.133kPa)为青光眼模型制作成功。对照组只麻醉大鼠,不进行手术。动物实验设计计划严格经过成都市第一人民医院伦理委员会审查。
1.2.6 HE染色将视网膜组织快速在10%福尔马林溶液中固定24h。固定后,视网膜组织样品包埋于石蜡中并进行切片(切片的厚度5μm)。将5μm厚的组织固定在带正电荷的载玻片上,然后进行脱水-再水化,切片进行苏木精-曙红染色。所有切片均用光学显微镜进行拍摄。
1.2.7 视网膜神经节细胞计数葡聚糖四甲基罗丹明(DTMR)盐溶液(终浓度1mg/mL)从大鼠玻璃体腔注入,给予DTMR 48h后,将进行免疫荧光分析的动物处死,并摘除眼球。将眼球在甲醛中固定2h,然后将视网膜移出并平放,使用PBS/甘油(1∶1)将RGC层置于最上方,并标记上视网膜的方向。将平置的视网膜放置在显微镜载玻片上,并使用适当的滤光片套件立即用免疫荧光显微镜进行检查,通过图像分析软件Image Pro Plus对图像进行计数。
1.2.8 TUNEL染色视网膜组织经固定、OCT包埋,并制作成6μm厚的冰冻切片。切片滴加蛋白酶K工作液(20μg/mL),37℃温育10~30min,PBS清洗3次。接着切片在4%的多聚甲醛溶液中室温固定5min,PBS清洗3次。然后切片上滴加DNse I反应液,37℃温育30min,PBS清洗3次。用吸水纸小心吸去样本区域周围的多余液体,滴加TdT酶反应液于样本区域上,于37℃湿盒中孵育60min(避光),PBS清洗3次。用吸水纸小心吸去样本周围的液体,每个样本上滴加Streptavidin-Fluorescein标记液,放入温盒中,37℃反应30min(避光),PBS清洗3次。最后DAPI染色液复染细胞核,室温避光反应10min,PBS洗涤,加适量封片剂,荧光显微镜观察并拍照。
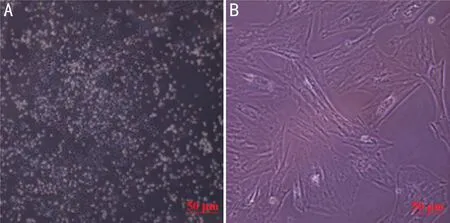
图1 骨髓间充质干细胞形态(×100) A:第0代,第5d;B:第3代,第4d。
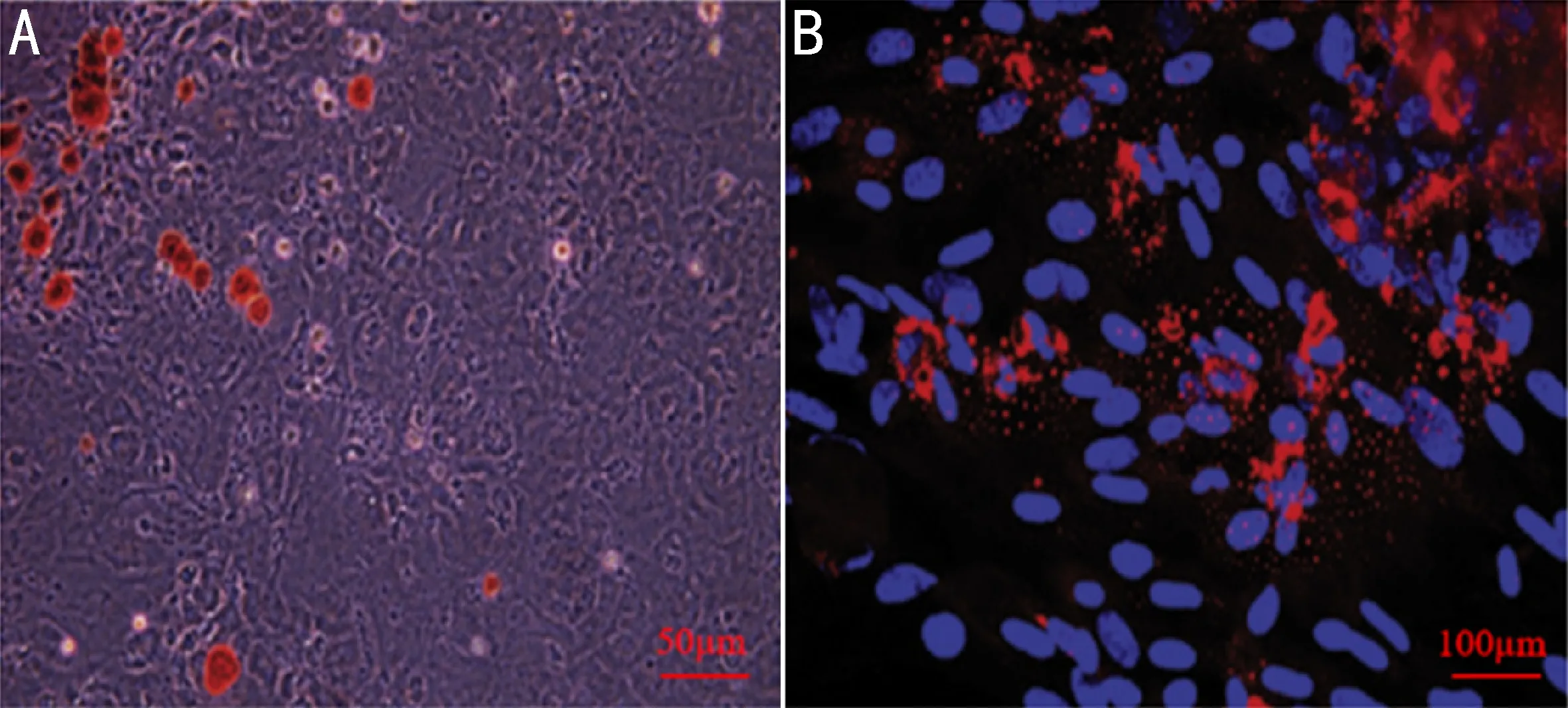
图2 骨髓间充质干细胞的体外分化 A:成骨分化(×100);B:成脂分化(×200),蓝色表示细胞核。

图3 流式细胞术检测BMMSCs的免疫表型特征。
1.2.9 Western blot视网膜组织中加入1mL制备好的RIPA裂解液提取蛋白,用BCA法测定总蛋白含量。用12% SDS-PAGE凝胶分离蛋白质并转移到PVDF膜上。用含有5%脱脂牛奶的PBS封闭膜1h,之后加入稀释后的胰岛素样生长因子1(insulin-like growth factor 1,IGF1)(1∶1000)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)(1∶1000)和β-actin(1∶1000)一抗,4℃摇床上孵育过夜。TBST洗膜3次,每次10min,加入对应于一抗种属来源的HRP标记的二抗(1∶2000),在室温摇床上孵育1h,TBST洗膜3次,每次10min。使用ECL化学发光液显色发光,凝胶成像系统拍照,Image Pro Plus图像分析系统对蛋白条带进行分析。
2 结果
2.1 骨髓间充质干细胞的形态如图1所示,原代培养第5d出现小集落,细胞形状为类圆形;传至第3代时,细胞呈现出大的,扁平的或成纤维细胞样的形态。
2.2 骨髓间充质干细胞的体外分化如图2所示,成骨诱导后,用茜素红S染色将矿物结节染色为阳性;成脂诱导后,用油红O染色发现中性脂质空泡;提示所提取的原代细胞为骨髓间充质干细胞。
2.3 流式细胞术实验如图3所示,流式细胞术分析数据表明BMMSCs表达CD29,CD44,CD90和CD106,但不表达CD45和CD14,并且它们在随后的传代中保持其表型。
2.4 大鼠青光眼模型鉴定由表1可以看出,20只大鼠对照眼、实验眼的眼内压在各时间点比较差异均有统计学意义(F时间=20.45,P时间<0.01;F组间=24.78,P组间<0.01;F组间×时间=18.34,P组间×时间<0.01)。在术后第7、14、21、30d时大鼠实验眼的眼内压均明显高于对照眼,差异均有统计学意义(P<0.05),表明青光眼大鼠模型均建造成功。
2.5 视网膜组织形态表现如图4所示,对照组、青光眼模型组、骨髓间充质干细胞组大鼠视网膜厚度分别为345.67±23.12、203.45±13.56、287.89±18.23μm,差异有统计学意义(F=18.21,P<0.01)。对照组大鼠视网膜神经纤维排列整齐,视网膜神经节细胞数量多,视网膜厚度正常;与对照组比较,青光眼模型组大鼠视网膜神经纤维排列不整齐,视网膜神经节细胞数量明显减少,视网膜厚度变薄(P<0.01);骨髓间充质干细胞组大鼠视网膜神经纤维细胞排列较整齐,视网膜神经节细胞数量和视网膜厚度高于青光眼模型组(P<0.05)。

图4 HE染色观察各组大鼠视网膜厚度变化(×200) 单箭头:视网膜神经节细胞;双箭头:视网膜厚度。A:对照组;B:青光眼模型组;C:骨髓间充质干细胞组;D:三组大鼠视网膜厚度比较。bP<0.01 vs 对照组;cP<0.05 vs 青光眼模型组。
表1 对照眼和实验眼术后第7、14、21、30d的眼内压
2.6 视网膜神经节细胞计数如图5所示,对照组、青光眼模型组、骨髓间充质干细胞组大鼠视网膜神经节细胞数量分别为1267.34±67.32、632.56±34.78、1057.21±58.32个/mm2,差异有统计学意义(F=21.74,P<0.01)。青光眼模型组大鼠视网膜神经节细胞数量明显低于对照组(P<0.01),BMMSCs组大鼠的视网膜神经节细胞数量高于青光眼模型组(P<0.05)。
2.7 视网膜神经节细胞凋亡如图6所示,对照组、青光眼模型组、骨髓间充质干细胞组大鼠视网膜神经节细胞凋亡数量分别为0.68±0.10、5.75±1.13、3.34±0.78个,差异有统计学意义(F=67.58,P<0.001)。青光眼组大鼠视网膜神经节细胞凋亡数量显著高于对照组(P<0.001),骨髓间充质干细胞组大鼠的视网膜神经节细胞凋亡数量明显低于青光眼模型组(P<0.05)。
2.8 Western blot如图7所示,对照组、青光眼模型组、骨髓间充质干细胞组大鼠视网膜中IGF1和BDNF蛋白表达差异有统计学意义(F=25.62、28.60,均P<0.01)。青光眼模型组大鼠视网膜中IGF1(0.21±0.07)和BDNF(0.18±0.04)蛋白表达量明显低于对照组(0.57±0.11,0.49±0.12)(均P<0.01),骨髓间充质干细胞组大鼠视网膜中IGF1(0.38±0.06)和BDNF(0.29±0.05)蛋白表达量高于青光眼模型组(均P<0.05)。
3 讨论
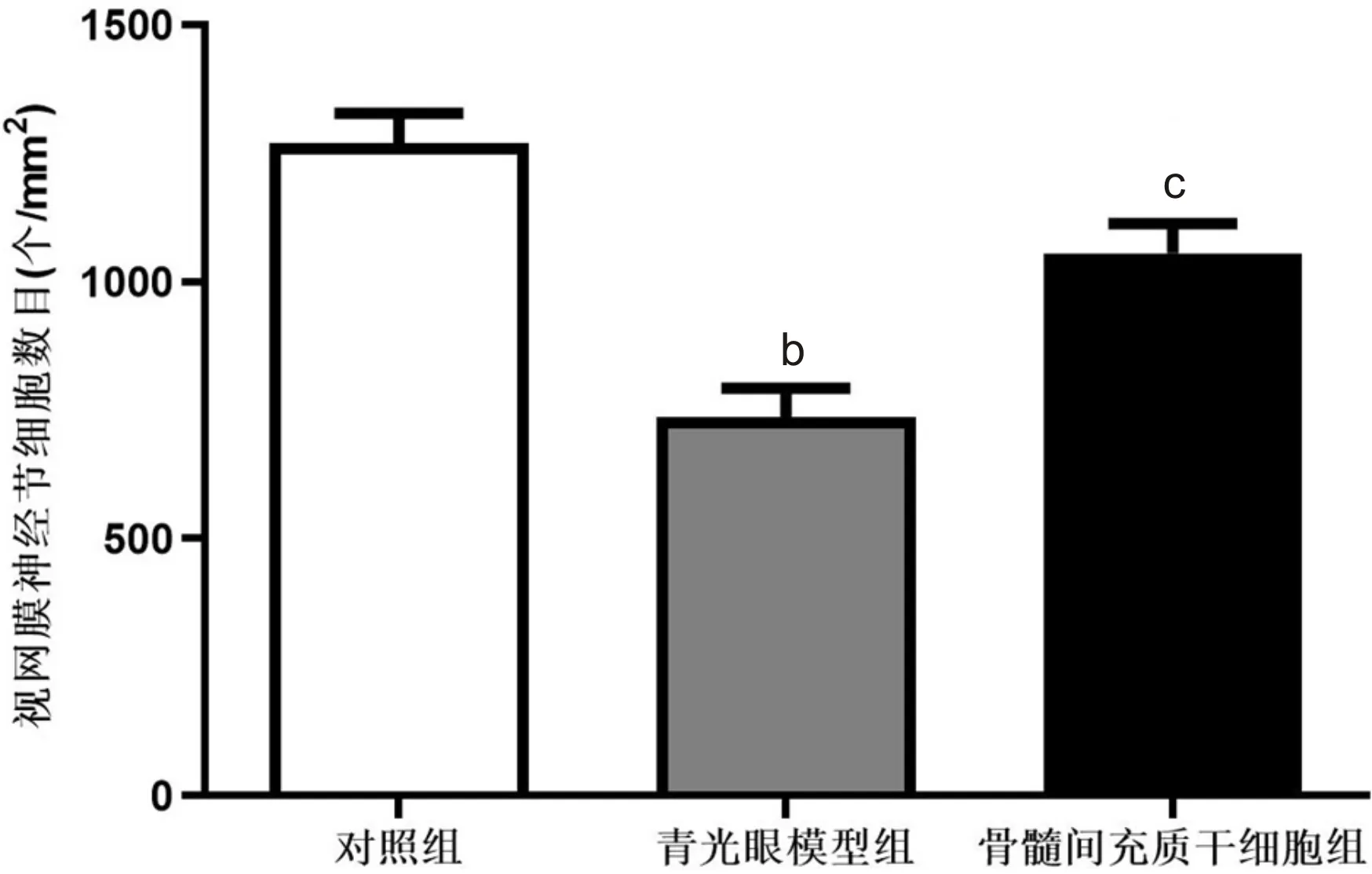
图5 免疫荧光显微镜下视网膜神经节细胞数量变化 bP<0.01 vs对照组;cP<0.05 vs青光眼模型组。
青光眼是一种视神经病变,其特征在于视网膜神经节细胞的进行性退化。青光眼影响全球7000多万人,其中约10%是双眼失明,使其成为不可逆转性失明的主要原因[8]。青光眼可分为两大类:开角型青光眼和闭角型青光眼。在美国,超过80%的病例是开角型青光眼;然而,闭角型青光眼是造成严重视力丧失的重要原因。开角型和闭角型青光眼均可作为原发性疾病。继发性青光眼可由创伤,某些药物如皮质类固醇,炎症,肿瘤或诸如色素分散或假去角质的病症引起[9]。因此,早期诊断和治疗可以预防视力丧失。青光眼的神经保护治疗宗旨在预防视网膜神经节细胞的死亡。在某种程度上,降低眼压可以在一定程度上保护神经,从而防止神经元的破坏和减少神经节的不可逆损失[10]。然而,目前没有保护视网膜神经节细胞的预防性治疗。

图6 TUNEL染色观察各组大鼠视网膜神经节细胞凋亡变化 bP<0.001 vs 对照组;cP<0.05 vs 青光眼模型组。
干细胞已经用于医学领域的神经保护治疗。研究发现,视网膜干细胞移植对青光眼视网膜神经节细胞有保护作用[11],MSCs在神经保护疗法中具有吸引力[12]。间充质干细胞分泌BDNF,神经生长因子,神经胶质细胞源性神经营养因子(GDNF),睫状神经营养因子(CNTF),IGF1等各种细胞因子和神经营养因子[13]。这些由MSCs分泌的因子已被证明可对缺血[14]、脑缺血再灌注[15]等疾病具有
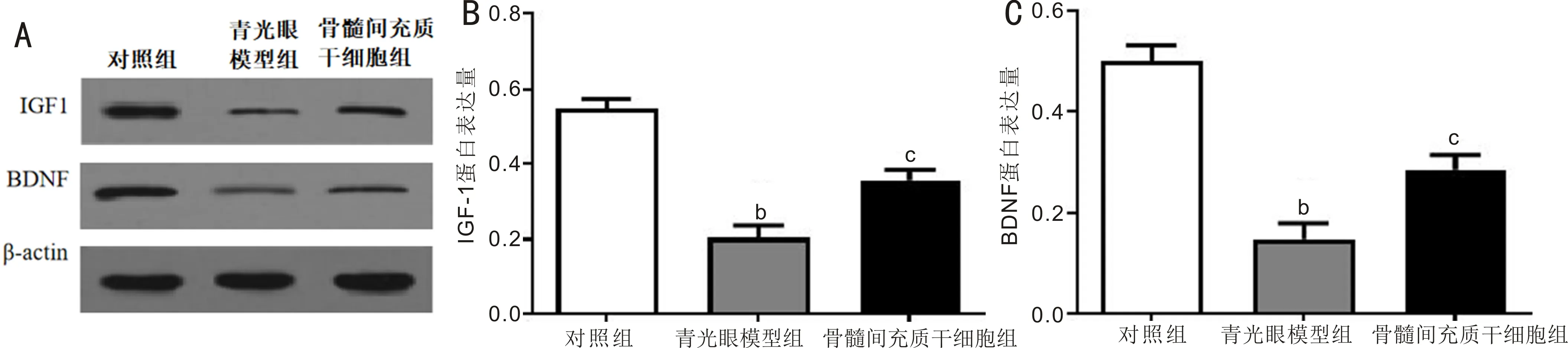
图7 Western blot检测各组大鼠视网膜中IGF1和BDNF蛋白变化 A:三组大鼠视网膜中IGF1和BDNF蛋白表达;B:三组大鼠视网膜中IGF1蛋白表达;C:三组大鼠视网膜中BDNF蛋白表达。bP<0.01 vs 对照组;cP<0.05 vs 青光眼模型组。
神经保护作用。研究表明,涉及青光眼治疗中MSCs,BMMSCs在动物模型中有效维持视网膜神经节细胞活力[7],并且BMMSCs治疗青光眼被广泛研究。在本研究中,我们将大鼠BMMSCs用于大鼠青光眼模型中来研究其对视网膜神经的神经保护和整合能力,是否对青光眼有保护作用。
本实验探究骨髓间充质干细胞是否对青光眼大鼠模型有保护作用,我们先提取了大鼠原代骨髓间充质干细胞并进行了鉴定,得到纯度高的骨髓间充质干细胞。接着,我们制作了大鼠青光眼模型,并检测了大鼠眼内压,结果表明青光眼大鼠模型均建造成功。为了进一步探究骨髓间充质干细胞经玻璃体腔移植后的作用,进行了如下实验:HE染色结果表明,对照组大鼠视网膜神经纤维排列整齐,视网膜神经节细胞数量多,视网膜厚度正常,青光眼组大鼠视网膜神经纤维排列不整齐,视网膜神经节细胞数量明显减少,视网膜厚度变薄,骨髓间充质干细胞组大鼠视网膜神经纤维细胞排列较整齐,视网膜神经节细胞数量和视网膜厚度明显高于青光眼组;视网膜神经节计数结果表明,青光眼模型组大鼠视网膜神经节细胞数量明显低于对照组,骨髓间充质干细胞组大鼠的视网膜神经节细胞数量明显高于青光眼组,但低于对照组;TUNEL染色结果表明,青光眼模型组大鼠视网膜神经节细胞凋亡数量显著高于对照组,骨髓间充质干细胞组大鼠的视网膜神经节细胞凋亡数量明显低于青光眼模型组;Western blot结果表明,青光眼模型组大鼠视网膜中IGF1和BDNF蛋白表达量明显低于对照组,骨髓间充质干细胞组大鼠的视网膜中IGF1和BDNF蛋白表达量高于青光眼模型组。因此,骨髓间充质干细胞玻璃体腔移植能治疗大鼠青光眼,可以保护视网膜神经节细胞。
综上所述,骨髓间充质干细胞的玻璃体腔移植可以在体内抑制视网膜神经节细胞凋亡,对视网膜神经节细胞具有保护作用,其中间充质干细胞分泌多种细胞因子和生长因子,在青光眼病理过程中对神经节细胞的保护起关键作用。
