核壳硅碳复合微球固定相的制备及其在糖类分离中的应用
2020-11-02赵兴云张红燕周孝禹万丽红吴仁安
赵兴云, 张红燕, 周孝禹, 王 莉, 万丽红, 吴仁安*
(1. 中国科学院大连化学物理研究所高分辨质谱技术研究组, 辽宁 大连 116023; 2. 中国科学院大学, 北京 100049)
糖类化合物的色谱分析对于深入研究其结构表征和生物活性具有重要意义[1,2]。糖类化合物是含有多羟基的强极性化合物,在反相色谱上基本不保留,在正相色谱非极性流动相中溶解度低[3,4],且多糖类结构多样,异构体成分多[5],进行分离纯化以及纯度鉴别较困难[2,6],因而必须寻求高效富集和分离检测的新材料和新方法[7-9]。
纳米材料在分析化学领域的应用扩大了纳米材料的应用范围[10],也促进了蛋白质组学[11,12]、糖组学[11,13]等各研究领域的不断发展,其中比表面积大、介孔结构清晰狭窄的介孔碳材料[14]为组学的研究提供了有力工具。有序介孔碳复合材料[15]、磁性核壳介孔碳[16]、有序硅碳复合纳米纤维[17]等新型复合材料也被不断发展,并基于其对多肽的疏水、静电相互作用和对相对分子质量较大蛋白质的尺寸排阻效应,被用于作为固定化酶反应器或者用于选择性富集复杂样品中的内源性肽[18]以及磷酸化肽[12,19]。同时基于纳米孔碳材料和多糖之间具有较强的相互作用及纳米孔碳材料对蛋白质的尺寸排阻作用,已有多篇报道[20,21]将纳米孔碳材料应用于糖蛋白酶解中的糖链富集中。然而这些材料形貌不规格,粒径小,有的存在微孔,限制了其在色谱柱方面的应用。
本文将苯酚和甲醛通过物理吸附作用,在二氧化硅表面和孔内聚合形成淡黄色酚醛树脂(PF),最后在氮气气氛中煅烧得到黑色核壳硅碳复合微球(Sil@MC)材料。该方法简单高效,经过氦离子扫描显微镜和氮气物理吸附脱附表征,证明碳材料均匀地固定在二氧化硅表面上,涂覆后仍具有良好的单分散性,且比表面积和孔径也并未减少。将Sil@MC材料填充于高效液相色谱固定相中,发现硅碳材料与糖类具有较强的相互作用,Sil@MC色谱柱对糖类及糖类同分异构体具有良好的分离性能,峰形良好。该方法拓展了色谱固定相的合成思路,获得了一种有潜力的色谱固定相。
1 实验部分
1.1 仪器、试剂与材料
Orion Nanofab扫描氦离子显微镜(Carl Zeiss,德国); Quantachrome SI氮气物理吸附/脱附仪(QuantaChrome,美国); 1290液相色谱(安捷伦,美国); 15-T Solari X混合傅里叶变换离子回旋共振-质谱仪(FT-ICR-MS, Bruker Daltonics,德国)。
二氧化硅(粒径5 μm,孔径9.5 nm)由中国科学院大连化学物理研究所王树东课题组提供。D-(+)-氨基葡萄糖盐酸盐(D-(+)-glucosamine hydrochloride)、葡萄糖(glucose)、D-(+)-海藻糖二水合物(D-(+)-trehalose dihydrate)、棉子糖(raffinose)购自上海阿拉丁试剂公司。松三糖、耐斯糖和水苏糖购自大连美仑生物科技公司。3′-唾液酸乳糖(3′-sialyllactose, 3′-SL)、6′-唾液酸乳糖(6′-sialyllactose, 6′-SL)、乳-N-新四糖(LNnT, Galβ1→4GlcNAcβ1→3Galβ1→4Glc)、乳-N-四糖(LNT, Galβ1→3GlcNAcβ1→3Galβ1→4Glc)购自上海甄准科研试剂公司。乙腈(ACN)购自美国Tedia公司。实验用水经Milli-Q水处理系统(Millipore公司,美国)处理。除特别说明,实验所用化学试剂均分析纯。
1.2 Sil@MC的制备及装柱过程
参考文献[22]合成方法,在100 mL乙醇-水(1∶2, v/v)中加入0.5 g二氧化硅微球,混合均匀后,加入0.093 g苯二酚和171 μL氨水。于60 ℃磁力搅拌2 h后,逐滴加入126 μL甲醛,反应后离心或者抽滤洗涤,样品干燥后,将所得固体于氮气气氛中处理6 h,即可获得核壳硅碳复合微球Sil@MC材料,最后采用匀浆法填充于色谱柱中。
1.3 色谱分离条件
色谱柱规格:100 mm×2.1mm,柱温:30 ℃,流速:0.3 mL/min,流动相A:水(含0.1%(v/v)甲酸),流动相B:乙腈。
检测器:FT-ICR-MS,正离子模式,采集范围m/z150~3 000;分辨率:200 000;电压:4 500 V;干燥气温度200 ℃,流速4 L/min。
2 结果和讨论
2.1 Sil@MC固定相的表征
首先,采用扫描显微镜观察二氧化硅与合成的Sil@MC材料的形貌(见图1a和1b)。根据图像,观察到Sil@MC材料更加明亮,这是因为碳材料的导电性优于二氧化硅材料。二氧化硅与合成的Sil@MC材料均匀分散,粒径均在5 μm左右。

图 1 (a)二氧化硅和(b)Sil@MC材料的扫描氦离子显微镜图Fig. 1 Scanning helium-ion micrographs of (a) silica and (b) core-shell silica@mesoporous carbon (Sil@MC) material
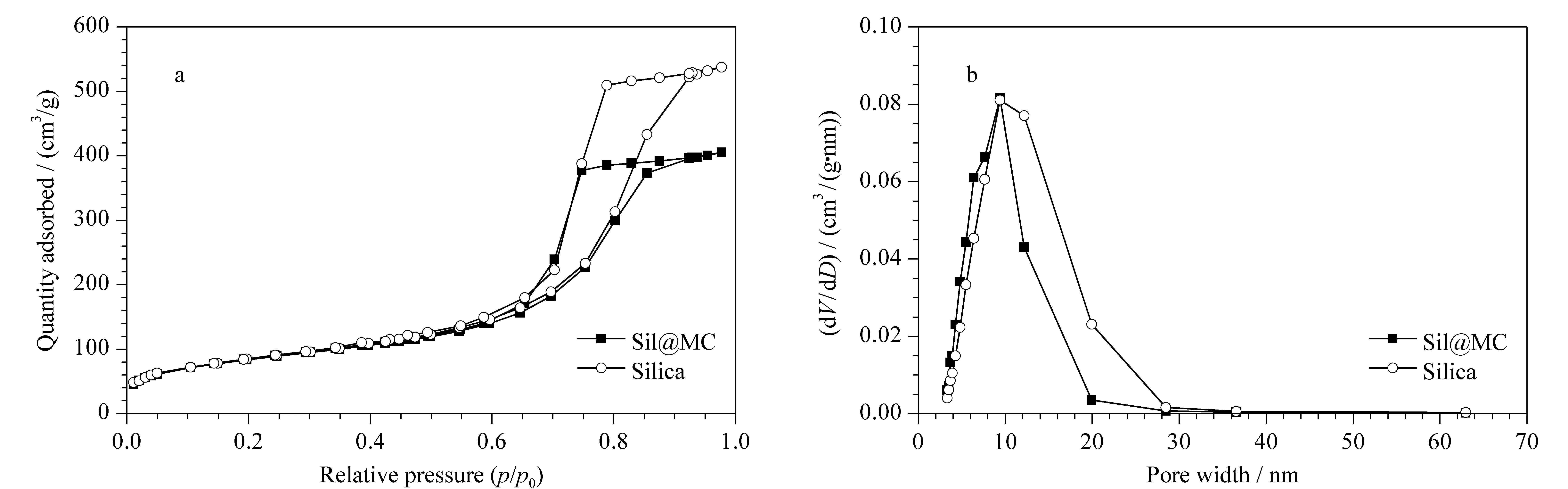
图 2 二氧化硅和Sil@MC材料的(a)N2吸附脱附等温线及(b)BJH吸附孔大小分布图Fig. 2 (a) N2 adsorption isotherm and (b) BJH adsorption pore size distribution graphs of silica and Sil@MC material
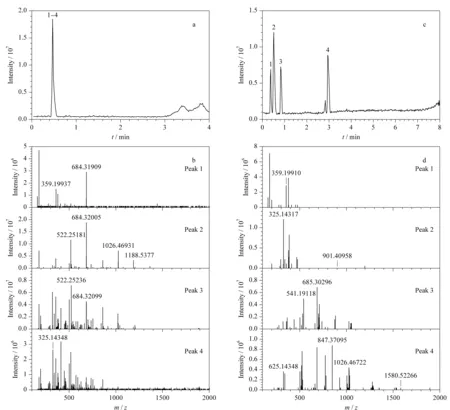
图 3 极性糖类化合物在(a,b)二氧化硅和(c,d)Sil@MC色谱柱上的分离Fig. 3 Separation of polar sugar compounds on the (a, b) SiO2 and (c, d) Sil@MC columns Mobile phase: (A) water (containing 0.1% (v/v) formic acid) and (B) acetonitrile; gradient elution program: 0-1.5 min, 3%B, 1.5-3.0 min, 3%B-40%B. Peak Nos.: 1. D-(+)-glucosamine hydrochloride; 2. glucose; 3. D-(+)-trehalose dihydrate; 4. raffinose.
图2a和图2b为二氧化硅和Sil@MC固定相的氮气吸脱附等温线和孔径分布图。经计算,二者比表面积分别为300 m2/g和302 m2/g。二者平均孔径均为9.5 nm,然而Sil@MC固定相孔径分布变窄,孔容(0.63 cm3/g)低于二氧化硅固定相的孔容(0.92 cm3/g),证明实验成功合成了薄壳层Sil@MC材料。
2.2 Sil@MC固定相在糖类化合物分离中的应用
本工作将未涂覆酚醛树脂的二氧化硅材料和Sil@MC材料填充到色谱柱中,选择D-(+)-氨基葡萄糖盐酸盐、葡萄糖(单糖)、D-(+)-海藻糖二水合物(二糖)和棉子糖(三糖)为分析对象,研究两种色谱柱对极性糖类化合物的分离性能。如图3a所示,采用未涂覆酚醛树脂的二氧化硅色谱柱、流动相中ACN含量从3%增加到40%时,4种化合物只得到一个色谱峰;如图3c所示,采用Sil@MC色谱柱时,在相同流动相梯度洗脱程序下,4种化合物在4 min内实现基线分离,出峰顺序分别为D-(+)-氨基葡萄糖盐酸盐、葡萄糖、D-(+)-海藻糖二水合物和棉子糖,保留时间分别为0.38、0.53、0.86和2.98 min,说明Sil@MC材料对糖类具有保留作用,且糖单元越多,极性糖类化合物在Sil@MC固定相上的保留作用越强。
接着,实验应用Sil@MC色谱柱测试其对低聚糖异构体化合物(松三糖和棉子糖、耐斯糖和水苏糖)的分离性能。如图4a所示,当流动相中乙腈的体积分数从3%增加到40%时,三糖化合物松三糖和棉子糖依次洗脱,其保留时间分别为3.30 min和3.42 min,其质谱图见图4b;如图4c所示,在相同流动相条件下,四糖化合物耐斯糖和水苏糖均被依次洗脱,其保留时间分别为3.13 min和3.64 min,其质谱图见图4d。
实验同样应用Sil@MC色谱柱测试其对人乳样品中两种唾液酰化母乳寡糖异构体(3′-SL和6′-SL)的分离性能,其色谱分离图见图5a。可以看出,3′-SL和6′-SL分别从Sil@MC色谱柱上洗脱,实现了异构体的分离。3′-SL和6′-SL的保留时间分别为3.89 min和4.32 min,对应质谱图见图5b。在人乳样品中,有两个性质非常相近的四糖异构体,即LNT和LNnT,它们仅在一个键位上有所不同。采用Sil@MC色谱柱、在优化的梯度洗脱条件下,LNT和LNnT依次被洗脱(见图5c),其保留时间分别为4.62 min和4.98 min,对应质谱见图5d。
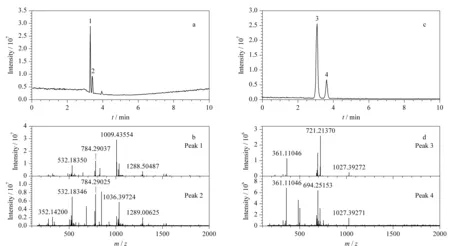
图 4 低聚糖同分异构体在Sil@MC色谱柱上的分离Fig. 4 Separation of oligosaccharides isomers on the Sil@MC column Mobile phase: (A) water (containing 0.1% (v/v) formic acid) and (B) acetonitrile; gradient elution program: 0-1.5 min, 3%B, 1.5-3.5 min, 3%B-40%B, 3.5-10 min, 40%B-80%B. Peak Nos.: 1. melezitose; 2. raffinose; 3. nystose; 4. stachyose.
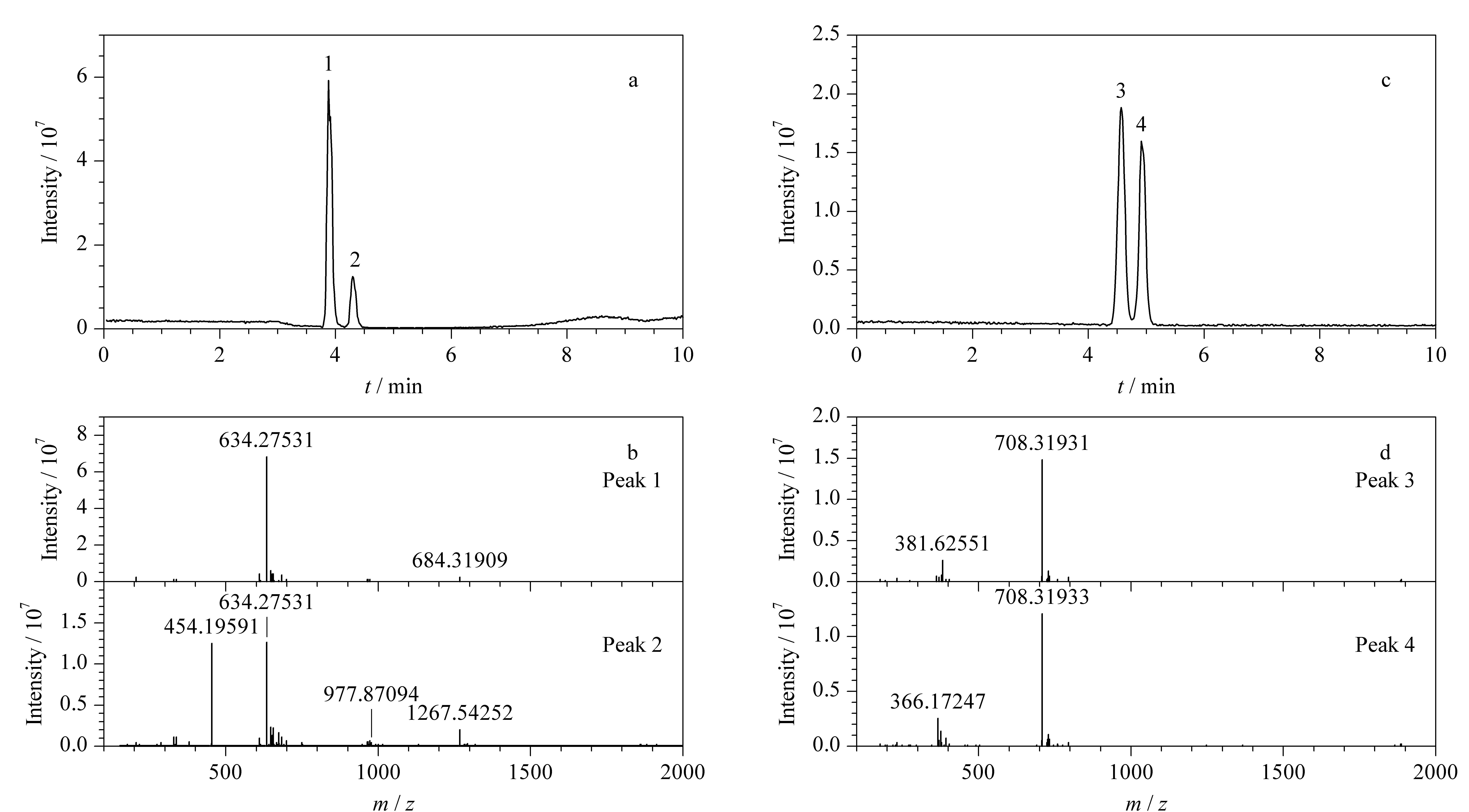
图 5 人乳寡糖异构体在Sil@MC色谱柱上的分离Fig. 5 Separation of human milk oligosaccharides isomers on the Sil@MC column Mobile phase: (A) water (containing 0.1% (v/v) formic acid) and (B) acetonitrile; gradient elution program: for Fig. 5a, 0-2 min, 3%B, 2-4 min, 3%B-20%B, 4-10 min, 20%B-80%B; for Fig. 5c, 0-1.5 min, 3%B, 1.5-4.0 min, 3%B-30%B, 4-10 min, 30%B-80%B. Peak Nos.: 1. 3′-sialyllactose (3′-SL); 2. 6′-sialyllactose (6′-SL); 3. lacto-N-tetraose (LNT); 4. lacto-N-newtetraose (LNnT).
3 结论
本文以二氧化硅为内核,通过简单的方法合成了Sil@MC材料,克服了纳米孔碳材料不能直接用作HPLC固定相的问题,涂覆后的材料比表面积和孔径改变较少,在高效液相色谱-质谱体系中,D-(+)-氨基葡萄糖盐酸盐、葡萄糖、D-(+)-海藻糖二水合物、棉子糖4种极性糖类化合物在合成的Sil@MC色谱柱上实现了分离,而这4种化合物在未涂覆酚醛树脂的二氧化硅色谱柱上未得到分离。将Sil@MC色谱柱应用于低聚糖同分异构体的分离,代表性低聚糖和乳寡糖中三糖或四糖异构体均实现了分离,体现了优异的碳-糖相互作用性能。结果表明,本文采用了简单的方法成功将酚醛树脂基碳材料引入到色谱固定相中,证明核壳型硅碳复合材料是一种具有前景的高效液相色谱固定相材料。
