实时荧光定量PCR仪检测HBV DNA的性能验证及评价 *
2020-11-02李彩东陈俏丽田鹏飞
李彩东,陈俏丽,田鹏飞
甘肃省兰州市第二人民医院肝病研究所,甘肃兰州 730046
乙型肝炎病毒(HBV)感染是全球性公共卫生问题,我国是HBV感染高发国家,有2 000万~3 000万人是携带HBV的慢性乙型肝炎患者[1]。HBV DNA定量反映了病毒复制水平,是抗病毒治疗适应证选择和疗效判断的重要指标[2]。目前,常采用实时荧光定量聚合酶链反应(PCR)法进行HBV DNA定量检测,该法对试剂、标本和操作的要求较高。因此,本实验室从精密度、准确度、可报告范围、定量检测限、质控方面对现行使用的ABI step one plus实时荧光定量PCR仪进行了全面评估,现报道如下。
1 资料与方法
1.1一般资料 收集本实验室高水平HBV DNA标本(3.11×108IU/mL,阳性标本)用于可报告范围与定量检测限验证;高水平(106IU/mL)和低水平(103IU/mL)血清标本用于精密度验证。乙型肝炎表面抗体为阳性,其余指标为阴性的混合血清作为阴性血清标本。所有血清标本在当天分离后-20 ℃保存备用。
1.2仪器与试剂 ABI step one plus实时荧光定量PCR仪,离心机,生物安全柜,湖南圣湘HBV DNA定量检测试剂盒(一步法,批号2019022、2019023),质控品(批号20181009)。
1.3方法 在PCR反应管中加入5 μL核酸释放剂,然后加入5 μL标本,用移液枪反复吹打混匀后,静置10 min。加入40 μL配制好的反应液,混匀后瞬时离心,放置于实时荧光定量PCR仪上进行检测。热循环条件:50 ℃ 2 min;94 ℃ 5 min;94 ℃ 15 s,57 ℃ 30 s进行45个循环,并在57 ℃ 30 s采集荧光基团FAM、荧光分子VIC通道的荧光信号。
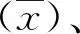
1.3.2准确度 取参加2019年全国临床检验实验室室间质评的HBV DNA定量检测血清标本,共5个水平,每个水平重复检测3次,记录结果。采用室间比对的方式对结果进行评估,计算偏倚。
1.3.3可报告范围 按照CLSI EP06-A文件[4]相关要求,试剂盒说明书提供的可报告范围为1.00×102~5.00×109IU/mL,选取实验室高水平血清标本(3.11×108IU/mL),用阴性混合血清梯度稀释至102IU/mL,每个稀释水平做两个复孔。
1.3.4定量检测限 取高水平血清标本(3.11×108IU/mL)分别稀释至200、100 IU/mL,分装冻存于-20 ℃冰箱。每天检测1次,每次重复做3次,连续检测5 d。分别计算2个标本检测的精密度(CV值),从中选择最接近于20%CV的对应水平,即为可定量报告的最低水平。
1.3.5室内质控 质控品保存于-20 ℃,使用前充分复融并离心。所有试验均做阴性对照、阳性对照以及阳性质控,质控在控则结果有效,否则需要重新检测。
2 结 果
2.1精密度验证 利用HBV DNA检测试剂盒检测高水平(106IU/mL)和低水平(103IU/mL)标本,结果显示二者批内CV和批间CV均小于5.0%,符合厂家声明。见表1。
2.2准确度验证 对2019年参加全国临床检验实验室室间质评的HBV DNA定量检测结果进行统计分析。5份血清标本共15个检测结果,其中1份标本检测结果为阴性(结果为0),4份标本检测结果为阳性,最大偏倚为-1.8%,符合国家卫生健康委员会临床检验中心要求(<8.0%)。室间质评得分为100分,准确度良好,验证通过。见表2。
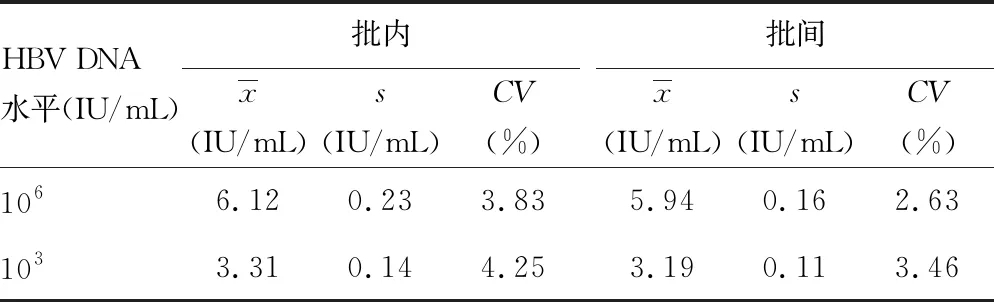
表1 HBV DNA检测试剂盒精密验证结果
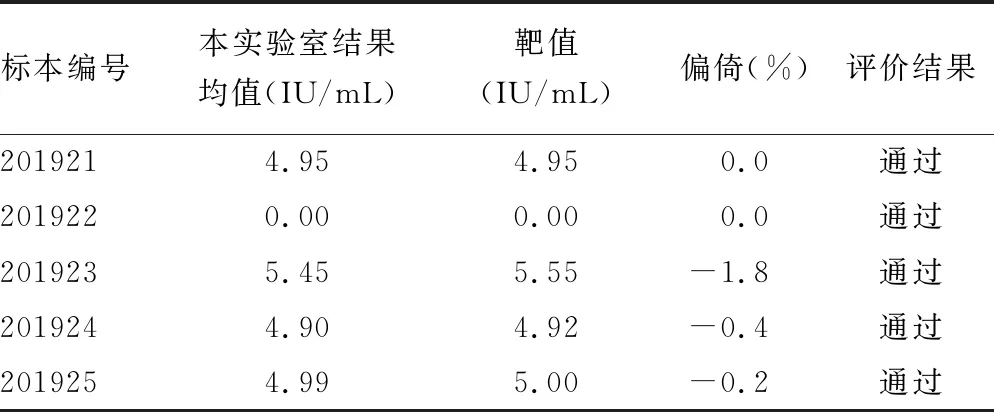
表2 2019年参加全国临床检验实验室室间质评HBV DNA定量结果
2.3可报告范围验证 以预测值为横坐标,实测值为纵坐标进行线性回归,并计算决定系数R2,得到直线回归方程Y=1.013 2X+0.019 2,R2=0.997>0.98,符合线性要求(图1)。本试验得到的线性范围为2.51×102~3.11×108IU/mL,在厂家声明范围(1.00×102~5.00×109IU/mL)内。

图1 HBV DNA检测试剂盒可报告范围验证结果
2.4定量检测限验证 对稀释标本的检测结果进行统计分析,HBV DNA水平为200 IU/mL的标本平均检测值为218 IU/mL,CV为19%,符合要求。因此,本检测方法可定量报告的最低水平为200 IU/mL。见表3。

表3 HBV DNA检测下限
2.5质控数据累积评价 将2019年10—12月使用的批号为20170109的HBV质控品共59次质控数据进行统计分析,该批号所有质控品测定值均在参考范围内,没有超出失控限。见表4。
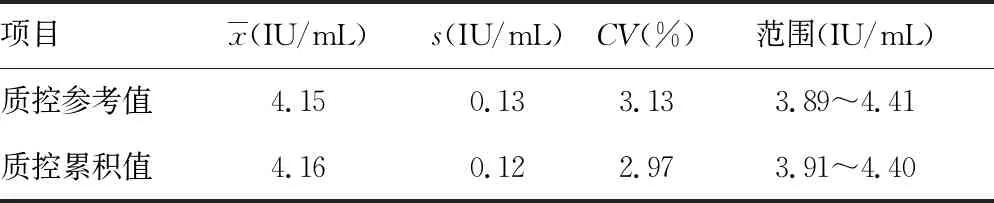
表4 HBV DNA质控数据累积结果
3 讨 论
实时荧光定量PCR作为精准治疗的有效检测手段,具有灵敏度高、特异性强等优点,现已广泛应用于临床检测。与临床检验、生化等项目相比,PCR定量试验自动化程度相对较低,对操作人员和实验条件的要求较高,因此,结合本实验室实际情况对PCR检测系统进行性能验证是十分必要的。本文参照国内外相关标准及方法[5-8],从以下5个方面验证了本实验室实时荧光定量PCR检测体系的性能。
精密度是指同一样品多次测定结果之间的接近程度,包括批内精密度和批间精密度。本研究选用两个水平的血清标本,验证结果表明,高水平(106IU/mL)标本和低水平(103IU/mL)标本批内CV分别为3.83%、4.25%,批间CV分别为2.63%、3.46%,均小于厂家声明值(5.0%)及ISO标准值(7.5%)。
准确度是指测定值与参考值的接近程度,常采用以下两种方法进行验证:一是用检验方法或比对方法对患者标本进行检测、验证;二是检测有确定值的参考物质,进行验证[9]。本实验室通过检测能溯源的国家级标准物质进行准确度验证,结果表明,检测值最大偏倚为-1.8%,符合国家卫生健康委员会临床检验中心质评要求(<8.0%)。
可报告范围是指检测方法可报告的最高与最低水平的变化范围,即检测线性范围。厂家声明的线性范围为1.00×102~5.00×109IU/mL,本实验室由于缺少高值标本,测定选取的范围为2.51×102~3.11×108IU/mL,在此范围内线性良好。在后期试验中,还需进一步取材验证上限范围。
定量检测限是检测样品能被定量测定的最低量,该测定结果应该具有一定的准确度[10]。本实验室选取两个水平标本进行多次、重复测定,结果显示,本检测系统的定量检测限为200 IU/mL。该结果高于厂家声明的1.0×102IU/mL,推测原因如下:(1)商品化试剂盒在开发过程中虽进行了完整的方法学验证,但在临床使用过程中,考虑到人员操作、样品及检测系统等差异,其结果会有一定误差。基于本实验室检测仪器确定HBV DNA定量检测限为200 IU/mL,因此对临床低于200 IU/mL的检测结果,要结合扩增曲线及Ct值,报告相应的测定值。(2)由于标本稀释过程中未充分混匀或者液体残留至管壁上,导致部分HBV DNA水平为100 IU/mL的血清标本检测结果偏低,CV大。这提示研究者在检测标本时要充分混匀和离心。(3)本试验步骤中标本取样量少,仅5 μL,可能造成了低水平标本检测的试验误差。目前,我国已有多家医院检验科使用全自动核酸提取扩增一体仪,避免了人为因素及移液器造成的系统误差,保证了检测结果的准确性。
综上所述,本实验室基于ABI step one plus实时荧光定量PCR仪的HBV DNA定量检测系统的精密度、准确度、可报告范围等性能良好,定量检测限为200 IU/mL,高于试剂盒说明书,其余均与试剂盒相符。质控品批内性质稳定,符合《医学实验室质量和能力认可准则(2012年)》要求,可用于临床常规检测。
