HPLC 法同时测定前列消胶囊中9 种成分
2020-11-02赵善冬任维鑫
焦 健 董 伟 赵善冬 任维鑫 张 超
(1.济南市人民医院, 山东 济南271199; 2.山东中医药大学中药学院, 山东 济南250355)
前列消胶囊由虎杖、土茯苓、泽泻、鹿茸、金樱子等11 味药材加工而成,临床上主要用于尿频、尿急、尿涩痛、小便淋漓不尽、腰膝酸软等前列腺炎属下焦湿热证的治疗[1],可明显缓解慢性前列腺炎患者临床症状,疗效显著[2]。但该制剂现行质量标准仅对大黄酸进行定量分析,而该成分来源广泛,专属性不强,难以全面控制质量。
中药及其制剂组成多样,作用机理复杂,通过多种成分之间的协同作用来达到临床疗效,故多指标成分检测模式近年来已逐步应用于其质量控制中。虎杖苷为虎杖特征成分,具有保护心血管系统、抗氧化、提高机体免疫力的作用[3⁃4];落新妇苷、花旗松素、黄杞苷等黄酮为土茯苓主要成分,具有利尿、镇痛、抗炎、抗氧化、免疫抑制、抗肿瘤等作用[5⁃6];泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇B 等三萜为泽泻药效成分,具有利尿、降脂、降糖、降血压等药理作用[7⁃8]。本实验参考中药质量标志物确定原则,采用HPLC 法测定前列消胶囊中君药虎杖特征成分虎杖苷,臣药土茯苓主要活性成分落新妇苷、花旗松素、黄杞苷,佐药泽泻代表性成分泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇B 的含有量,以期为全面评价该制剂质量提供依据。
1 材料
1.1 仪器 UltiMate3000 型高效液相色谱仪(美国赛默飞世尔科技公司);XPR205D5/AC 型电子天平(瑞士梅特勒⁃托利多公司);SB⁃800DT 型超声波清洗器(宁波新芝生物科技股份有限公司)。
1.2 试剂与药物 23⁃乙酰泽泻醇B(批号111846⁃201705,纯度99.7%)、落新妇苷(批号111798⁃201805,纯度93.6%)、花旗松素(批号111816⁃201102,纯 度98.9%)、黄杞苷(批 号111906⁃201102,纯度93.7%)对照品均购自中国食品药 品检定 研究院;虎杖苷(批 号PRF8071241,纯 度98.8%)、泽泻醇A(批 号14112903,纯度98.5%)、24⁃乙酰泽泻醇A(批号PRF8050342,纯度99.6%)对照品均购自成都普瑞法科技开发有限公司;泽泻醇 F(批号CFS201701,纯 度 98.0%)、泽泻醇 G(批 号CFS201702,纯度98.0%)对照品均购自武汉天植生物技术有限公司。前列消胶囊(每粒装0.3 g,批号20190107、20190302、20190405)购自吉林省德商药业股份有限公司。乙腈为色谱纯;其他试剂均为分析纯。
2 方法与结果
2.1 对照品溶液制备 精密称取虎杖苷、落新妇苷、花旗松素、黄杞苷、泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇B 对照品适量,60% 乙醇制成各成分质量浓度分别为1.568、3.092、0.476、1.318、0.132、0.354、0.182、0.116、1.172 mg/mL 的贮备液,各精密吸取2.5 mL,置于同一50 mL 量瓶中,60%乙醇定容至刻度,即得(各成分质量浓度分别为78.4、154.6、23.8、65.9、6.6、17.7、9.1、5.8、58.6 μg/mL)。
2.2 供试品溶液制备 取胶囊数粒,倾出内容物后研成细粉,精密称取2.0 g,精密加入25 mL 60%乙醇,称定质量,超声提取30 min,放冷,60%乙醇补足减失的质量,滤过,即得。
2.3 阴性样品溶液 按胶囊处方工艺,分别制备缺虎杖、缺土茯苓、缺泽泻的阴性样品,按“2.2” 项下方法制备,即得。
2.4 色谱条件 Kromasil C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈(A)⁃0.1%冰醋酸(B),梯度洗脱(0~12.0 min,20.0% A;12.0~18.0 min,20.0%~25.0% A;18.0~34.0 min,25.0%~30.0% A;34.0~39.0 min,30.0%~55.0% A;39.0~58.0 min,55.0%~80.0% A;58.0~65.0 min,80.0%~20.0% A);体积流量1.0 mL/min;柱温30 ℃;0~34.0 min 在291 nm波长处检测虎杖苷、落新妇苷、花旗松素、黄杞苷[9⁃10],34.0~65.0 min 在208 nm 波长处检测泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇B[11⁃12];进样量10 μL。
2.5 方法学考察
2.5.1 专属性试验 取对照品、供试品、阴性样品溶液适量,在“2.4” 项色谱条件下进样测定,结果见图1。由此可知,各成分色谱峰峰形对称,与相邻峰均能有效分离,分离度均大于1.5,理论塔板数按各成分计均不小于4 000,阴性无干扰。
2.5.2 线性关系考察 精密吸取“2.1” 项下贮备液2.0 mL,60%乙醇定容至20 mL,精密吸取适量,60%乙醇依次稀释2、5、10、15、20 倍,在“2.4”项色谱条件下进样测定。以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表1,可知各成分在各自范围内线性关系良好。
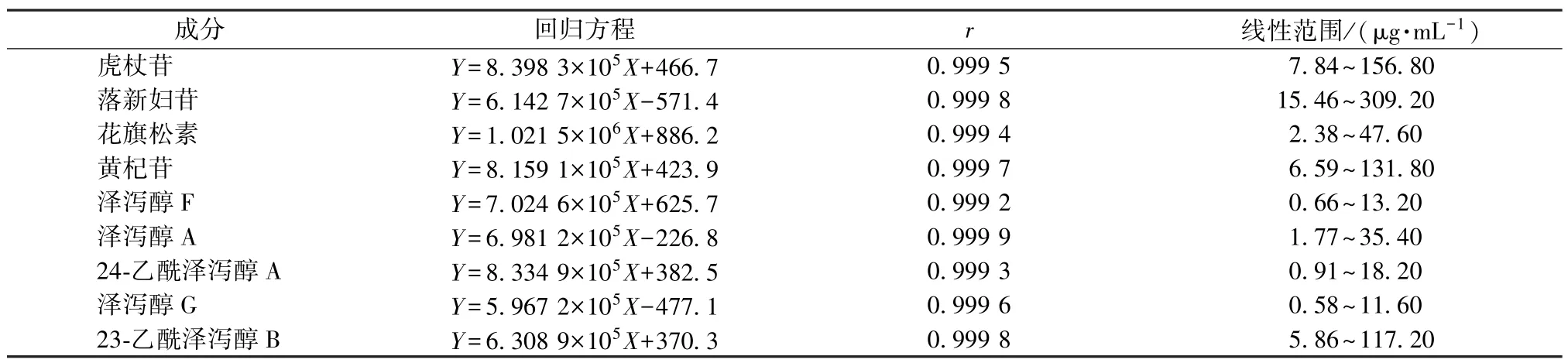
表1 各成分线性关系Tab.1 Linear relationships of various constituents

图1 各成分HPLC 色谱图Fig.1 HPLC chromatograms of various constituents
2.5.3 精密度试验 精密吸取“2.1” 项下对照品溶液,在“2.4” 项色谱条件下进样测定6 次,测得虎杖苷、落新妇苷、花旗松素、黄杞苷、泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇B 峰面积RSD 分别为0.63%、0.57%、0.92%、0.69%、1.20%、0.99%、1.07%、1.15%、0.76%,表明仪器精密度良好。
2.5.4 重复性试验 取同一批胶囊,按“2.2”项下方法平行制备6 份供试品溶液,在“2.4” 项色谱条件下进样测定,测得虎杖苷、落新妇苷、花旗松素、黄杞苷、泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇含有量RSD 分别为1.07%、0.96%、1.53%、1.11%、0.61%、1.36%、1.42%、0.79%、1.23%,表明该方法重复性良好。
2.5.5 稳定性试验 取同一份供试品溶液,于0、2、4、6、12、24 h 在“2.4” 项色谱条件下进样测定,测得虎杖苷、落新妇苷、花旗松素、黄杞苷、泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇峰面积RSD 分别为0.65%、0.59%、0.89%、0.71%、1.18%、1.01%、1.06%、1.14%、0.78%,表明溶液在24 h 内稳定性良好。
2.5.6 加样回收率试验 取各成分含有量已知的同一批胶囊数粒,倾出内容物,研成细粉,精密称取9 份,每份1.0 g,每3 份为1 组,按2015 年版《中国药典》 四部要求精密加入对照品溶液(虎杖苷1.152 mg/mL、落新妇苷2.298 mg/mL、花旗松素0.316 mg/mL、黄杞苷0.978 mg/mL、泽泻醇F 0.092 mg/mL、泽泻醇A 0.226 mg/mL、24⁃乙酰泽泻醇A 0.138 mg/mL、泽泻醇G 0.082 mg/mL、23⁃乙酰泽泻醇B 0.848 mg/mL)0.5、1.0、1.5 mL,使待测成分加入量分别约为样品含有量的50%、100%、150%,按“2.2” 项下方法制备供试品溶液,在“2.3” 项色谱条件下进样测定,计算回收率。结果,虎杖苷、落新妇苷、花旗松素、黄杞苷、泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇平均加样回收率分别为99.58%、100.09%、97.88%、99.73%、96.94%、98.93%、98.77%、97.81%、99.98%,RSD 分别为1.03%、0.77%、1.42%、0.99%、1.21%、1.14%、1.28%、1.39%、0.87%。
2.6 样品含有量测定 取3 批胶囊,按“2.2”项下方法制备供试品溶液,每批平行3 份,在“2.3” 项色谱条件下进样测定,计算含有量,结果见表2。
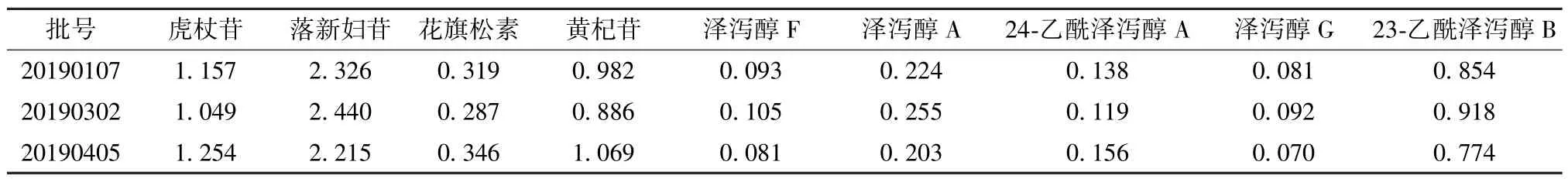
表2 各成分含有量测定结果(mg/g, n=3)Tab.2 Results of content determination of various constituents(mg/g, n=3)
3 讨论
3.1 提取方法筛选 本实验比较了提取溶剂(甲醇[13]、95% 乙 醇、60% 甲 醇、60% 乙 醇[9⁃10,14])、提取方式(超声[9⁃13]、加热回流[14])、提取时间(15、30、45 min)对各成分综合提取率的影响,发现60%乙醇超声提取30 min 时最高,而且杂质干扰较小。
3.2 洗脱系统筛选 本实验首先考察了乙腈⁃水[9,11⁃12,14]流动相,发现色谱图基线有漂移,虎杖苷、落新妇苷、黄杞苷色谱峰峰形不理想,存在拖尾现象。再考察了乙腈⁃0.1% 冰醋酸[10,13]、乙腈⁃0.1%甲酸[8],发现以乙腈⁃0.1% 冰醋酸洗脱时色谱图基线平稳,各成分峰形对称,与相邻峰的分离效果良好。
3.3 含有量分析 表2 显示,不同批次前列消胶囊中各成分含有量存在一定差异,以24⁃乙酰泽泻醇A、泽泻醇G 更明显,可能与原药材产地、采收季节等因素有关。
4 结论
本实验采用HPLC 法同时测定前列消胶囊中虎杖苷、落新妇苷、花旗松素、黄杞苷、泽泻醇F、泽泻醇A、24⁃乙酰泽泻醇A、泽泻醇G、23⁃乙酰泽泻醇B 的含有量,该方法操作便捷,结果准确,可为该制剂质量控制提供依据,并有助于生产企业完善原药材质量标准,降低批次间差异,从而达到产品质量的稳定性和临床疗效的一致性。
