香菇草根部浸提液对伪鱼腥藻化感作用的研究
2020-10-31周利姚苗苗匡兵高静思朱佳
周利,姚苗苗,匡兵,高静思,朱佳
1. 青岛理工大学环境与市政工程学院,青岛 266033
2. 山东省调水工程运行维护中心青岛分中心,青岛 266033
3. 哈尔滨工业大学深圳研究生院,深圳 518055
4. 深圳职业技术学院建筑与环境工程学院,深圳 518055
0 前言
水体富营养化已经成为严重的水环境问题之一,2012年Tian等[1]在研究中国的南四湖时发现伪鱼腥藻(Pseudanabaenasp.)为优势种,占比高达 32.94%,之后在中国的东平湖[2],丰庆湖[3]等均发现伪鱼腥藻占优势。伪鱼腥藻属于蓝藻门,常见于淡水鱼虾池和水库中[4-7],一般作为微囊藻的伴生种一起在富营养化水体中形成水华[8]。可产生典型嗅味物质 2-甲基异莰醇(2-MIB)[9-10],Teneva等[11]证实了它还可以产生神经毒素和肝毒素,需要引起足够的关注和重视。
化感作用是植物产生的次代谢物质进入到环境中从而对生物的生长产生作用[12]。化感抑藻由于具备生物降解性好、不污染环境,经济等特点,被认为是一种颇有前景的控藻方式[13-14]。近年来,关于化感作用在水生生态系统中的研究十分活跃,也发现了多种能够抑制藻类生长的水生植物,如菖蒲(Acorus calamus L.)、梭鱼草(Pontederia cordata)、南美蟛蜞菊(Wedelia trilobata)、美人蕉(Canna indica)[15-18]等。香菇草(Hydrocotyle vulgaris)也被证实化感作用明显[19],朱嘉成[20]2014年发现香菇草对铜绿微囊藻有明显的化感抑制作用,但关于香菇草对伪鱼腥藻化感作用的研究还未见报道。香菇草是伞形科(Umbelliferae)天胡荽属(Hydrocotyle)多年生草本,原产于欧美的挺水或湿生观赏植物,国内多用做观赏植物[21],多分枝,节生根且根茎发达[22],对环境适应性强,生物量大[19],具有良好的应用前景。本文通过设置不同的香菇草根部浸提液的投加量,来研究香菇草根部浸提液对伪鱼腥藻的化感作用,以期为防控伪鱼腥藻提供新的思路。
1 材料与方法
1.1 试验材料
试验植物香菇草来自于深圳市南山花卉世界,长势均匀,生长良好,无病虫害,植株高约 10—20 cm,购买后将香菇草用自来水冲洗干净,置于无菌玻璃瓶中,用 BG11培养基培养 2天,排除外界条件对试验的干扰。试验所需伪鱼腥藻(FACHB-1277)购自中科院水生生物研究所淡水藻种库。试验正式开始前将伪鱼腥藻藻种扩大培养至对数增长期,并反复接种扩大培养,待藻种数量达到试验用量后接种试验。试验所用培养基为BG11培养基,经高温高压灭菌后使用。
1.2 试验方法
浸提液的制备:将新鲜的香菇草根部分离后,取100 g 于60 ℃下干燥48 h后研磨成粉末,然后用500 mL的 BG11培养基浸泡 48 h,离心去除残渣,上清液先用定量滤纸过滤,再经孔径为0.2 μm 滤膜减压抽滤排除微生物的影响,所得滤液即为浸提液母液,其香菇草根部浸提液浓度为200 g·L-1(以香菇草根部鲜重计),置于冰箱(4 ℃)中贮存备用。
试验设置:在无菌条件下将香菇草根部浸提液、藻种置于500 mL锥形瓶内,加入BG11 培养基使培养体系总体积为 250 mL,藻叶绿素 a浓度为 90 μg·L-1,香菇草根部浸提液添加量分别为 0、2 g·L-1,4 g·L-1,6 g·L-1,8 g·L-1、10 g·L-1(以香菇草根部鲜重计)共6个处理组,每组设三个平行。
培养条件: 试验在光照培养箱中进行,光照强度2500 lx,光暗比 12 h:12 h,温度 25 ℃,每天定时手动摇瓶3次,并任意交换锥形瓶位置,以减少由于培养箱内光照不均匀而产生的试验误差。试验所用所有玻璃器皿均经121 ℃,20 min高温灭菌后使用。
1.3 检测仪器及检测参数
试验期间,采用调制荧光仪(PHYTO-PAM,Walz 公司,德国)检测伪鱼腥藻的ρ(Chl a)及藻细胞PSⅡ(光合系统Ⅱ)的光合活性。采用分光光度计及相关试剂盒(A001-1 南京建成生物工程研究所)测定SOD活性。

表1 香菇草根部浸提液浓度Table 1 The concentration gradient of water extract of Hydrocotyle vulgaris root
测定叶绿素荧光参数前将样品暗适应5 min,各参数可在仪器上直接读出。PS Ⅱ光合活性的参数: 1.Fv/Fm表示最大光化学量子产量,在光抑制条件下,Fv/Fm的降低表明藻类受到了环境的胁迫。2.rETR为光抑制时的相对电子传递速率,相当于一定光强下单位生物量内的光合作用速率。以叶绿素a的浓度〔ρ(Chl a)〕来反映藻细胞密度,采用特征荧光法测定ρ(Chl a),即每天定时采用调制荧光仪直接测定,该方法便捷高效。
1.4 数据处理
香菇草根部浸提液对藻类的抑制率计算:IR=(1-N/N0)×100,式中:IR为抑制率%;N, N0分别为试验组和对照组ρ(Chl a),μg·L-1。
藻的比生长速率计算:μ= (lnX2-lnX1) /(T2-T1),式中T1、T2为培养时间,X1、X2为培养T1、T2时间的伪鱼腥藻ρ(Chl a),μg·L-1。
EC50值是藻细胞生长抑制率为 50%时香菇草根部浸提液的浓度。以藻类ρ(Chl a)的变化作为衡量藻类活力的毒理响应指标,香菇草浸提液浓度取10的对数为横坐标,通过查生物统计机率值换算表,以ρ(Chl a)抑制率对应的机率值作为纵坐标,求出回归方程,以抑制率为 50%时对应的机率值求出EC50的值[23]。
利用 Microsoft Excel 软件进行数据统计。
2 结果与分析
2.1 不同香菇草根部浸提液浓度对伪鱼腥藻叶绿素a浓度的影响
伪鱼腥藻与不同浓度的香菇草根部浸提液共培养22天后有不同程度的生长。由图1可见,在前4天,各试验组处于稳定期,第 4—10天各试验组出现缓慢增长,第 10天之后均进入了对数增长期,且各试验组伪鱼腥藻生长出现了较为明显的差距。添加低浓度香菇草根部浸提液(2 g·L-1,4 g·L-1)的试验组和对照组伪鱼腥藻ρ(Chl a)数值区别不大,且趋势相近,促进和抑制效果均不明显。添加高浓度香菇草浸提液(6 g·L-1,8 g·L-1,10 g·L-1)的试验组伪鱼腥藻的生长则出现不同程度的抑制作用。培养结束时添加量为 0,2 g·L-1,4 g·L-1,6 g·L-1,8 g·L-1和 10 g·L-1的试验组ρ(Chl a)分别为 7171.18 μg·L-1,6727.15 μg·L-1,6942.45 μg·L-1,4873.97 μg·L-1,3357.73 μg·L-1和 2437.08 μg·L-1。
各试验组应用ρ(Chl a)计算得到的藻类生长比增长速率如图2所示。将添加量按照伪鱼腥藻比增长速率从高到低排列依次为: 0,4 g·L-1,2 g·L-1,6 g·L-1,8 g·L-1和 10 g·L-1。最高比增长速率为 0.187 d-1,最低比增长速率为 0.143 d-1。
由图3可见,各试验组ρ(Chl a)抑制率差异显著,10 g·L-1添加量组最高,其次是 8 g·L-1和 6 g·L-1,最后为 2 g·L-1和 4 g·L-1。低浓度组(2 g·L-1和 4 g·L-1)在培养期内出现了促进藻细胞叶绿素a增长的现象。吴湘等[24]在研究黄花水龙对铜绿微囊藻化感作用时也发现低浓度组的化感物质在试验开始 1—2 d 内对藻细胞生长反而起促进作用,肖晗等[25]也发现低浓度海菖蒲浸提液对锥状斯氏藻起促进作用。添加量2 g·L-1组IR变化在-11.98%—9.88%之间,添加量4g·L-1组IR变化在-10.92%—8.60%之间,因此低浓度添加量组整体对藻叶绿素a作用效果不明显。高浓度处理组(6 g·L-1,8 g·L-1和 10 g·L-1)在培养期一直表现为抑制,最后一天抑制出现了下降趋势。最高抑制率为 73.43%(添加量 10 g·L-1,第 8 天时)。

图1 不同香菇草根部浸提液浓度下伪鱼腥藻叶绿素a的浓度Figure 1 The ρ(Chl a) of Pseudanabaena sp. under different concentrations of water extract of Hydrocotyle vulgaris root

图2 第22天时不同香菇草根部浸提液浓度下伪鱼腥藻的比生长速率Figure 2 Specific growth rates of Pseudanabaena sp. under different concentrations of water extract of Hydrocotyle vulgaris root on the 22 day

图3 不同香菇草根部浸提液浓度下伪鱼腥藻的叶绿素a抑制率Figure 3 The ρ(Chl a) inhibition rates of Pseudanabaena sp.under different concentrations of water extract of Hydrocotyle vulgaris root
2.2 不同香菇草根部浸提液浓度对伪鱼腥藻叶绿素荧光参数的影响
图4为不同香菇草根部浸提液浓度下伪鱼腥藻最大光化学量子产量Fv/Fm的变化。可以看出Fv/Fm总体上呈先上升后下降的趋势,添加量为 4 g·L-1,6 g·L-1,8 g·L-1,10 g·L-1的试验组Fv/Fm值在第三天达到了峰值,10 g·L-1的值最大为 0.38,说明在初始阶段,香菇草根部浸提液对伪鱼腥藻有刺激作用,使得伪鱼腥藻最大光化学量子产量产生快速的变动,之后由于藻自身的调节系统趋于稳定。各组在第五天之后整体呈下降趋势,对照组的下降趋势最为缓慢,在第 13 天之后Fv/Fm值始终高于其他试验组,整个培养期Fv/Fm变化范围0.23—0.32。添加量为 2 g·L-1,4 g·L-1和 6 g·L-1三组Fv/Fm变化趋势较为相似,在 11天之后Fv/Fm值低于对照组,大于添加量8 g·L-1,10 g·L-1的试验组。添加量8 g·L-1,10 g·L-1试验组的下降趋势最大,第 7天之后,添加量为8 g·L-1的试验组Fv/Fm始终大于添加量为10 g·L-1的试验组,添加量为8 g·L-1试验组的Fv/Fm变化范围为 0.35—0.12,添加量为 10 g·L-1试验组的Fv/Fm变化范围 0.38—0.08。结合图 5,10 g·L-1添加量下0—14天Fv/Fm抑制率稳步上升,14天之后稳定在40%左右,而最大抑制率为44.44%。

图4 香菇草根部浸提液对伪鱼腥藻最大光化学量子产量的影响Figure 4 The effects of water extract of Hydrocotyle vulgaris root on Fv/Fm of Pseudanabaena sp.

图5 10 g·L-1香菇草根部浸提液浓度下伪鱼腥藻最大光化学量子产量抑制率Figure 5 Inhibition rates of the Fv/Fm of Pseudanabaena sp. under 10 g·L-1 water extract of Hydrocotyle vulgaris root
不同香菇草根部浸提液浓度下伪鱼腥藻最大相对电子传递速率rETR如图6所示,与Fv/Fm变化趋势相似。对照组伪鱼腥藻最大相对电子传递速率数值在 72—86.7之间上下波动,整体较为平稳。化感物质添加量为 2 g·L-1,4 g·L-1和 6 g·L-1的试验组rETR值变化趋势基本一致且数值差别不大,且第 5天之后,数据都低于对照组。添加量为 8 g·L-1,10 g·L-1的试验组伪鱼腥藻的下降趋势最大,第6天之后,添加量为 8 g·L-1的试验组rETR始终大于添加量为 10 g·L-1的试验组,添加量为 8 g·L-1试验组的rETR变化范围为59—87.3,添加量为10 g·L-1试验组的rETR变化范围52—86.1。由图7可以看出,添加量为10g·L-1抑制率随时间延长波动上升,最后稳定在20%上下,最大抑制率可达到28.63%。
2.3 不同香菇草根部浸提液浓度对伪鱼腥藻酶活性的影响
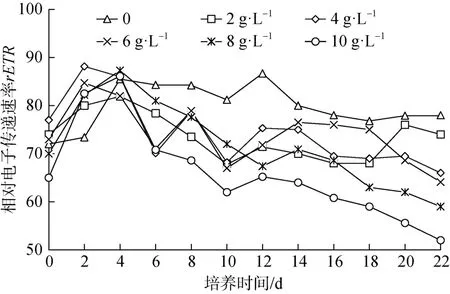
图6 香菇草根部浸提液对伪鱼腥藻电子相对传递速率的影响Figure 6 The effects of water extract of Hydrocotyle vulgaris root on rETR of Pseudanabaena sp.

图7 10 g·L-1香菇草根部浸提液浓度下伪鱼腥藻电子相对传递速率抑制率Figure 7 Inhibition rates of the rETR of Pseudanabaena sp.under 10 g·L-1 water extract of Hydrocotyle vulgaris root
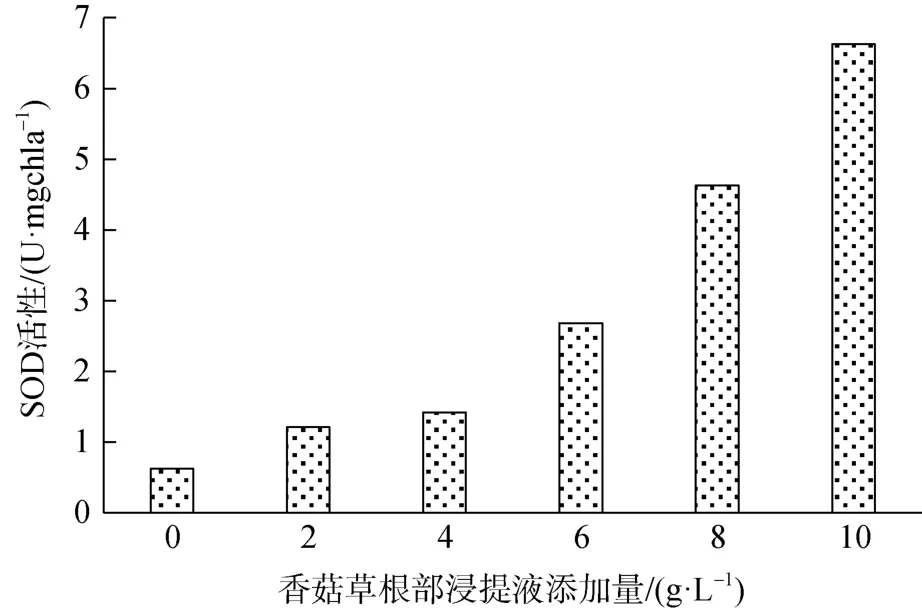
图8 第 13天时不同香菇草根部浸提液浓度下伪鱼腥藻SOD活性Figure 8 The SOD activities of Pseudanabaena sp. under different concentrations of water extract of Hydrocotyle vulgaris root on the 13th day
图8为试验第13天时不同香菇草根部浸提液添加量下伪鱼腥藻SOD活性。可以看出各试验组SOD活性都大于对照组,且添加量越高,SOD升高越大。添加量为 10 g·L-1的试验组 SOD 值为 6.627 U·mg-1,远大于对照组SOD值0.623 U·mg-1,说明藻细胞生长受到了外界极大胁迫。
3 讨论
化感作用的抑藻机理主要是破坏藻细胞的结构,改变光合作用,影响生物体酶的活性,改变核酸代谢等[12]。本研究结果表明,香菇草根部浸提液浓度从6 g·L-1的试验组开始对伪鱼腥藻产生持续明显的化感抑制效果,(EC50,96h)值为 9.33 g·L-1。李庆华等[26]研究柳树叶浸提液化感抑藻效应,结果表明对蛋白核小球藻有显著的化感抑制作用,半效应浓度(EC50,96h) 值为 11.82 g·L-1,白羽等[27]研究发现加拿大一枝花对铜绿微囊藻具有化感抑制作用,(EC50,72h)值为 9.57 g·L-1,表明香菇草根部浸提液具有抑制水华蓝藻的潜能,在筛选植物来化感抑制藻类水华方面值得引起关注。
在整个培养周期内低浓度的香菇草根部浸提液组(2 g·L-1,4 g·L-1)对伪鱼腥藻ρ(Chl a)的促进或抑制 效 果 不 明 显 ,而 高 浓 度 添 加 量 组 (6 g·L-1,8 g·L-1,10 g·L-1)ρ(Chl a)显著低于对照组,最高抑制率可达 73.43%(添加量 10 g·L-1,第 8 天时)。有报道称附着在凤眼莲根部的藻细胞中叶绿素a 浓度明显下降,而它的降解产物脱镁叶绿素 a酸酯的含量显著升高,表明凤眼莲抑藻成分可能促进了叶绿素 a的降解[28]。由此推测高浓度的香菇草根部浸提液可能促进藻类叶绿a的降解,减少藻类的同化产物,进而抑制伪鱼腥藻的生长。添加量为6 g·L-1,8 g·L-1和10 g·L-1组在培养到第22天伪鱼腥藻叶绿素a抑制率明显低于第16天时,造成这种现象的原因有可能是香菇草的抑藻成分不稳定,易分解或者具有挥发性,亦或是抑藻成分被藻细胞吸收。添加量为 6 g·L-1,8 g·L-1和 10 g·L-1组比生长速率分别为 0.173 d-1,0.158 d-1和0.143 d-1。可见随着香菇草根部浸提液浓度的增加,其抑藻效果逐渐增强。
在整个培养周期加入化感物质的试验组,Fv/Fm,rETR整体都低于对照组,可以推测,香菇草根部浸提液会影响藻类的光合系统,降低光合系统的最大光化学量子产量和相对电子传递速率,进而达到降低生物量的效果。杜彩丽等[29]研究发现高浓度的蟛蜞菊水提液严重破坏了藻细胞内部的类囊体膜和气囊等结构,类囊体膜的溶解会导致叶绿素和藻胆体等光合色素失去载体,气囊的破坏将造成细胞沉降,不利于光合作用。这可能是造成高浓度香菇草根部浸提液下伪鱼腥藻最大光化学量子产量和相对电子传递速率明显减小的原因。添加量10 g·L-1的Fv/Fm和rETR值显著低于对照组,且数值最低,与叶绿素a结果一致。说明10 g·L-1试验组伪鱼腥藻受到外界的威胁最大。高浓度组(6 g·L-1,8 g·L-1和 10 g·L-1)伪鱼腥藻叶绿素荧光参数都小于对照组,藻类的光合速率减弱,推测香菇草根部浸提液通过降低藻的光合速率来达到化感抑藻的效果。Fv/Fm最大抑制率为 44.44%(添加量为 10 g·L-1,第 16 天时),rETR最大抑制率为28.68%(添加量为10 g·L-1,第20天时),可能化感作用对Fv/Fm的抑制效果强于rETR。
本试验研究中,SOD的活性随着香菇草根部浸提液添加量的增多而应激性增加,表明香菇草根部浸提液添加量越多,伪鱼腥藻受到的威胁越大,化感作用越强。低浓度(2 g·L-1,4 g·L-1)组 SOD 值较对照组略有上升,可见低浓度香菇草根部浸提液对伪鱼腥藻有一定的胁迫致使一定量的氧自由基产生,但 SOD也随之呈现一定的应激活性来对抗与阻断因氧自由基对细胞造成的损害,这可能是低浓度香菇草根部浸提液对伪鱼腥藻化感作用不明显的原因。当添加量上升到 6 g·L-1,8 g·L-1和 10 g·L-1时,SOD的活性大幅度升高,说明藻类已经受到了较大的威胁,使细胞内的氧自由基过量产生,虽然 SOD活性随之上升,但机体本身的抗氧化体系已经不能完成清除氧自由基,活性氧大量累积可造成植物细胞内发生过氧化反应,破坏细胞内膜系统,使机体功能受损[30],最终抑制伪鱼腥藻生长,由此推测过藻细胞氧化损伤为香菇草根部浸提液的化感抑藻机理之一。
本研究发现添加量为 6 g·L-1,8 g·L-1和 10 g·L-1的香菇草根部浸提液对伪鱼腥藻有化感抑制作用,表现为伪鱼腥藻生物量的减少,藻光合系统受损以及对藻抗氧化体系酶有一定影响,其抑藻能力随着香菇草根部浸提液添加量增多而增强,因此香菇草可作为一种潜在生态控藻生物,为控制伪鱼腥藻水华发生提供一种新思路。需要说明的是,本试验是在排除细菌作用,光照不匀,营养竞争等条件下进行的,与自然水体环境条件尚不能完全吻合,究竟香菇草根部浸提液在实际生态系统中对藻类的影响如何,还需进一步研究。
