超高密度标测系统对周长交替变化的大折返性房性心动过速机制的探讨*
2020-10-31程光辉黄尾平张劲林韩宏伟邓成钢张勇华苏晞
程光辉 黄尾平 张劲林 韩宏伟 邓成钢 张勇华 苏晞
周长交替的房性心动过速(简称房速)临床上较罕见,以往的病例报道描述了房室折返性心动过速、房室结折返性心动过速和室性心动过速的不同机制[1-3],但具有长短周长交替的房速国内外的报道很少。近年来,由于超高密度、超高分辨率的标测工具的发展,应用超高密度标测系统可将心动过速的三维激动图标测的极其细致及精准[4-6]。在本研究中,笔者利用超高密度标测系统对这一特殊类型的房速的特征和电生理机制进行了研究。
1 资料和方法
1.1 临床资料 2017年5月至2018年12月,在武汉亚洲心脏病医院心内科应用高密度标测系统进行射频消融治疗的房速患者中,前瞻性地纳入并分析所有周长交替房速患者。长短周长交替定义为长周长与短周长的周长固定差>20 ms。所有患者均签署知情同意书。
1.2 电生理检查及射频消融 术前至少停用抗心律失常药物(胺碘酮除外)5个半衰期;术前1个月停用胺碘酮。术前行经食管超声心动图检查,排除心房血栓。所有患者均在全麻状态下进行电生理检查。经左锁骨下静脉放置5F 的10级冠状静脉窦电极,作为激动标测的参考电极。采用Prucka 64导电生理记录系统(GE公司 美国)记录双极腔内电图(滤波30~500 Hz)。术中应用肝素进行抗凝治疗,保持激活凝血时间>300 s。根据房速的激动特点,将房速分为大折返性房速、局部性微折返性房速和局灶性房速。大折返房速定义:折返激动围绕一个中心障碍区,且心动过速周长可覆盖整个心房激动时间的90%以上。如果不存在明显的中心障碍区,且在一个很小的局部区域(表面直径<3 cm)可记录到覆盖心动过速周长90%以上的电位,同时心房其余区域为离心扩布传导时,定义为局部微折返性房速。局灶性房速记录不到覆盖心动过速周长90%以上的电位,其激动规律性地从心房最早激动部位离心的向周围扩布,此后于心动周期很长的时间内无心内膜的激动。当存在两个折返环路且共同借助相邻的解剖结构进行折返,且任一折返环路均覆盖整个心动过速周长,这种心动过速定义为双环折返性心动过速。
1.3 超高密度激动标测 应用Rhythmia三维标测系统(波士顿科学公司,美国)进行激动标测。房速发作时,在可控弯长鞘(Agilis;美国雅培公司)支撑下应用Orion多极网篮电极(Orion;波士顿科学公司)进行激动标测。标测系统基于以下原则自行采点标测:①心动过速周长稳定,周长变化在10 ms内;②2个冠状静脉窦参考电极之间的相对激动时间差在5 ms内;③呼气相的呼吸门控,阈值设置为峰-峰振幅的50%;④导管位置稳定在1 mm 以内,导管记录到稳定的心电信号持续时间至少在75%的心搏间期;⑤电极与心腔表面接触最大距离≤2 mm。
对该类型房速在标测过程中可分别根据长周长及短周长设定不同的兴趣窗进行激动标测。因此激动标测的兴趣窗是根据目标房速周长的需要设定的,而不是系统的默认值。在操作过程中,可通过人工移动周长图形条来调整兴趣窗的设定,以便其仅覆盖所要标测的目标房速周长(图1)。

图1 周长交替变化的房速标测周长兴趣窗调整的实例
无心房电位的电沉默区定义为致密瘢痕区域,在三维激动标测图上为灰色区域。双电位线定义为由至少50 ms的等电位线分隔的两个不同的电位。碎裂电位定义为具有3个以上独立的正或负偏转的连续低振幅电图。瘢痕阈值设置为小于0.03 m V。
1.4 射频消融 激动标测明确房速机制后,消融靶点为折返环路的最窄的峡部传导通道,消融后将原瘢痕与电解剖屏障形成的峡部传导通道形成线性损伤,从而导致其解剖的传导阻滞。射频能量采用头端3.5 mm 的冷盐水灌注端导管,设定功率30~35 W,温度43℃,盐水流速17~30 m L/min。射频消融过程中房速终止转为窦性心律或目标房速转为另一种不同的房速定义为目标房速的终止。术后通过心房递增脉冲起搏刺激至最小起搏周长为200 ms或起搏直至心房组织的局部有效不应期进行诱发,证实房速不能诱发为手术终点。
1.5 随访 所有患者术后1年分别于第1、3、6、9和12个月于电生理专科门诊进行随访,此后每6个月随访1次。所有患者术后均接受华法林或新型口服抗凝药治疗,应用华法林抗凝治疗时,其目标国际标准化比率为2~3,抗凝治疗至少3个月。
1.6 统计学处理 连续变量以¯x±s 表示,正态分布变量组间比较采用student′t检验,非正态分布变量组间比较采用Mann-Whiteney U 检验。P<0.05为差异有统计学意义。采用SAS 9.2统计软件进行统计分析。
2 结果
一共436例连续接受心律失常标测并消融的患者中,共标测了478个房速。其中7例病例存在周长交替现象(7/478,1.5%)。7 例中,男3 例,女4例,平均[53.7±11.2(36~70)岁]。1例因风湿性心脏病行二尖瓣机械瓣置换术,1例有房间隔缺损修补术史,1 例有病窦综合征史并植入永久起搏器。该3例患者均为首次行射频消融手术。其余4例患者均曾经历过肺静脉电隔离及心房的基质改良射频消融术。该4例病例均为第二次行射频消融术。术中7例房速病例共进行了14次激动标测,多数激动标测不需要人工手动校点。激动标测过程中,在总共252 876个系统自动采点中,仅仅只有3个点(0.01%)进行了人工手动校正。房速平均周长[289±35(254~357)]ms。其中长周长房速激动标测平均采点数为21 520±11 103,短周长房速平均周长[251±18(230~273)]ms,其激动标测平均采点17 594±8 059。致密瘢痕的阈值区间为(0.015±0.007)m V(中位数0.014 m V)。
分别对长短周长房速三维激动标测图进行比较,笔者将长短周长交替的房速分为两种类型(图2)。类型1:存在2个具有不同传导路径及周长的潜在折返环路,且共享折返环路的某一段路径。其周长交替是由致密瘢痕区域内的一个传导通道发生间歇性2∶1传导阻滞导致。在周长较短的情况下,激动能够经过通道传导,折返环路的路径相对较短。但长周长房速时,因为原有的瘢痕内的通道出现功能阻滞(进入不应期),使得激动传导必须绕至较长的路径才能完成折返。类型2:明确只有一个相同路径的折返环路。其周长交替形成机制为在原存在的线性损伤病变中,存在2个相邻的不同传导速度的缝隙。长周长房速时,激动通过一个缝隙的传导速度慢于短周长房速通过另外一个缝隙的传导速度,通过在两个不同的缝隙处记录到的局部碎裂电位间期的长短可以证实这种折返机制。
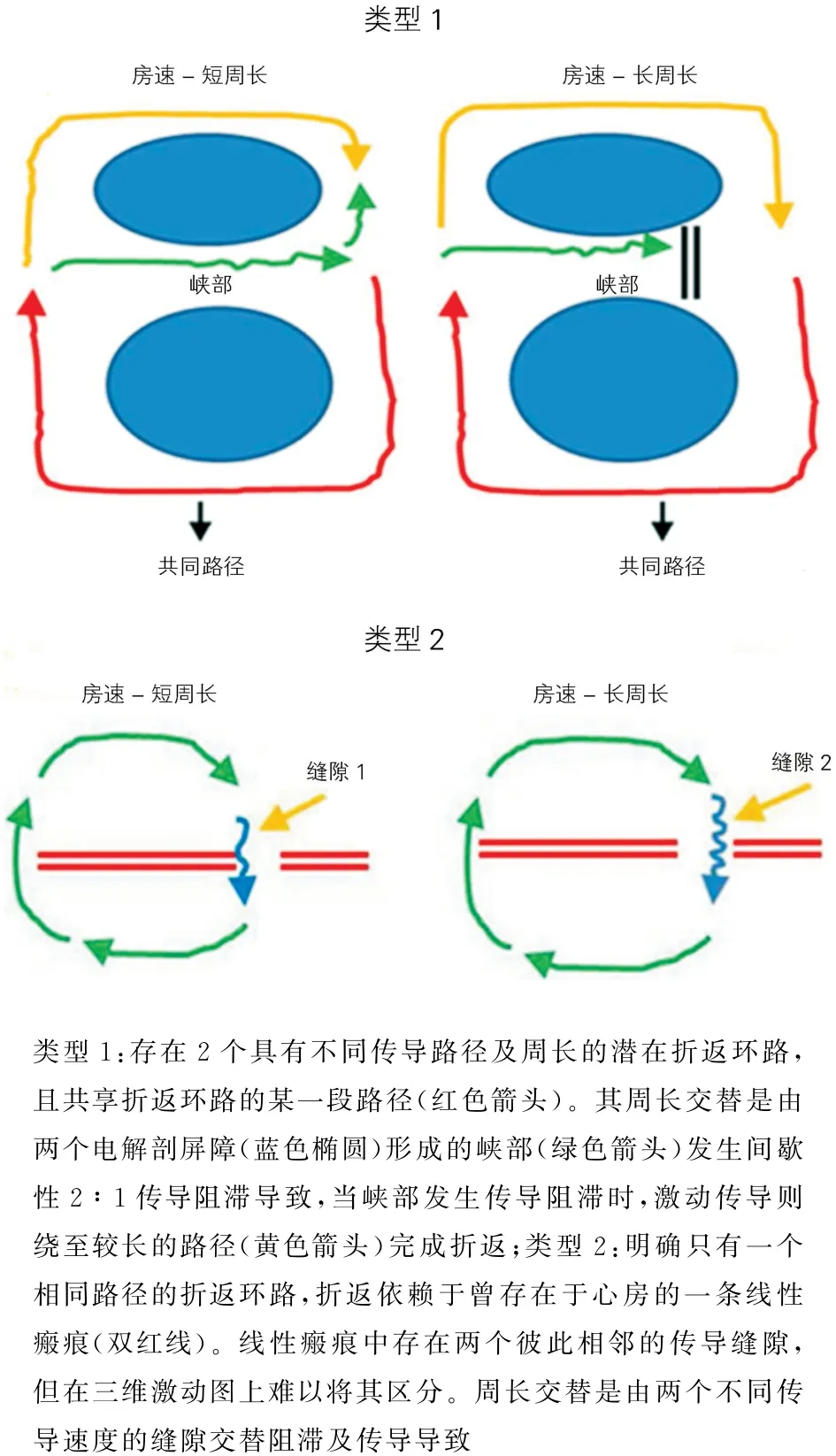
图2 两种长短周长交替变化的房速激动模式简化示意图
3例病例房速特点表现为类型1(1~3例),4例(4~7例)表现为类型2。对于病例1,长短周长房速均围绕右房游离壁的两条外科手术切口瘢痕线之间的通道传导(图3)。在短周长房速的三维激动标测图上,可发现通道刚好处于可激动传导状态,而在长周长房速三维激动标测图上,通道出现功能性传导阻滞,激动需绕更长的路径才能完成折返。病例2为右房心肌病患者,其心房本身存在广泛的瘢痕区域,短周长房速时,激动围绕右房游离壁2个瘢痕之间的通道传导形成折返。长周长房速时,瘢痕之间的通道出现功能传导阻滞,激动转绕三尖瓣环形成一个大折返。病例3其短周长房速是绕左心房后壁两个瘢痕之间的通道的一个小折返,而长周长房速时,原瘢痕之间的通道出现功能传导阻滞,激动必须经过更长的路径才能形成折返。病例4,5,其长短周长房速均为通过原左房顶部线的缝隙产生的顶部依赖的大折返房速。其周长长短交替是由2个缝隙以不同的传导速度交替阻滞和传导所致(图4)。病例6,其长短周长均是通过先前左房消融的前壁线的缝隙产生的大折返。其周长长短交替同样是相邻缝隙以不同的传导速度交替阻滞及传导的结果。病例7,其长短周长均为围绕原二尖瓣峡部线折返。其周长变化可能是不同的激动传导通过不同的残余心外膜连接导致的。

图3 病例1 周长交替房速的高密度标测图
通过回顾分析折返环的通道或缝隙处的局部心腔内电图,发现房速1(类型1)其周长交替时,在其相对应的通道或缝隙处出现局部双电位和单电位的交替。房速2(类型2)其长周长折返环上的通道或缝隙记录到的局部碎裂电位间期时间长于短周长房速时记录到的局部碎裂电位间期[(97.4±12.5)ms vs(62.5±9.4)ms)]。
对于病例1,通过消融封闭2个折返环路的共同通道终止房速。病例2,3,先通过消融封闭短周长折返环的通道,消融过程中将长短交替周长房速转变为固定长周长的房速,然后再消融封闭长周长房速的折返路径的通道终止房速。病例4~7,均通过消融闭合原消融线存在的缝隙终止房扑。所有患者手术结束时均进行诱发,无一例再诱发出房速。随访12.4(6.3~20.6)个月,1例房速复发(14.3%,1/7)。

图4 病例4周长交替房速的高密度标测图
3 讨论
周长交替的房速临床上极其罕见,对于该类型的心动过速,应用传统的三维激动标测可能很难阐明其心动过速机制。Rhythmia三维标测系统提供超高密度激动标测图和高分辨率、高清晰的心内电图。此外,在标测过程中,可以根据标测的目标周长房速调整兴趣窗的设定,从而可分别对长周长及短周长房速进行单独而又精准的激动标测,而不会受到长短周长变化的干扰及影响。
通过对其长短周长三维激动图的分析,笔者将长短周长交替房速的机制分为两类。房速1其存在2个潜在的折返环路,其折返路径不同但又存在一段共同的传导通道。其周长交替是由小折返环的通道发生间歇性2∶1传导阻滞导致的。当小折返环的 通道发生传导阻滞时,激动则转换为围绕折返路径的共同传导通道而产生大的折返环路。激动传导经过较长的路径传导后,原来功能传导阻滞的小折返环的通道传导恢复,从而形成周长较短的折返路径。分别单独对房速1长短周长的三维激动标测图分析其机制是非常有用的。房速2在三维激动标测图中其长短周长交替房速仅有一个共同的折返路径。合理的解释是,在三维激动标测图上,难以区分出两个相邻的传导缝隙。其产生周长交替变化主要是由于两个相邻的不同传导速度的缝隙出现交替阻滞和传导。因此,对于房速2,通过单独标测其不同周长的三维激动图意义不大。发现其机制的唯一线索是在不同周长房速时其对应缝隙处的局部碎裂电位间期时间长短的交替。
通过应用超高密度标测得到的上述结果,笔者发现产生长短周长交替的房速的必要条件是传导的通道或缝隙出现间歇性传导阻滞或激动传导缓慢。在笔者报道的病例中,其均伴有不同原因的严重心房瘢痕(既往心脏手术、心房颤动导管消融术或纤维性心房心肌病)。心脏组织中的电激动传导主要是由缝隙连接导致的。而严重瘢痕的心房心肌可导致心肌细胞间电连接减少和组织弱耦合,这可能是导致对周长变化敏感的不稳定的传导特性。长周长时,因为其传导路径较长或传导缓慢,而导致原传导阻滞的通道恢复传导,从而创造短周长房速产生的条件。但刚好稳定和恰好完美的传导恢复时间是极其难以匹配的,这可解释临床上长短周长交替的房速是极其罕见的。
房速1可在折返路径的固定部位出现与周长交替相对应的局部双电位及单电位。房速2的折返路径的传导缝隙处,长周长房速在该部位记录到的局部心腔内电位间期长于短周长房速时。这是识别该类房速这一特殊机制的独特线索。
在本研究病例报道中,因为研究病例心动过速周长不断交替变化,因此对于该系列病例笔者术中行电生理检查时并未对所有房速进行拖带标测。应用拖带标测理解周长交替变化的折返性心动过速,要求对拖带的所有测量标准能够熟练应用理解。拖带后其起搏后间期与周长交替的心动过速的其中的一个原始周长(通常为短周长)一致,且经过多次拖带重复性良好,则支持心动过速为折返机制。John等[7]认为起搏学对于证实房速机制具有重要意义,甚至是对于周长交替变化的房速。其认为将刺激信号至心内心房波(A 波)的间期(S-A)与局部心腔内电图与A 波间期(E-A)进行比较是另一种有效的方法。心动过速时,如果一个单一的额外刺激后出现心房融合波或夺获心房,则可证实起搏导管已经接近心动过速的折返环路。在未来的研究中,我们将尝试证实单一额外刺激导致心动过速重整这一方法在验证三维激动标测结果中的价值。
