His束起搏患者的选择和植入技巧*
2020-10-31陈骁蒋丽梦苏蓝
陈骁 蒋丽梦 苏蓝
His束起搏(His-bundle pacing,HBP)能通过激动His束-浦肯野系统产生最接近生理的心脏传导,自2000 年Deshmukh等[1]报道HBP 起搏以来,该项技术在全球引起了广泛关注,但由于对植入技术要求高及受植入器械的限制,在早年HBP存在成功率低、起搏阈值高等缺陷,限制了在临床的推广和广泛应用。随着近几年的临床实践,HBP植入成功率有了明显提高,2018 年的Meta分析[2]结果示,HBP平均植入成功率84.8%,应用3830 导线(Select SecureTM,Medtronic Inc.,Minneapolis,MN,USA)成功率提高至92.1%,急性期平均夺获阈值1.71 V/0.5 ms,随访3个月为1.79 V/0.5 ms。HBP的临床运用从早期的心房颤动(atrial fibrillation,AF)伴房室传导阻滞,到完全性左束支传导阻滞(complete left bundle branch block,CLBBB)伴心力衰竭(heart failure,HF)、起搏介导心肌病和传统心脏再同步化治疗(cardiac resynchronization therapy,CRT)术后无反应升级等人群。作为心脏同步化治疗的新方法,HBP 在改善生活质量、射血分数的获益与传统双室起搏治疗效果相似[3]。
1 HBP的历史概述及适应证
1969年,Scherlag等[4]首次通过静脉导管记录到His电位。
1970年,Narula等[5]首次在人体实现用多极导管在三尖瓣隔膜瓣房室交界区行临时性HBP。
2000年,Deshmukh等[1]首次发表对慢性AF 伴HF 者行房室结消融后行永久HBP。
2015年,Lustgarten等[6]研究显示HBP纠正CLBBB和传统CRT 治疗相比,生活质量、左室射血分数(LVEF)获益相似。
2017年,Huang等[7]对AF 伴HF 患者行HBP 及房室结消融,发现其能降低住院率,改善心功能;首例永久左束支起搏(left bundle branch pacing,LBBP)报道[8]。
2018年,Abdelrahman等[9]前瞻对照研究显示HBP在总死亡率、HF住院率及升级起搏器的首要临床终点均显著低于右室起搏;《永久希氏束起搏国际专家合作组共识》发布[10]。
2019年,HBP纠正真性CLBBB伴HF患者长期随访的研究,明显改善心功能[14]。
基于HBP的临床观察及共识,下列指南中明确了HBP的适应证:
(1)《2018 ACC/AHA/HRS心动过缓和心脏传导延迟患者评估和管理指南》[11]:①LVEF 0.35~0.50的房室传导阻滞患者,心室起搏比例>40%,CRT 或HBP 优于右室起搏(Ⅱa类推荐);②如阻滞部位在房室结,HBP 可保持心室生理激动(Ⅱb类推荐)。
(2)《2018中国心力衰竭诊断和治疗指南》[12]:HBP 适合①左室导线植入失败;②CRT 术后无应答;③药物控制心室率不理想的AF 伴HF,且经导管消融失败或不适合AF消融,需要房室结消融控制心室率;④慢性AF 伴HF,需要高比例心室起搏(>40%)。
(3)《2019 ESC室上性心动过速管理指南》[13]:心动过速参与的心动过速性心肌病首先考虑消融治疗,消融不成功或药物不能控制,建议房室结消融后CRT或HBP(Ⅰc类推荐)。
2 永久HBP植入技术
相比较近期原创LBBP技术,HBP植入方法较难掌握,学习曲线长,成功率和远期参数受到植入者经验影响较大。2020年发表的综述比较了二者优劣[15],认为HBP保持了正常的心脏传导具有一定优势,包括电轴和宽度,不存在LBBP带来的不完全性右束支传导阻滞,导线头端不跨三尖瓣等。作为传导束起搏的主要方式,二者相互补充,并不能完全相互替代。通过技术和器械不断改进,可大幅度改进阈值参数和提高HBP的成功率。术者只有熟练掌握两种技术,根据疾病特点和传导束病变选择适当方式,才能同时兼顾生理性起搏的有效性和长期安全性。笔者总结了本中心10年的植入经验,介绍HBP植入常规操作和进阶技巧,为术者在临床实战中提供参考。
2.1 器械和植入工具 目前常规使用3830导线配合C315 His/C304递送鞘(Medtronic Inc.,Minneapolis,MN,USA)行HBP,有术者尝试采用普通主动电极进行操作,但难度高,成功率低。专为HBP设计的可调弯C304-HIS递送鞘目前在国外已经上市,但尚未进入国内市场。另外,Boston Scientific INGEVITY lead导线配合SSPC 鞘,和2020年上市的Biotronik Solia导线配合Selectra 3D 鞘管等,也为术者行HBP提供了更多的器械选择。对于大右房或三尖瓣返流患者,可以利用现有左室导线递送鞘(如Extended Hook 6250)配合C315 His,采用鞘中鞘技术提高支撑力协助电极到位。目前尚无适用于希浦系统起搏的专用起搏器,在目前CRT/D装置中将HBP导线连接左室插孔,可以避免HBP的感知低下和感知过度等问题,也可避免非专用脉冲发生器的房室逻辑算法产生冲突,这为将来的专用起搏器设计提供了设计思路。
2.2 His束的定位及标测 His束穿中央纤维体走行在三尖瓣环室间隔膜部下方,影像定位是常用方法。在透视下结合三尖瓣环影像可进行His束解剖定位,亦有术者尝试通过电生理三维标测系统、腔内超声等工具协助定位。Gu等[16]报道三尖瓣环造影方法指导His束远端起搏,以及“九分区法”帮助希浦系统起搏定位[17-18]。
常规推荐术中使用多导电生理仪进行完整数据记录,在没有多导等工具时也可用心电监护仪和程控分析仪记录体表和腔内心电记录电位信号。
术中结合电位标测和起搏标测精确定位His束,电位标测方法如下:①直接标测:多数病例可直接用3830电极在房室交界区标测,标测时3830电极头端需露出鞘口,环端尽量保持在鞘管内。该方法优点是免除了股静脉穿刺,减少了手术步骤和耗材。②对于初学者或遇到定位困难时,可经股静脉入路用标测电极预先标测His束电位,评估His束位置,在心脏解剖变异情况下提高His束定位的成功率。
起搏标测:起搏标测比电位标测更加精细,在电位标测无法定位His束时,以高输出且大于自身频率20 次/分起搏,根据起搏心电图判断是否夺获His束,达到快速定位的目的,并完成夺获阈值的初步测定(图1)。
双导管精确定位法:该方法适用于His束固定后参数不满意需进一步精细调整或对参数要求高的特殊病例,如HBP消除束支传导阻滞和房室结消融后起搏患者等。操作时若第一根3830电极固定后阈值不佳,则将其保留作为标记,用第二根电极在附近寻找更佳位置。其优势是交替寻找到更好的His束起搏位点,获得满意参数;两根递送鞘也可做相互支撑,增加固定时鞘的稳定性(图1)。
2.3 导线固定方法 透视下或通过其他辅助手段定位His束并不困难,但由于His束穿过中心纤维体,组织致密导致导线难以深拧。为加强支持力,可适当调整鞘的角度,将鞘后坐在房侧以提供支撑;也可加用左室外膜导线递送鞘,采用“鞘中鞘”技术来完成。在固定电极时,注意保持递送鞘方向垂直于间隔,仅电极头端出鞘更便于固定。固定前可先尝试向前轻推导线,观察其是否接触间隔。操作时轻微逆时针旋转鞘管,使其保持垂直间隔,顺时针匀速旋转导线尾部,同时在透视下观察电极头端是否同步转动有效拧入。
2.4 参数测试内容及方法 参数检测内容包括①单、双极的导线感知、阈值、阻抗;②HBP 电极以下心室传导是否正常:以稍高于阈值输出,频率大于130 次/分起搏,表现为1∶1 H-V 传导。测试阈值时注意起搏频率的影响,高频率起搏时可能伴随阈值升高。
2.5 撤鞘 撤鞘前注意排除导线互相缠绕,然后缓慢后撤递送鞘至心房侧,全过程在透视下进行,同时调整导线至适当张力,撤鞘后需复查起搏参数。
3 技术难点和关键问题
HBP技术关键问题是固定问题,电极固定的准度和深度决定了HBP参数可靠性和远期稳定性,但His束位于中心纤维体附近,欲获得深部固定较为困难。笔者就如何判断起搏位点是否跨越传导束阻滞部位,电极固定良好的判断等问题进行归纳总结。
3.1 跨越病变的传导束起搏位点 HBP 纠正左束支传导阻滞(left bundle branch block,LBBB)的早期研究显示,纠正阈值高且术后有逐渐升高趋势,所以对于需心室起搏患者,His束电极是否跨越阻滞部位是保证远期安全性的关键问题。是否跨越传导束阻滞部位有以下表现:①以稍高于His束夺获阈值为输出电压,以140次/分以上有效起搏His束,保持His束至心室1∶1传导无脱落;②需纠正束支传导阻滞患者中,表现为低输出即可夺获传导束,并同时纠正束支阻滞;如需稍微升高输出即可纠正阻滞,提示电极靠近阻滞部位,此位点也可接受。在HBP 未能跨越病变时,远端的HBP或LBBP可作为有效替代方法,能避免病变进展所导致的远期阈值升高或电极失用。
3.2 电极固定良好的判断 HBP 电极固定的判断方法:①起搏单极阻抗随电极进入间隔深度而增加,通常超过400 Ω;②电极在三尖瓣下固定深度可达6 mm 以上,判断头端进入间隔深度的方法包括在左前斜位鞘内注射造影剂,行腔内超声或经胸心脏超声检查等;③回弹实验和张力测试:电极固定完成后,如再顺时针旋转导线尾端一圈,将逆时针回弹一圈;退鞘至心房,不同张力下阈值无明显升高提示固定良好,如出现阈值异常波动建议重新固定。
3.3 心室备用起搏的选择 HBP 起搏位点在房室交界区,存在感知低下和传导束起搏阈值偏高等缺陷,同时远期局部组织纤维化和自身传导束病变进展可导致阈值逐渐升高,以上均会造成对传导束的失夺获。HBP是否需要增加心室备用起搏导线,需综合考虑以下内容:①评估是否心室起搏依赖;②夺获电极周围心肌可保障局部心肌夺获,尽量做到低阈值非选择性HBP可作为自身备用起搏;③若心肌夺获阈值偏高,可改为远端HBP 或LBBP。④如选择增加心室备用导线,术者需谨慎评估风险/获益比,充分考虑因增加导线带来的额外风险和经济支出等问题。
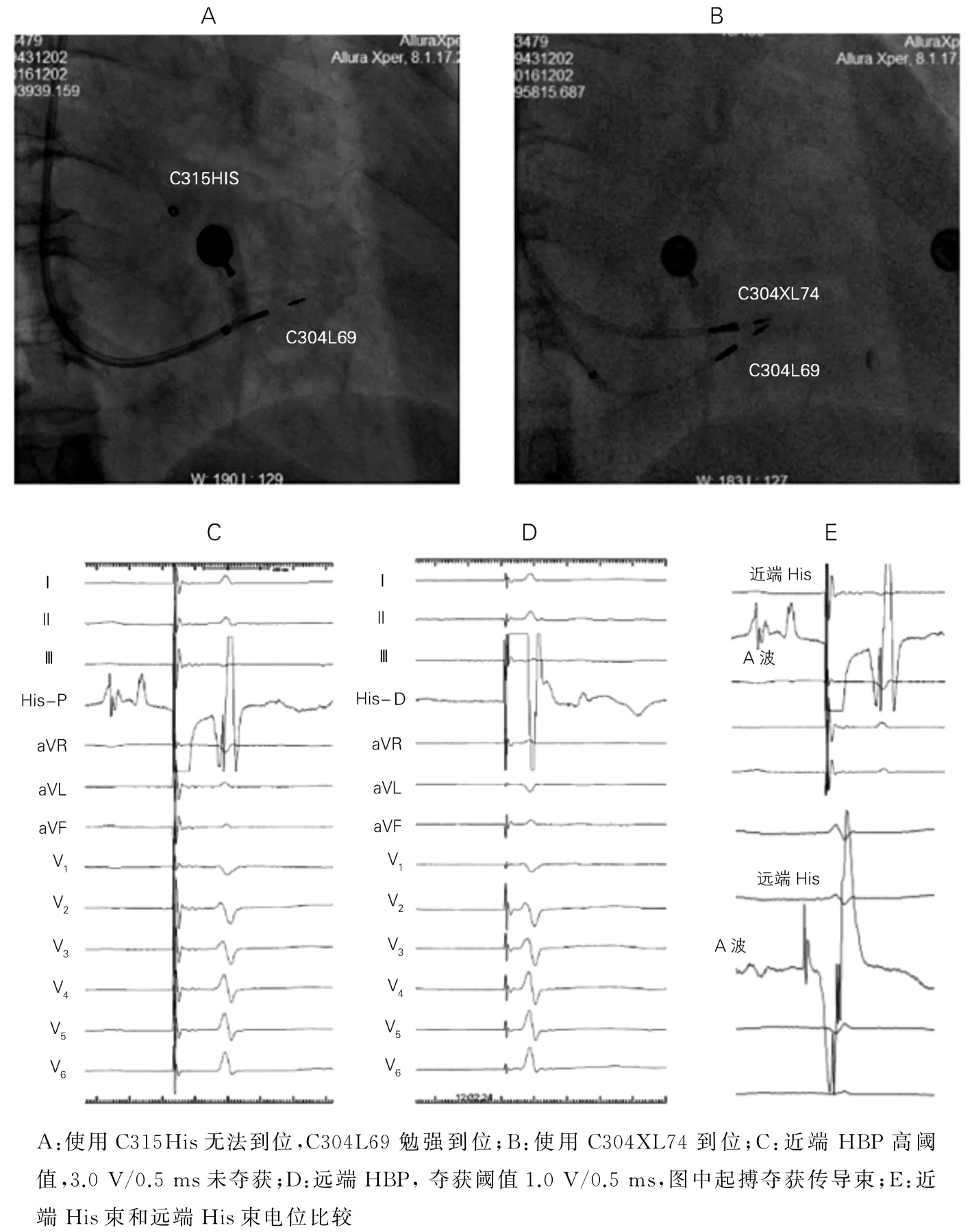
图1 双导管法C304 74 cm 长鞘定位His束
3.4 避免右束支损伤 His束起搏操作过程中可能会出现传导束的损伤,一项纳入358例HBP患者的临床研究显示,最常见的阻滞类型为右束支传导阻滞(5.9%),部分患者出现房室传导阻滞(1.1%)或左束支阻滞(0.8%)[19],多数右束支损伤呈一过性,后期可恢复。通常电极在跨瓣后到室侧定位过程中更容易损伤右束支,故导管在瓣下位置操作时需要注意以下细节:①如腔内图标记到电位,电位到V 波的间期短于40 ms,需考虑右束支电位可能;②起搏时改变输出出现选择性LBBB形态或非选择性LBBB图形;③无论在电极或者递送鞘操作过程中,若已造成右束支损伤,建议立即避开该部位重新定位以免造成永久性右束支损伤。
4 挑战性的HBP
临床实践中除常规操作外,术者亦需在特殊条件下行起搏器植入,包括巨大右房、重度三尖瓣返流、右侧入路等,而手术器械的限制增加了操作难度,影响植入成功率。
4.1 巨大右房和重度三尖瓣返流 肥厚型心肌病、心脏瓣膜病、右房增大明显的患者中行HBP 时,常规使用的C315His鞘因长度有限并缺少足够的支撑,如伴有三尖瓣重度返流将影响电极定位和固定。可选用C304 74 cm 长鞘(图2),也可采用左室电极递送鞘(如Extended Hook 6250)为C315His的外鞘的“鞘中鞘”方式提供足够的支撑(图2A)。
4.2 右侧植入His束电极 临床中左侧静脉路径闭塞、永存左上腔、左侧长期血透管或造瘘、升级时原右侧囊袋的患者,需经右侧入路操作完成植入。此类患者植入难点在于目前无专用右侧递送鞘,C304和C315His等鞘管均为左侧植入所设计,从右侧锁骨下静脉进入上腔静脉时呈大角度的反S弯,路径扭曲容易折鞘,可将C315His输送鞘进行适当塑型后操作(图2B)。术中者应注意以下细节:①提前以7F外鞘保护;②递送鞘进入上腔静脉后,在左前斜位透视下调整鞘口至间隔方向,同时注意避免暴力操作引起心脏穿孔;③操作导丝至右室流出道,后将递送鞘沿导丝送至三尖瓣环处;④固定后完成参数测定立即撤鞘至右房顶部,并调整导线张力防止电极脱位。
4.3 非3830导线如何HBP 使用普通主动导线行HBP植入成功率低,2000 年Deshmukh 的研究中显示普通主动电极的成功率仅50%左右。如选择普通电极时应注意电极的固定螺旋须为可导电螺旋,植入方法:将导丝塑形为双弯鹅颈形态或可借助左室导线递送鞘;植入时预先将电极螺旋部分拧出,His束定位成功后再将螺旋完全拧出,使头端螺旋进一步深扎固定(图3)。

图2 C315His输送鞘的特殊使用技巧
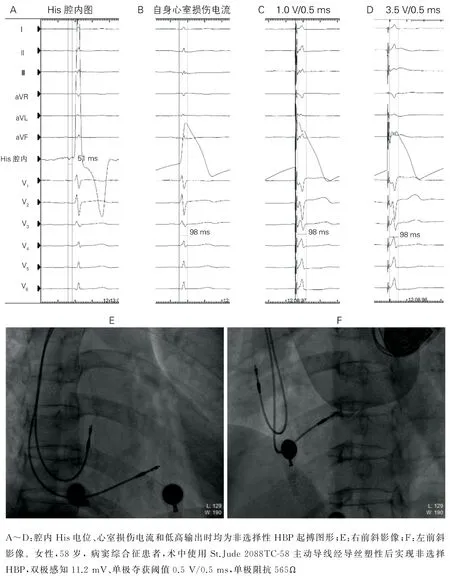
图3 使用主动电极的HBP
5 总结
许多临床研究已证实希浦系统起搏的有效性和安全性,但与传统的右室电极植入相比,希浦系统起搏电极植入过程更为复杂,对术者也提出了更高的要求。目前HBP 存在感知低下和交叉感知,阈值偏高等缺陷;不适用于阻滞点位于His束以下的患者;当自身传导系统病变进展至起搏位点以下导致电极失夺获等,更为精确的His束远端起搏和更远端LBBP技术能有效克服以上缺陷。目前LBBP 技术方兴未艾,但HBP仍为最生理的起搏方式,充分了解传导束不同起搏部位的优缺点和植入方法,可以帮助医师在面对各种临床起搏需求时,提高手术安全性和成功率。总结本中心HBP的植入经验和技巧,包括“4D 技术”——双电极(Double leads)、更远(Distal)、更深(Deep)以及更高要求(Demand),为实现既生理又安全的传导束起搏提供了参考。目前技术的进展已领先于器械的更新,今后随着器械和工具的改进将为术者提供更多选择,为更多的患者提供最佳的治疗方法。
