外源甜菜碱调节西瓜细胞渗透胁迫研究
2020-10-29王世豪朱芳铭孙梦利徐子健江雪飞乔飞
王世豪 朱芳铭 孙梦利 徐子健 江雪飞 乔飞
摘 要:为探究外源甜菜碱对渗透胁迫下西瓜细胞生长的影响,以二倍体西瓜悬浮细胞为试验材料,利用甘露醇(Mannitol)模拟渗透胁迫,同时外源施用甜菜碱,通过测定细胞鲜重、细胞体积、细胞内活性氧(ROS)和细胞外pH,明确甜菜碱与西瓜渗透胁迫抗性的相关性。结果表明:渗透胁迫下西瓜细胞鲜重以及细胞生长量受到抑制,并且渗透胁迫可以诱导西瓜细胞外碱化、细胞活性氧迸发;外源甜菜碱可以一定程度上缓解渗透胁迫对西瓜悬浮培养细胞生长量的抑制作用,调节细胞pH以及细胞ROS的水平。总之,渗透胁迫下,外源甜菜碱可以维持西瓜细胞生长,并具有调节抗性反应的作用。
关键词:西瓜;渗透胁迫;甜菜碱;细胞外pH;活性氧
中图分类号:S651 文献标识码:A
Abstract: In order to explore the influence of exogenous glycine betaine on watermelon cell growth under osmotic stress and determine the correlation between the glycine betaine and the watermelons osmotic stress resistance, measurement of fresh cell weight, cell volume, intracellular reactive oxygen species (ROS) and extracellular pH was performed with the suspension cultured cells of diploid watermelon as the experimental materials, the mannitol simulating the osmotic stress and the exogenous glycine betaine being applied simultaneously. Under osmotic stress, the fresh weight and growth weight of watermelon cells were both inhibited, and extracellular alkalization and burst of intracellular ROS were also induced. The exogenous glycine betaine was found to be able to alleviate the inhibition effect of osmotic stress on the growth weight of the suspension cultured cells of watermelon to a certain degree, and be of regulative effect on extracellular pH and intracellular ROS level. In a word, the exogenous glycine betaine could maintain the watermelon cell growth and regulate the resistant reaction under osmotic stress.
Keywords: watermelon; osmotic stress; betaine; extracellular pH; ROS
DOI: 10.3969/j.issn.1000-2561.2020.09.014
植物在生长发育过程中会遭受多种逆境环境的影响,其中渗透胁迫是植物生长发育过程中要面对的最主要的环境问题之一[1]。植物生长常见的三大非生物胁迫因素:干旱、盐碱和低温,均可对植物造成渗透胁迫[2]。渗透胁迫可以改变植物细胞渗透势,使植物水分缺失,也有报道表明,渗透胁迫会抑制植物的生长[3]。Lei等[4]研究发现,小麦在渗透胁迫影响下,其幼苗的相对水分含量降低,幼苗生长受到抑制;Aydi等[5]利用渗透胁迫处理菜豆可以抑制其叶片物质的积累,导致叶绿素成分遭到破坏,同时光合作用效率下降;另有研究表明,植物自身的调节作用可以缓解轻度胁迫对光合速率的影响,但在中度和重度胁迫条件下,植物的光合作用还是会明显降低[6]。此外,渗透胁迫还会导致烟草叶片原生质体核酸和蛋白质的合成减少[7]。目前,有研究表明,渗透胁迫下西瓜细胞生长量受到抑制,细胞活性氧迸发,细胞外pH升高,细胞微管骨架遭受破坏。
植物在渗透胁迫下往往会形成相应的生理响应机制,即在渗透胁迫下,植物为适应渗透胁迫环境,植物细胞会积累渗透调节物质来维持植物体内的水分平衡,降低细胞液的渗透势,从而使水分顺利地进入植物体内,保证了植物生理活动的进行[8]。甜菜碱(Betaine)就是植物重要的渗透调节物质之一。甜菜碱是一种广泛存在于微生物、动物和植物中的可溶性季铵类化合物[9],其作为一种渗透调节物质,因可溶性高、不具有任何毒性以及生理pH条件下不带净电荷而被认为是现已发现的最好的渗透调节物质之一[10]。此外,甜菜碱还有非常重要的非渗透调节功能。如高盐胁迫下甜菜碱可以保护光系统PSⅡ的放氧活性[11];甜菜碱可以维持逆境胁迫下Rubisco蛋白的活性[12];外源施加甜菜碱可以保护细胞质膜的稳定性和完整性[13]。目前已在白菜[14]、水稻[15]、小麥[16]、烟草[17]等植物中得到了验证,主要体现在抗盐胁迫、干旱、低温[18]以及高温胁迫等方面。
已有研究表明,作为植物重要的渗透调节物质的海藻糖,具有调节西瓜细胞渗透胁迫,维持细胞生长、保护亚细胞结构并调节抗性反应的功能。甜菜碱同样也作为植物重要的渗透调节物质,外源添加甜菜碱能够对植物产生保护作用,增强抗逆能力[19],但多体现在植株方面,目前在细胞水平上探究外源性甜菜碱参与渗透胁迫的作用机理尚不清楚。据此,本研究利用西瓜二倍体悬浮细胞作为试验材料,通过测定甘露醇处理后西瓜细胞外溶液pH和细胞内ROS含量,以及细胞鲜重和细胞生长量,初步了解渗透胁迫对西瓜细胞的影响,此外,对渗透胁迫下的西瓜细胞施加外源甜菜碱,观察甜菜碱对细胞生长状态的影响,为后期进一步研究甜菜碱对渗透胁迫下西瓜细胞的保护作用机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 材料 试验材料选用二倍体西瓜“FR- 32-1B-2n”的悬浮细胞,细胞系通过诱导西瓜叶片愈伤组织建立,继代周期为7 d。
1.1.2 试剂及配制 甘露醇(Sigma-Aldrich):配制1 mol/L甘露醇,称取甘露醇粉末18.217 g,用100 mL MS培养基溶解,121 ℃灭菌30 min,分装4 ℃贮存;甜菜碱(Sigma-Aldrich):配制100 mmol/L甜菜碱,称取甜菜碱粉末1.1715 g溶解于100 mL超纯水中,0.22 μm无菌过滤,分装4 ℃贮存;DHR123(Sigma-Aldrich):配制5 mg/mL DHR123,称取DHR123用DMSO溶解至5 mg/mL,20 ℃贮藏备用;MS培养基:称取MS培养基粉末4.43 g,加入1 L超纯水,pH调节至5.8。
1.1.3 实验仪器 摇床(Kuhner Shaker)、荧光显微镜(Axio Imager M2, Zeiss)、pH检测仪(Mettler toledo)、电子天平(Mettler toledo)、高速冷冻离心机(Thermo Heraeus MultifugeX1R)。
1.2 方法
1.2.1 悬浮细胞生长量测定 悬浮细胞生长量的测定参照文献[20]的方法,具体方法如下:继代15 mL西瓜悬浮细胞于三角瓶中,分别以300 mmol/L甘露醇(注:选取300 mmol/L甘露醇方便比较显著性差异)、10 mmol/L甜菜碱+300 mmol/L甘露醇处理,而对照组使用相同体积MS培养液处理,将全部处理组细胞放置于25 ℃摇床150 r/min进行培养,7 d后将悬浮细胞及培养液一同倒入25 mL量筒中,保鲜膜封口,于4 ℃下静置一昼夜,记录总体积VT和沉淀细胞体积VC,用VC/VT表示△PCV(packed cell volume),将对照组生长量定为100%。结果取3次重复的平均值。
1.2.2 悬浮细胞活性氧(ROS)测定 细胞内活性氧(ROS)含量的测定参照文献[21]的方法,具体操作如下:取200 μL处于指数分裂期(继代3~4 d后)的西瓜悬浮细胞放入自制染色室中,吸干培养液,用1 mL MS培养液重悬细胞;避光情况下,置于25 ℃摇床稳定细胞1 h,加入DHR123至终浓度10 μmol/L。避光情况下,25 ℃摇床孵育细胞30 min或在常温下孵育4 h,用MS培养液洗涤孵育细胞3次。分别用CK、100 mmol/L甘露醇和10 mmol/L甜菜碱(预处理12 h)+100 mmol/L甘露醇处理细胞20 min,使用Ziess Imager Z2荧光显微镜观察并拍摄不同时间点荧光信号强度,通过Image J(http://rsbweb.nih. gov/ij/)軟件测定ROS荧光强度,计算单位面积荧光强度与整体荧光强度的比值,得到ROS相对荧光强度。
1.2.3 悬浮细胞外pH测定 悬浮细胞外pH的测定参照文献[22]的方法,取2 mL处于指数分裂期(继代3~4 d后)的西瓜悬浮细胞放置在摇床上稳定30~60 min,待悬浮细胞液pH稳定后用超纯水孵育细胞30 min,分别设对照组(CK)、100 mmol/L甘露醇和10 mmol/L甜菜碱+ 100 mmol/L甘露醇3个处理处理细胞。使用pH计(Mettler toledo,pH 12)测定和记录,计算pH的相对变化量(△pH)。
1.2.4 悬浮细胞鲜重测定 悬浮细胞鲜重的测定参照文献[23]的方法,继代20 mL西瓜悬浮细胞于三角瓶中,以100 mmol/L甘露醇处理,对照组加入相同体积MS培养液处理,将全部处理组细胞放置于25 ℃摇床150 r/min进行培养,每天吸取1.5 mL西瓜悬浮细胞置于2 mL离心管中,使用离心机12 000 r/min离心20 min,弃上清液,称重并记录,连续进行7 d。实验设3次重复。
2 结果与分析
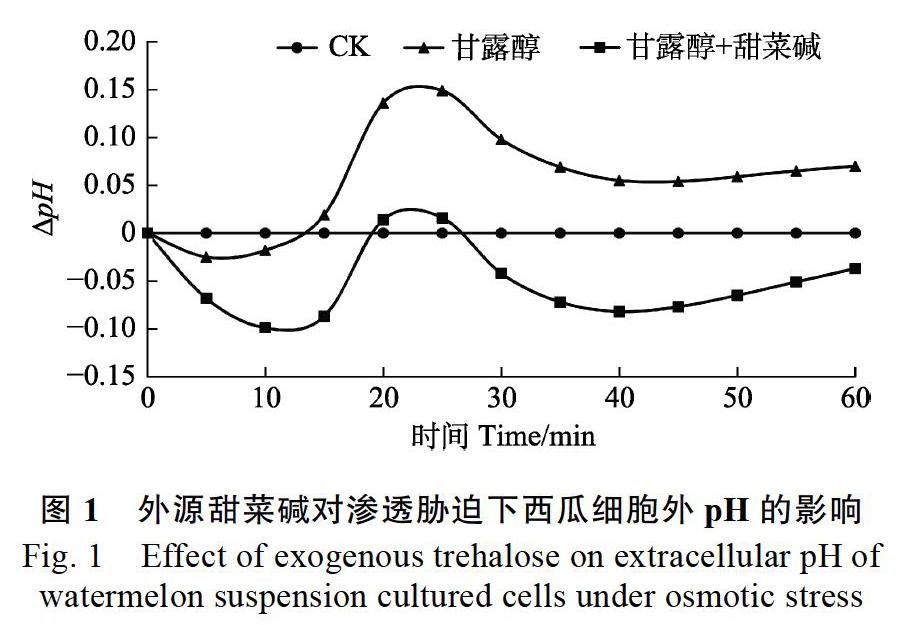
2.1 外源甜菜碱对渗透胁迫下西瓜细胞外pH的影响
为研究外源甜菜碱对渗透胁迫下西瓜细胞外pH的影响,选取处于指数分裂期(继代3~4 d后)的细胞,测定不同处理下西瓜细胞外pH的变化情况,结果发现:与对照组及10 mmol/L甜菜碱+100 mmol/L甘露醇处理组相比,100 mmol/L甘露醇处理后的细胞外pH整体呈上升趋势,并且发现细胞外pH在甘露醇诱导后15 min左右开始迅速升高,在处理后25 min达到最大,比对照组高0.149,比10 mmol/L甜菜碱+100 mmol/L甘露醇处理组高0.133。此后呈现出下降趋势,但甘露醇处理组培养液pH依然高于另外两组。研究表明:渗透胁迫可以导致细胞外培养液pH的升高,发生细胞外碱化(即细胞质酸化);外源甜菜碱参与细胞外碱化调节,缓解渗透胁迫下细胞外pH的升高。
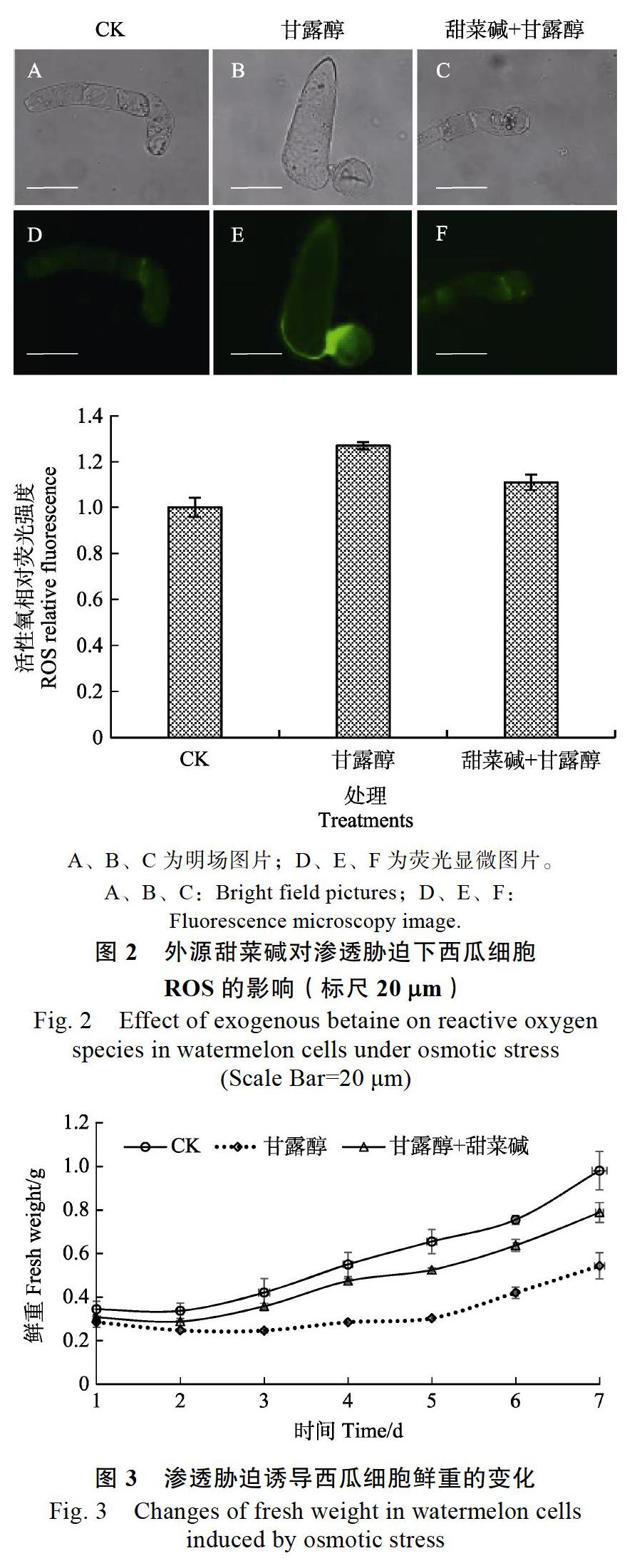
2.2 外源甜菜碱对渗透胁迫下西瓜细胞ROS的影响
为确定外源甜菜碱对渗透胁迫下西瓜细胞ROS的影响,结合ROS荧光染料进行测定,计算ROS相对荧光强度。本研究首先从渗透胁迫对细胞内ROS的含量变化进行探究,结果发现(图2):经过100 mmol/L甘露醇处理西瓜细胞20 min后,西瓜细胞内的ROS相对荧光强度明显高于对照组及10 mmol/L甜菜碱+100 mmol/L甘露醇处理组,约为空白对照的1.27倍,10 mmol/L甜菜碱+100 mmol/L甘露醇处理组的1.14倍,说明渗透胁迫可以诱导西瓜细胞活性氧积累,含量增多;添加外源甜菜碱可以缓解渗透胁迫对西瓜细胞ROS的诱导作用。
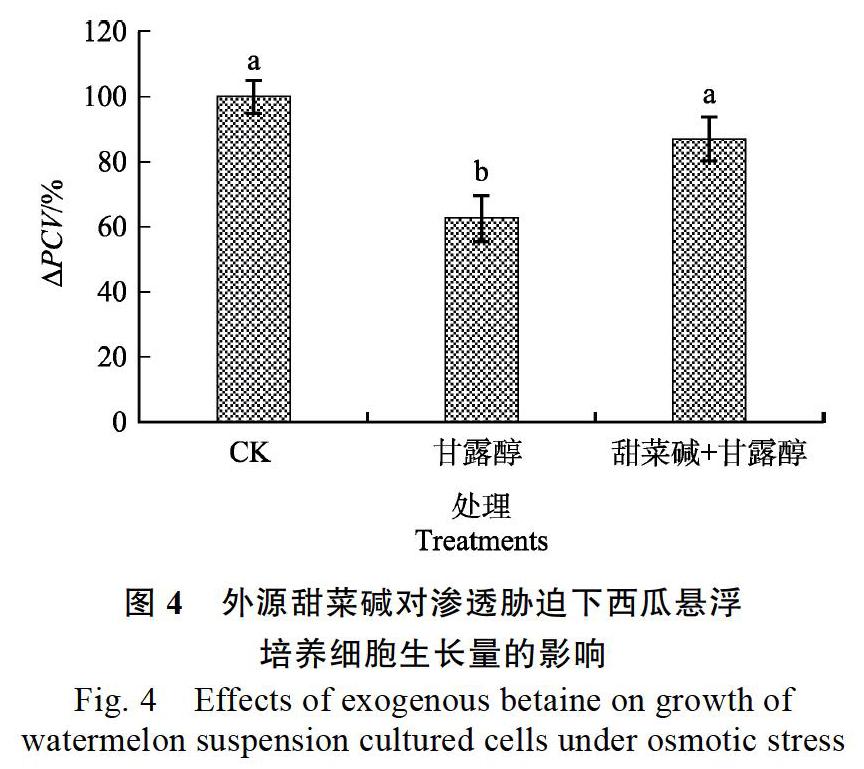
2.3 渗透胁迫对细胞鲜重的影响
利用100 mmol/L甘露醇模拟渗透胁迫,对继代细胞进行处理,每天相同时间点测定细胞的鲜重,结果发现(图3):细胞鲜重总体呈上升趋势,与对照组及10 mmol/L甜菜碱+100 mmol/L甘露醇处理组相比,虽然100 mmol/L甘露醇处理组细胞鲜重没有较大变化,但整体水平明显低于对照组与10 mmol/L甜菜碱+100 mmol/L甘露醇处理组,在第7天与对照组差距最大,甘露醇胁迫组细胞鲜重比对照组少0.4371 g,说明甘露醇模拟的渗透胁迫对细胞的生长有抑制作用;外源甜菜碱可缓解渗透胁迫对西瓜细胞生长的抑制作用。
2.4 渗透胁迫对细胞体积的影响及甜菜碱的缓解作用
为探究渗透胁迫对细胞生长的影响,以及甜菜碱对胁迫下细胞的保护机制,通过△PCV半定量测定悬浮细胞体积。结果发现(图4):与对照组及甜菜碱+甘露醇处理组相比,300 mmol/L甘露醇处理西瓜细胞7 d后,西瓜悬浮细胞体积分别下降了37.45%,24.47%,细胞体积差异显著(P<0.05);此外,对照组与甜菜碱+甘露醇处理组细胞体积无显著差异。同时,图3与图4结果趋势相一致。说明渗透胁迫对西瓜细胞的生长有抑制作用,外源甜菜碱对渗透胁迫下西瓜悬浮培养细胞的生长量有较为明显的缓解作用。
3 讨论
本研究利用西瓜悬浮细胞作为试验材料,通过测定甘露醇条件下培养液pH的变化规律以及细胞内活性氧含量变化,得到渗透胁迫对细胞外pH以及细胞ROS的影响。结果发现,在渗透胁迫下,细胞培养液的pH在处理后15 min左右迅速升高,并在处理后25 min左右达到最大值。有研究表明,造成细胞外pH升高的原因是由于H+的内流和离子交换等造成[24],是细胞生理生化反应的调控过程。多种逆境胁迫都会引起H+流向发生变化,从而引起细胞pH的改变,进一步调控植物进行抗逆性应答反应[25]。细胞外碱化被认为是响应外界刺激的重要步骤,而伴随有细胞质酸化的培养基碱化是植物细胞感受外界刺激的早期反应[26];植物遭受胁迫后,不仅可以诱导细胞外碱化(细胞质酸化),还对细胞内ROS积累有显著影响[27]。经过甘露醇胁迫处理西瓜细胞20 min后,西瓜细胞内的ROS相对荧光强度明显高于对照组,说明渗透胁迫诱导西瓜悬浮细胞系培养基碱化,细胞ROS迸发。ROS在植物中的大量积累主要是由于植物受到逆境胁迫所产生[28],有关ROS参与植物抗病方面的研究已经十分深入,但其实ROS在非生物胁迫下同样发挥着重要的调控作用。在正常的植物细胞中ROS可以作为胞内信号分子,调节多种生理生化反应,当植物受到逆境胁迫时细胞内的ROS含量会迅速上升,这种现象被称为“氧化迸发”[29],然而,ROS的过量积累会对植株造成不同程度的伤害,限制植物体的光合作用,导致大分子物质的结构性死亡[30],甚至引起植株的死亡。ROS参与植物非生物胁迫反应,如盐胁迫处理下番茄幼苗H2O2含量升高[31]、盐及低温胁迫会导致油菜H2O2含量升高[32]。而H2O2是ROS的一种重要表现形式。将pH的变化作为早期信号进行植物抗渗透胁迫的响应。加强对细胞pH的调控,可以在一定程度上提高植物的抗逆性。
植物细胞的生长主要包括细胞体积的变大和细胞数量的增加,从细胞鲜重以及细胞生长量两个方面可以体现出细胞数量的变化。从上述研究中我们发现,用100 mmol/L甘露醇模拟渗透胁迫处理西瓜悬浮细胞后,细胞生长量下降了11.21%;用100 mmol/L甘露醇模拟渗透胁迫处理西瓜悬浮细胞后,虽然100 mmol/L甘露醇处理组细胞鲜重的变化趋势没有较大变化,但整体水平明显低于对照组,呈现降低状态,可见渗透胁迫对西瓜细胞的生长具有抑制作用。
甜菜碱是植物体内一种重要的渗透调节物质,已经有大量的研究表明通过外源施加甜菜碱可以提高植物的抗逆性,对植物生长和作物产量都有积极的影响。外源施加甜菜碱可以使水分胁迫下小麦体内束缚水含量增加,抗旱性增强,从而有利于干物质量积累[33]。楊淑英等[34]认为,外源甜菜碱在干旱下可以提高光合速率、胞间CO2浓度和叶面积等生理指标,有效提高小麦的产量。对干旱胁迫条件下的番茄幼苗喷施甜菜碱可以增加脯氨酸含量,减少丙二醛含量,减小相对电导率,提高番茄幼苗的抗旱性[35]。此外,外源添加甜菜碱还对干旱引起的叶片气孔限制有效缓解[16],减轻叶绿素含量、PSⅡ光化学效率等降低的程度[36]。在本研究的试验结果中发现,外源甜菜碱可以缓解渗透胁迫下西瓜细胞外pH以及细胞内ROS含量的升高,同时对渗透胁迫下西瓜细胞生长的抑制有缓解作用,可以一定程度上提高西瓜细胞的抗逆性,但对于其在提高抗性中发挥的具体作用还需要进一步研究。
参考文献
[1] Zhu J K, Hasegawa P M, Bressan R A, et al. Molecular aspects of osmotic stress in plants[J]. Critical Reviews in Plant Sciences, 1997, 16(3): 253-277.
[2] 李 刚, 姜晓莉, 董学会. 植物渗透胁迫研究进展[J]. 吉林农业大学学报, 1996(S1): 84-86.
[3] Munns R. Comparative physiology of salt and water stress[J]. Plant Cell and Environment, 2002, 25(2): 239-250.
[4] Lei Y, Yin C Y, Ren J, et al. Effect of osmotic stress and sodium nitroprusside pretreatment on proline metabolism of wheat seedlings[J]. Biologia Plantarum, 2007, 51(2): 386- 390.
[5] Aydi S S, Aydi S, Gonzalez E, et al. Osmotic stress affects water relations, growth, and nitrogen fixation in Phaseolus vulgaris plants[J]. Acta Physiologiae Plantarum, 2008, 30(4): 441-449.
[6] 姚瑞玲. 不同種源青钱柳幼苗对渗透胁迫适应机理的研究[D]. 南京: 南京林业大学, 2007.
[7] Premecz G, Ruzicska P, Oláh T, et al. Effect of “osmotic stress” on protein and nucleic acid synthesis in isolated tobacco protoplasts[J]. Planta, 1978, 141(1): 33-36.
[8] 马建华, 郑海雷, 赵中秋, 等. 植物抗盐机理研究进展[J]. 生命科学研究, 2001(S1): 175-179, 226.
[9] Rhodes A D, Hanson A D. Quaternary ammonium and tertiary sulfonium compounds in higher plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1993, 44(1): 357-384.
[10] 刘友良, 毛才良, 汪良驹. 植物耐盐性研究进展[J]. 植物生理学通讯, 1987(4): 1-7.
[11] Papageorgiou G C, Fujimura Y, Murata N. Protection of the oxygen-evolving photosystem II complex by glycinebetaine[J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1991, 1057(3): 361-366.
[12] Nomura M, Hibino T, Takabe T, et al. Transgenically produced glycinebetaine protects Ribulose 1, 5-bisphosphate carboxylase/oxygenase from inactivation in Synechococcus sp. PCC7942 under salt stress[J]. Plant and Cell Physiology, 1998, 39(4): 425-432.
[13] Chen W P, Li P H, Chen T H H. Glycinebetaine increases chilling tolerance and reduces chilling-induced lipid peroxidation in Zea mays L.[J]. Plant Cell and Environment, 2000, 23(6): 609-618.
[14] 钟国辉, 王建林. 外源甜菜碱对氯化钠胁迫下白菜叶片的保护效应(简报)[J]. 植物生理学通讯, 1997, 33(5): 333-335.
[15] 郭 岩, 张 莉, 肖 岗, 等. 甜菜碱醛脱氢酶基因在水稻中的表达及转基因植株的耐盐性研究[J]. 中国科学(C辑): 生命科学, 1997, 27(2): 151-155.
[16] 马千全. 外源甜菜碱提高小麦抗旱性的研究[D]. 泰安: 山东农业大学, 2003.
[17] Yang X H, Liang Z, Lu C. Genetic engineering of the biosynthesis of glycinebetaine enhances photosynthesis against high temperature stress in transgenic tobacco plants[J]. Plant Physiology, 2005, 138(4): 2299-2309.
[18] Liang G J. Betaine can improve tolerance to low temperature in plant[J].Journal of Zhao Qing University, 2003, 24(2): 36-55.
[19] Yang X, Lu C. Photosynthesis is improved by exogenous glycinebetaine in salt-stressed maize plants[J]. Physiologia Plantarum, 2005, 124(3): 343-352.
[20] Ismail A, Riemann M, Nick P. The jasmonate pathway mediates salt tolerance in grapevines[J]. Journal of Experimental Botany, 2012, 63(5): 2127-2139.
[21] Chang X, Heene E, Qiao F, et al. The phytoalexin resveratrol regulates the initiation of hypersensitive cell death in Vitis cell[J]. PloS One, 2011, 6(10): e26405.
[22] Qiao F, Chang X L, Nick P. The cytoskeleton enhances gene expression in the response to the Harpin elicitor in grapevine[J]. Journal of Experimental Botany, 2010, 61(14): 4021-4031.
[23] 刘明乾, 吴绍华, 田 郎, 等. 橡胶草悬浮细胞遗传转化体系的建立[J]. 热带生物学报, 2018, 9(2): 176-182.
[24] 张洪培, 张晓茹, 胡格格, 等. 水杨酸诱发的丹参悬浮培养细胞内H2O2迸发与其培养基碱化的关系[J]. 植物科学学报, 2015, 33(3): 405-413.
[25] Benouaret R, Goujon E, Goupil P. Grape marc extract causes early perception events, defence reactions and hypersensitive response in cultured tobacco cells[J]. Plant Physiology and Biochemistry, 2014, 77(2): 84-89.
[26] Ojalvo I, Rokem J S, Navon G. 31P NMR study of elicitor treated Phaseolus vulgaris cell suspension cultures[J]. Plant Physiology, 1987, 85(3): 716-719.
[27] Okada M, Matsumura M, Ito Y, et al. High-affinity binding proteins for N-acetylchitooligosaccharide elicitor in the plasma membranes from wheat, barley and carrot cells: conserved presence and correlation with the responsiveness to the elicitor[J]. Plant and Cell Physiology, 2002, 43(5): 505-512.
[28] 白英俊, 李國瑞, 黄凤兰, 等. 活性氧与植物抗氧化系统研究进展[J]. 安徽农业科学, 2017, 45(36): 1-3.
[29] 王海波, 黄雪梅, 张昭其. 植物逆境胁迫中活性氧和钙信号的关系[J]. 北方园艺, 2010(22): 189-194.
[30] 张 怡, 路铁刚. 植物中的活性氧研究概述[J]. 生物技术进展, 2011, 1(4): 242-248.
[31] 普 凌, 赵 鑫, 王艇越, 等. 等渗盐胁迫对番茄幼苗生长和生理特性的影响[J]. 陕西农业科学, 2019, 65(5): 35-38.
[32] 张腾国, 胡馨丹, 李 萍, 等. 盐及低温胁迫对油菜ROS和抗氧化酶活性的影响[J]. 兰州大学学报(自然科学版), 2019, 55(4): 497-505.
[33] 张士功, 高吉寅, 宋景芝. 甜菜碱对NaCl胁迫下小麦细胞保护酶活性的影响[J]. 植物学通报, 1999(4): 429-432.
[34] 杨淑英, 张建新, 吕家珑, 等. 外源甜菜碱对冬小麦抗旱性生理指标的影响研究[J]. 西北植物学报, 2000(6): 1041-1045.
[35] 殷云刚, 罗庆熙, 马 承, 等. 干旱胁迫下叶面喷施甜菜碱对番茄幼苗生理指标的影响[J]. 北方园艺, 2008(10): 60-61.
[36] 马新蕾, 王玉军, 谢胜利, 等. 根施甜菜碱对水分胁迫下烟草幼苗光合机构的保护[J]. 植物生理与分子生物学学报, 2006, 32(4): 465-472.
