丁香酚对蓝莓链格孢霉的抑制作用
2020-10-29葛达娥魏照辉图尔荪阿依图尔贡陶宁萍周剑忠刘小莉
葛达娥,魏照辉,图尔荪阿依·图尔贡,3,潘 玥,王 帆,陶宁萍,周剑忠,刘小莉,
(1.上海海洋大学食品学院,上海 201306;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.新疆师范大学生命科学学院,新疆 乌鲁木齐 830054)
蓝莓属杜鹃花科、越橘属植物,其果实含多种抗氧化物、抗菌成分和丰富的食用纤维等,具有极高的营养和保健功效[1],经济价值极高。但蓝莓果皮柔嫩,在贮藏或者运输中,不可避免会造成果实相互之间的碰撞而导致机械损伤发生腐烂,因此对蓝莓的保鲜研究很有意义。
链格孢霉(Alternaria sp.)是一类普遍存在于新鲜果蔬表面并能导致果蔬在贮藏过程中发生腐败的丝状真菌。在前期实验中,本实验室从自然霉变的蓝莓样品中分离鉴定到一株链格孢霉,该菌株回接到新鲜蓝莓样品上,引发蓝莓初期腐败症状为果实表面出现黑色或褐色、塌陷的斑点,后期在腐烂区域表面产生大量的褐色菌丝[2-4]。研究表明链格孢霉次级代谢产物真菌毒素还会危害人体健康,造成极为严重的食品安全问题[5-6]。由于链格孢霉菌具有寄生和腐生性的特点,在-2~0 ℃下也能够生存,通常使用的低温贮藏、气调保鲜等物理手段不能彻底杜绝采前及采后蓝莓表面链格孢霉菌对果实的侵害。因此杀菌剂成为蓝莓采后病害防治的主要有效手段,如采用二氧化硫[7]和二氧化氯[8]对蓝莓进行熏蒸处理,可以有效杀死蓝莓中的致病菌,降低蓝莓的腐烂率,延长蓝莓货架期,但会造成化学残留,危害人体健康;因此安全无毒的植物源抑菌剂的开发应用成为当今研究的热点。
丁香酚是丁香精油的主要成分,有一定的抗菌生物活性,并能诱导果蔬内防御酶和抗氧化酶活性提高,在多种果蔬的防腐保鲜方面具有较好的应用前景,如杨梅[9]、苹果[10]、葡萄[11-12]、西红柿[13-14]、荔枝[15]、樱桃番茄[16]。本研究以实验室分离鉴定的一株链格孢霉为靶标菌,探究丁香酚对蓝莓链格孢霉的抑制效果,进一步明确丁香酚对病原真菌的有效抑菌质量浓度及其抑菌机理,为后续将丁香酚应用于蓝莓的保鲜提供依据。
1 材料与方法
1.1 菌株、材料与试剂
供试菌株:链格孢霉(Alternaria sp.),从腐败蓝莓中分离得到,鉴定后保藏于江苏省农业科学院农产品加工研究所食品生物工程研究室。
丁香酚精油、丁香酚(纯度85%) 江西金源天然香料公司;微量丙二醛(malondialdehyde,MDA)试剂盒、几丁质酶测定试剂盒、β-1,3-葡聚糖酶活性检测试剂盒、蛋白定量测定试剂盒 南京建成生物试剂公司;碘化丙啶(propidium iodide,PI)荧光染料 生工生物(上海)股份有限公司。
1.2 仪器与设备
HT7700透射电子显微镜 日本Hitachi公司;MERLIN扫描电子显微镜 德国ZEISS公司;TH4-200荧光倒置显微镜 日本Olympus公司;Epoch酶标仪美国BioTek公司;DDS-307A电导率仪 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 链格孢霉孢子悬浮液、菌丝的制备
采用Lachhab等[17]的方法,将链格孢霉接种到PDA培养基上28 ℃培养10 d,以无菌生理盐水洗下孢子,并用6 层纱布过滤除去菌丝。采用血球计数板对孢子进行计数,调整孢子悬浮液的孢子浓度为1×107个/mL,现用现制。
吸取孢子悬浮液1 mL加入到100 mL PDB液体培养基中,静置培养24 h,获得链格孢霉新鲜菌丝,备用。
1.3.2 丁香酚对链格孢霉菌丝生长抑制率的测定
采用生长速率法[18]测定丁香酚对链格孢霉菌丝生长的影响。分别吸取0.5、1.0、1.5、2.0、2.5 mL和3.0 mL的10 mg/mL丁香酚母液(溶剂为无水乙醇,下同)加入到100 mL PDA培养基中,使丁香酚终质量浓度分别为0.05、0.10、0.15、0.20、0.25、0.30 mg/mL,混匀后倒入无菌培养皿,备用。用直径6 mm的无菌打孔器从培养5 d的链格孢霉菌落边缘位置切取菌饼,将菌丝面贴在含丁香酚培养皿和对照培养皿中,对照培养皿不含丁香酚,预实验证明体积分数3%乙醇对菌丝生长无抑制作用。将培养皿置于28 ℃恒温培养箱内培养7 d,采用十字交叉法测定菌落直径,按下式计算丁香酚精油对菌丝径向生长的抑制率。

式中:6 mm为菌落初始直径。
1.3.3 丁香酚对链格孢霉孢子萌发抑制能力的测定
分别吸取一定量的丁香酚母液于1 mL的无菌PDB培养基中,将丁香酚配制成质量浓度分别为0、0.04、0.08、0.12、0.16、0.20、0.24、0.28、0.32、0.36、0.40 mg/mL的溶液,对照组为不含丁香酚的体积分数3%乙醇。取190 μL不同质量浓度的丁香酚和10 μL的孢子液(107个/mL)于96 孔板,置于28 ℃恒温培养箱中培养2 d。用酶标仪检测OD600nm值,以其衡量丁香酚精油对链格孢霉孢子萌发的抑制作用。
1.3.4 链格孢霉形态的观察
1.3.4.1 链格孢霉菌丝和孢子形态的观察
取1 mL孢子悬浮液和1 g湿菌丝,用0.3 mg/mL丁香酚溶液(处理组)或无菌水(对照组)处理12 h后用无菌水清洗菌丝和孢子3 次,除去丁香酚。用0.01 mol/L pH 7.0的磷酸盐缓冲液反复冲洗菌丝和孢子3 次,置于体积分数2.5% MDA溶液中4 ℃下过夜固定。将固定好的菌丝和孢子用磷酸盐缓冲液漂洗3 次,每次静置10 min,除去MDA;将样品依次置于系列体积分数为30%、50%、70%、80%、90%和100%的乙醇溶液中脱水置换,每次15 min。脱水后临界点干燥,将干燥的菌体固定到金属台上,用离子溅射仪对金属台喷金、镀膜,进行扫描电子显微镜观察。
1.3.4.2 链格孢霉菌丝和孢子的超微结构观察
将1.3.4.1节中乙醇脱水后的样品,继续用丙酮脱水3 次,用Epon812固定剂进行包埋,超薄切片,经醋酸铀和柠檬酸铅双染色后,采用透射电子显微镜进行观察和图像采集[19]。
1.3.5 链格孢霉菌丝细胞膜通透性的测定
取湿质量为1 g的菌丝,置于无菌离心管中,加入20 mL无菌水悬浮菌丝。加入0.6 mL丁香酚母液,使其终质量浓度为0.3 mg/mL。置于28 ℃、100 r/min摇床中处理12 h,12 000×g、4 ℃离心10 min,收集上清液,沉淀所得的菌丝用无菌水清洗3 次,备用。对照组用无菌水替代丁香母液。
1.3.5.1 链格孢霉菌丝PI染色及观察
将备用菌丝重浮于无菌水中得到菌丝悬浮液,在1 mL菌丝悬浮液中加入1 mL 2 μmol/L PI荧光探针,37 ℃避光孵育20 min后,用无菌水漂洗多余探针后置荧光显微镜下观察并拍照。
1.3.5.2 链格孢霉菌丝可溶性蛋白质量浓度、电导率的测定
分别吸取0.05 mL 1.3.5节中处理组和对照组的上清液,按照考马斯亮蓝法测定上清液中可溶性蛋白质量浓度;并将电导率仪预热15 min后,测定上清液的电导率。
1.3.6 链格孢霉菌丝相关酶活力的测定
将1.3.5节中的备用菌丝冷冻干燥后用液氮研磨至粉末状,4 ℃保存备用。
1.3.6.1 β-1,3-葡聚糖酶活力的测定
采用β-1,3-葡聚糖酶活力检测试剂盒,通过测定还原糖生成速率计算处理前后链格孢霉丝的β-1,3-葡聚糖酶活力。称取0.1 g菌丝粉末,按质量体积比为1∶10加入β-1,3-葡聚糖酶提取液,进行冰浴匀浆。12 000 ×g、4 ℃离心10 min,取上清液,置冰上待测。按β-1,3-葡聚糖酶活力检测试剂盒说明书对样本进行测定,计算β-1,3-葡聚糖酶活力。每克组织每小时产生1 mg还原糖定义为一个酶活力单位。
1.3.6.2 几丁质酶活力的测定
称取0.1 g菌丝粉末,按1∶10(m/V)的比例加入几丁质酶提取液,进行冰浴匀浆。12 000×g、4 ℃离心20 min,取上清液,置冰上待测。按几丁质酶测定试剂盒说明书对样品进行测定,计算丁香酚处理后几丁质酶活力的变化。37 ℃条件下,每克组织每小时分解几丁质产1 mg N-乙酰氨基葡萄糖的酶量为1 个酶活力单位。
1.4 数据统计与分析
实验数据采用DPS软件整理并采用Tukey多重比较方法进行方差分析(P<0.05),用Origin Pro 8.5软件绘制图形。
2 结果与分析
2.1 不同质量浓度丁香酚对链格孢霉菌丝生长的抑制作用

图1 不同质量浓度丁香酚对链格孢霉菌丝生长的抑制效果Fig. 1 Inhibitory effect of eugenol at different concentrations on the growth of Alternaria sp.
由图1可以看出,丁香酚对链格孢霉菌丝径向生长抑制作用效果随丁香酚质量浓度升高而增强,即呈现一定的剂量效应。当丁香酚质量浓度为0.05 mg/mL时,丁香酚对链格孢霉丝生长就表现出抑制作用,其抑制率为(18.38±0.89)%;丁香酚质量浓度由0.05 mg/mL增至0.15 mg/mL时,其对链格孢霉菌丝生长的抑制率提高了2.89 倍;丁香酚质量浓度增加至0.25 mg/mL时,菌丝生长抑制率高达(95.89±0.32)%。当丁香酚质量浓度为0.30 mg/mL,链格孢霉菌丝完全停止生长。
2.2 丁香酚对链格孢霉孢子萌发的最小抑菌浓度
如图2所示,随着丁香酚质量浓度的提高,OD600nm值逐渐降低,表明丁香酚对链格孢霉孢子萌发抑制作用增强。对照组的OD600nm值为2.89±0.38,当丁香酚质量浓度上升为0.04 mg/mL时,其OD600nm值为2.69±0.23,与对照组无显著性差异(P>0.05),即研究条件下质量浓度低于0.04 mg/mL的丁香酚对孢子的萌发无显著作用;当质量浓度达到0.12 mg/mL时,OD600nm值为1.59±012,较丁香酚质量浓度为0.04 mg/mL时显著减小(P<0.05),说明0.12 mg/mL丁香酚对孢子的萌发抑制作用增强;丁香酚质量浓度提高到0.24 mg/mL时,OD600nm值为0.13±0.01,相比于质量浓度为0.12 mg/mL时显著减小(P<0.05),链格孢霉的孢子萌发受到强烈抑制。当丁香酚质量浓度在0.28~0.40 mg/mL时,OD600nm值无显著性差异(P>0.05),即丁香酚对链格孢霉孢子萌发的最小抑制质量浓度为0.24 mg/mL。
2.3 丁香酚对链格孢霉菌丝细胞膜的影响

图3 丁香酚对链格孢霉菌丝细胞死亡的影响Fig. 3 Effect of eugenol on cell death of hyphae of Alternaria sp.
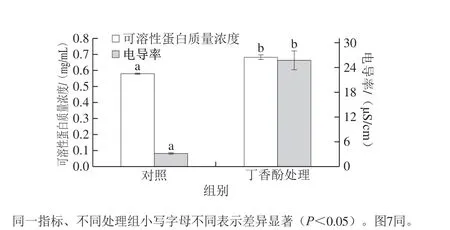
图4 丁香酚对链格孢霉菌丝细胞内容物泄漏的影响Fig. 4 Effect of eugenol on the leakage of intracellular contents from mycelia of Alternaria sp.
PI是一种常用的细胞核荧光染色剂,与细胞核中的DNA结合后,可在绿色光(540 nm波长)的激发下,在600 nm波长(红色光)处发出明亮的荧光[20]。PI不能透过完整细胞膜,当真菌菌丝细胞膜受到损伤后方可进入菌丝内部与核酸结合发出荧光。由图3可知,对照组菌丝在绿色光激发下无红色荧光出现,而经0.3 mg/mL的丁香酚处理后的菌丝出现了红色荧光,说明链格孢霉的菌丝细胞膜受到损伤。
细胞膜受到损伤将表现为膜透性增加和电解质外渗速率加快,通过测定菌丝胞外可溶性蛋白质量浓度和电导率可以了解真菌细胞膜通透性的变化。由图4可知,处理组的可溶性蛋白质量浓度和电导率较对照组均有所提高,且差异显著(P<0.05),处理组的可溶性蛋白质量浓度和电导率分别是对照组的1.18 倍和8.02 倍。由此推测丁香酚破坏了链格孢霉菌丝的细胞膜,使得膜通透性增加,内容物泄漏,进而导致菌丝死亡。
2.4 丁香酚对链格孢霉孢子和菌丝形态的影响

图5 链格孢霉孢子(A)和菌丝(B)扫描电子显微镜图Fig. 5 SEM images of Alternaria sp. spores (A) and hyphae (B)
如图5所示,0.3 mg/mL的丁香酚对链格孢霉菌丝生长及孢子萌发有明显抑制作用,与对照组相比,0.3 mg/mL丁香酚处理后的链格孢霉孢子和菌丝表面形态不再完整、光滑,出现了较深的凹陷;孢子无芽管抽出,菌丝周边呈现明显的内容物泄漏。因此,0.3 mg/mL的丁香酚可以导致链格孢霉发生裂解,胞内部分物质流出,使孢子失去萌发的能力,菌丝停止生长。
2.5 丁香酚对链格孢霉孢子和菌丝超微结构的影响
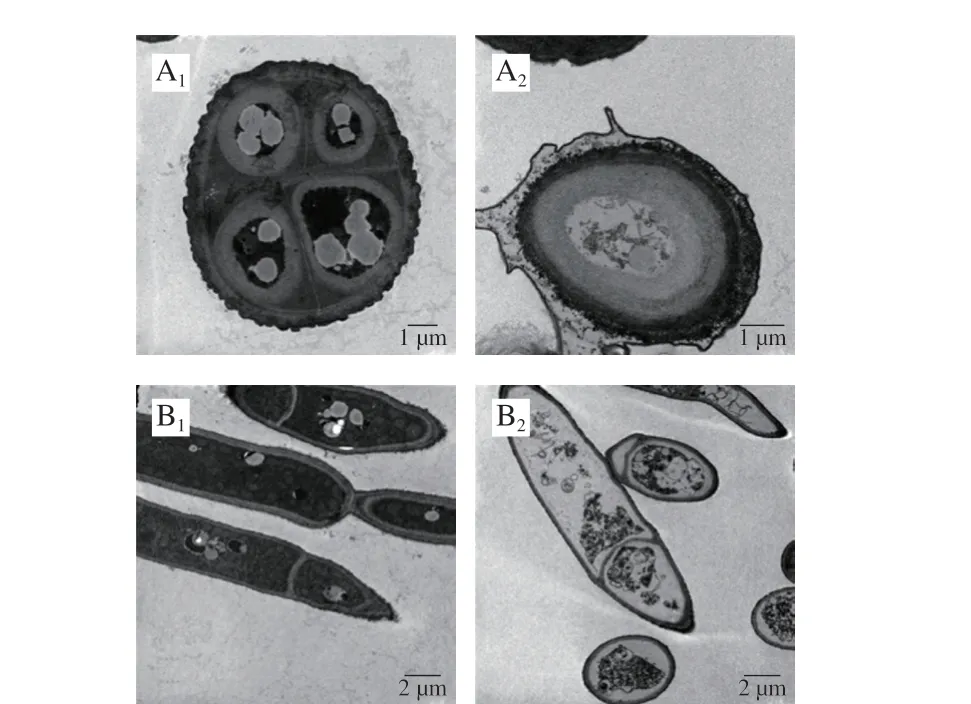
图6 链格孢霉孢子(A)和菌丝(B)透射电子显微镜图Fig. 6 TEM images of Alternaria sp. spores (A) and hyphae (B)
扫描电子显微镜结果显示丁香酚对链格孢霉形态完整性有一定的破坏作用,进一步于透射电子显微镜下观察丁香酚对链格孢霉孢子及菌丝的内部变化影响。如图6所示,未经丁香酚处理的链格孢霉的孢子和菌丝具有完整的细胞壁以及完整光滑的细胞膜结构,细胞结构紧密,胞质比较均匀;而经丁香酚处理作用后,孢子细胞壁出现了溶解,孢子和菌丝的细胞质发生固缩,引起细胞的质壁分离,已看不到完整的细胞器。可见,丁香酚对链格孢霉的细胞壁有明显的破坏作用,对细胞器形成也有一定影响,这可能是丁香酚抑制孢子萌发及菌丝生长的重要原因。
2.6 丁香酚对链格孢霉菌体相关酶活力的影响
真菌细胞壁的主要成分为多糖,其中多糖主要包括几丁质、纤维素、葡聚糖等。因几丁质酶可以催化几丁质水解,β-1,3-葡聚糖酶能催化β-1,3-葡聚糖苷键水解;因此,当细胞中的几丁质酶和β-1,3-葡聚糖酶活力升高时,细胞壁的重要组成成分减少,使细胞壁结构遭到破坏。

图7 丁香酚处理对链格孢霉菌丝几丁质酶和β-1, 3-葡聚糖酶活力的影响Fig. 7 Effect of eugenol treatment on chitinase and β-1,3-glucanase activity of Alternaria sp.
由图7可知,与对照组相比,丁香酚处理链格孢霉丝体12 h后,几丁质酶活力由(0.24±0.03)U/g上升到(0.81±0.04)U/g,β-1,3-葡聚糖酶活力由(0.60±0.05)U/g上升到了(0.90±0.04)U/g。经丁香酚处理后,链格孢霉菌丝几丁质酶和β-1,3-葡聚糖酶的活力显著升高,分别升高了2.37 倍和50%。几丁质酶和β-1,3-葡聚糖酶的活力显著升高,导致这两种酶控制的细胞壁上几丁质和葡聚糖含量降低,这一结果与透射电子显微镜下观察到的细胞壁完整性被破坏一致。
3 讨 论
丁香酚易从可食用的香料中进行提取,毒性较低,不易残留,对食品中常见的腐败菌和产毒素菌的生长有明显抑制作用[21-23]。本实验研究发现,不同质量浓度的丁香酚对链格孢霉的菌丝生长和孢子萌发都有抑制作用,且呈现一定的剂量效应,与已有研究的结论[24]相符。当丁香酚质量浓度为0.3 mg/mL时,能够完全抑制链格孢霉菌丝生长和孢子的萌发,余兴等[25]以500 μL/L的薰衣草精油、薄荷精油和葡萄籽精油直接作用链格孢霉,其抑制率分别为90.18%、87.09%和2.0%;许倩等[26]研究发现大蒜精油对链格孢霉的最小抑菌剂量为1.25 μL/L,说明丁香酚在抑制链格孢霉生长上更有优势。生物细胞膜是一种具有选择性的半透膜,有些抗菌物质能够破坏细胞膜的通透性,从而干扰细胞正常的物质运输[27]。目前的研究普遍认为植物源化合物作用于微生物时,主要是通过破坏细胞膜、增大膜的选择通透性、降低微生物膜的稳定性来达到抑菌效果[28-30]。房舒等[31]在研究蛇床子素结构修饰物JS-B对辣椒疫霉作用机制时发现,JS-B处理的菌丝经PI染色后未见荧光现象,而阳性对照组Cu2+处理相同时间则出现红色荧光;与本研究的PI染色结果一致,推测丁香酚主要通过引起链格孢霉细胞膜通透性增大,造成细胞死亡从而达到抑菌效果。Stein[32]研究认为细胞壁对细胞起着定型和保护的作用,细胞壁受到损伤会使细胞壁上的纤维原变形。李姝毅等[33]研究发现,经丁香酚作用后,阿萨希毛孢子菌菌体出现肿胀膨大、干瘪变形,部分菌丝胞壁破坏,随着丁香酚药液质量浓度的增加,整个菌丝完全被破坏,胞质外溢。在扫描电子显微镜和透射电子显微镜的观察下,经0.3 mg/mL丁香酚处理后的链格孢霉孢子和菌丝出现凹陷、细胞壁裂解等现象;因此,推测丁香酚破坏了链格孢霉的细胞壁,以致孢子失去萌发能力,菌丝停止生长。几丁质酶和β-1,3-葡聚糖酶能够催化水解真菌细胞壁重要组成成分几丁质和葡聚糖。胡平[34]研究发现草果精油处理葡萄灰霉病菌,能在一定程度上引起灰霉病菌产生葡萄糖饥饿现象,刺激几丁质酶活性的升高,不断降解真菌细胞壁,破坏真菌细胞壁的完整性,引起细胞内渗透压不稳定,导致真菌细胞溶解死亡。本实验中经0.3 mg/mL丁香酚处理后的链格孢霉几丁质酶和β-1,3-葡聚糖酶活力显著提高,说明丁香酚可以作用于链格孢霉的细胞壁及细胞膜,破坏菌体的完整性,使得胞内物质向外泄漏,同时使丁香酚更易扩散进入胞内,破坏细胞器,而起到杀菌作用。
虽然有关丁香酚杀菌机理的研究报道较多[35-36],但针对链格孢霉的机理研究却很少。魏月琴等[37]研究发现,鹿蹄草素可以增加链格孢病菌细胞膜透性,影响病原真菌体内蛋白质的合成,进而抑制链格孢霉的生长抑制作用。张素等[38]对黑曲霉超临界萃取物抑制链格孢作用机制进行研究,发现其抑菌机制是通过影响细胞膜的正常功能、损伤细胞结构和抑制真菌的呼吸代谢等方面实现的。本实验从丁香酚处理后链格孢霉形态和生理生化变化研究了丁香酚对链格孢霉的抑制机理,后续可以对受抑制链格孢霉菌体蛋白含量、呼吸代谢方面作进一步研究,以更深入了解丁香酚对链格孢霉的作用机制,为丁香酚直接用于蓝莓保鲜提供理论依据。
综上,丁香酚对链格孢霉菌丝的生长和孢子萌发有一定的抑制效果,且抑制效果随丁香酚质量浓度的提高而增强。0.3 mg/mL的丁香酚可以增大链格孢霉菌丝细胞膜的通透性,引起链格孢霉菌丝几丁质酶和β-1,3-葡聚糖酶活力的升高,导致细胞壁出现裂解,细胞器出现损伤,胞内物质流出,从而抑制链格孢霉的生长。
