微酸性电解水对黄豆发芽的影响
2020-10-29赵之怡申盼盼张运龙施丹李昂石艺琦张春玲
赵之怡,申盼盼,张运龙,施丹,李昂,石艺琦,张春玲
(西北农林科技大学 食品科学与工程学院,陕西 杨凌,712100)
黄豆芽是黄豆在适宜环境条件下发芽得到的蔬菜。与种子相比,发芽可以提高VC、黄酮类化合物和蛋白质等营养物质的含量,同时可以降低一些抗营养因子的影响,促进消化吸收[1-2]。豆芽生长周期短,全年均可生产,生产方便快捷,深受广大生产者和消费者的欢迎。然而,黄豆在发芽、收获、包装、运输和销售等各个环节中都有可能被来源于人类、动物或环境的微生物污染,如果未被合理消毒,污染微生物会在种子发芽所需的高温高湿环境中快速生长繁殖,造成豆芽的生产失败甚至食源性疾病的暴发[3]。目前,辐照、有机酸、次氯酸钠、热处理、酒精处理等微生物控制方法被应用于芽苗菜生产[3-6],但这些方法主要是在种子浸泡或清洗阶段用于种子消毒,但浸泡、清洗阶段的杀菌消毒无法完全灭活种子携带的微生物,在发芽期间如果不采取控制措施,残留的微生物在高温高湿的发芽环境中会迅速生长繁殖,最终数量达到较高水平;次氯酸钠、酒精等高浓度消毒剂的使用将导致化学残留并影响种子的正常发芽。因此,寻求一种既能有效控制微生物数量,又不影响豆芽生长和食用安全的消毒方法势在必行。
微酸性电解水(slightly acidic electrolyzed water, SAEW)是在无隔膜的电解槽中电解稀盐或稀HCl溶液生成的具有特殊理化性质的水溶液,pH为5.0~6.5,具有较强的杀菌活性。相比其他化学消毒剂,SAEW的制备只需简单的电解过程,无需复杂操作、制取方便、成本低廉;SAEW的有效氯成分易分解,pH接近中性,化学残留小,对人体、设备、环境的影响小;在微酸性pH范围内,SAEW中的有效氯成分主要以HClO形式存在,其杀菌效力为ClO-的80~150倍,且SAEW杀菌过程的作用时间短,不利于微生物抗性的形成,杀菌高效、广谱。研究表明,SAEW对纯培养的大肠杆菌、沙门氏菌、蜡样芽孢杆菌、绿脓假单胞菌都有较强的杀灭能力[7-8]。经过SAEW处理,新鲜蔬菜(如芹菜、香菜、藕)和多种芽苗菜(如豌豆芽、绿豆芽、荞麦芽)的微生物数量均显著下降[9-13]。因其杀菌高效广谱、价格低廉、安全环保等特点,SAEW被广泛应用于食品工业,日本、美国、韩国已经批准SAEW为食品添加剂[12-13]。因此,本研究将SAEW代替常规生产用水用于黄豆发芽过程。
植物生长环境中的离子种类和浓度会对植物造成不同程度的影响,研究表明,在含有一定量Na+的环境中发芽,可以提高西兰花芽和花椰菜芽的抗氧化活性[14]、提高苦荞芽的营养价值[15]。因此,本研究利用不同电解质(NaCl和HCl溶液)电解生成含有Na+和不含有Na+的SAEW,并将其应用到黄豆的清洗、浸泡、发芽过程,考察不同SAEW的杀菌效果,以及其对黄豆发芽特性、黄豆芽生长品质和营养物质含量的影响。
1 材料与方法
1.1 材料与试剂
平板计数琼脂(plate count agar, PCA)、结晶紫中性红胆盐琼脂(violet red bile agar, VRBA)、孟加拉红琼脂(rose bengal agar),北京陆桥技术有限公司;NaCl、HCl均为分析纯,四川西陇化工有限公司;抗坏血酸(ascorbic acid,AsA)含量测试盒、植物类黄酮测试盒,南京建成生物工程研究所;黄豆种子[(17.23±0.04)g/100粒],陕西省杨凌区好又多超市。
1.2 仪器与设备
Chlorometer Duo双量程氯量计,英国Palintest公司;Harmony-II微酸性电解水生成设备,北京睿安德科技有限公司;HD-240L微酸性电解水生成设备,上海富强旺卫生用品有限公司;DH-11L拍打式无菌均质机,宁波洛尚智能科技有限公司;Five Easy Plus FE28双标度pH/ORP计,Mettler Toledo公司。
1.3 试验方法
1.3.1 SAEW的制备
为比较不同电解质产生的不同有效氯浓度(available chlorine concentrations, ACC)的SAEW对黄豆发芽的影响,本研究以实验室前期研究所采用的参数为基础[12],由发生器1(Harmony-II,电解质60 g/L NaCl)和发生器2(HD-240L,电解质60 g/L HCl)制备ACC为35、70 mg/L的SAEW,在制备完成后立即检测其理化参数。ACC由氯量计测定。pH和氧化还原电位(oxidation-reduction potential, ORP)由双标度pH/ORP计测量。本研究所用处理溶液的理化参数如表1所示。

表1 处理溶液的理化参数Table 1 The physicochemical parameters of the treatment solutions
注: CK指自来水,NaCl 70、NaCl 35、HCl 70和HCl 35指电解NaCl或HCl溶液得到的ACC分别为70 mg/L或者35 mg/L 的SAEW
1.3.2 浸种与发芽
剔除虫蛀、干瘪、畸形、超小粒黄豆。每组称取黄豆200 g,用200 mL相应溶液轻柔清洗,弃去清洗液,重复3次。将清洗过的种子在600 mL相应溶液中浸泡12 h,弃去浸泡液,将种子置于发芽筐(直径16 cm)中,覆盖8层无菌纱布,避光发芽。每天用相应处理溶液淋洗5次,第4天收获。收获后黄豆芽置于4 ℃冰箱暂存。
1.3.3 微生物分析
采用平板菌落计数法检测黄豆发芽过程中的微生物数量。黄豆发芽期间,每天在第1次淋水后3 h随机采样25 g,置于无菌自封袋。自封袋中加入100 mL质量浓度为8.5 g/L NaCl溶液,以12次/s的速度在均质机中均质2 min以充分洗脱样品表面微生物,充分混匀后取1 mL均质液进行梯度稀释。取稀释梯度合适的菌液0.1 mL,分别涂布于PCA平板、VRBA平板和孟加拉红琼脂平板,PCA平板置于37 ℃培养48 h,VRBA平板置于37 ℃培养24 h,孟加拉红平板置于28 ℃培养72 h。培养结束后分别进行菌落总数、大肠菌群、霉菌和酵母计数,记录为3次重复测定的平均值,以lg CFU/g表示。本实验采用的平板菌落计数法的检出限为1.70 lg CFU/g,即结果表示为无法检出或0时,表示微生物数<1.70 lg CFU/g。
1.3.4 黄豆的发芽特性
将150粒黄豆按照1.3.2方法清洗、浸泡12 h后沥干水分,平铺于滤纸静置10 min。测定浸泡前后黄豆的质量。吸水率按公式(1)计算:
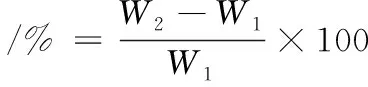
(1)
式中:W1为样品浸泡前黄豆质量,g;W2为样品浸泡后黄豆质量,g。
在直径18 cm的培养皿底部铺1层滤纸,将种子均匀铺在滤纸上,并在种子上覆盖2层滤纸待其发芽,每天喷淋相应溶液5次以保持水分,每12 h检测1次发芽种子数。黄豆发芽以种子破皮露白超过1 mm为标准,发芽率按公式(2)计算:
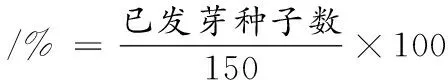
(2)
1.3.5 黄豆芽的生长指标
豆芽成熟后,从每个发芽筐中随机抽取50株黄豆芽,用直尺(最小刻度为0.5 mm)测量芽长,用游标卡尺(最小刻度为0.02 mm)测量茎粗。取平均值作为黄豆芽芽长和茎粗。
每组随机取出100株豆芽称重,测量黄豆芽鲜重/百株重(g/100株)。
1.3.6 黄豆芽的营养特性
黄豆芽收获后4 h内,随机取样,用VC试剂盒和植物类黄酮试剂盒检测VC和类黄酮的含量,VC含量以μg/g表示,类黄酮含量以mg/g表示。
1.3.7 数据处理
本研究的数据来源于3次独立的重复试验。以平均值±标准差(SD)表示。采用SPSS统计软件(IBM SPSS Statistics 25)进行统计分析,使用SNK法分析差异显著性,显著性水平设置为0.05;采用Origin 2017绘图软件进行图表绘制。
2 结果与分析
2.1 SAEW对黄豆发芽过程中微生物的控制效果
SAEW处理的黄豆在发芽过程中的菌落总数、大肠菌群、霉菌和酵母总数变化如图1所示。第4天收获时,CK处理组黄豆芽的菌落总数达到8.59 lg CFU/g。研究表明,细菌可以在种子的缝隙中隐藏而免受消毒剂的伤害[16]。即使经消毒剂处理后残留微生物极少,经过发芽,微生物数量也会呈指数增长,最终可达到7~8 lg CFU/g[17]。糙米经ACC为50 mg/L的SAEW浸泡30或60 min后,微生物降至无法检出(平板菌落计数)的水平,但是在发芽48 h后,存活于糙米表皮褶皱或缝隙中的微生物快速生长繁殖,数量达到8~9 lg CFU/g[18]。如果将大肠杆菌接种在萝卜种子上,其数量经ACC为20 000 mg/L的次氯酸钠溶液处理后显著减少,而发芽72 h后与未经消毒处理的对照组大肠杆菌数量处于同一水平[6]。以上研究表明,在种子的清洗、浸泡阶段很难将微生物彻底杀灭,而存活下来的微生物会在发芽过程中利用合适的环境条件和种子本身的营养物质快速繁殖,数量增至较高水平。因此,在种子发芽的整个过程中都应当采取消毒措施。
本研究将SAEW应用于黄豆清洗、浸泡、发芽全过程。如图1-a所示,第1天,经过12 h的浸泡,CK、NaCl 70、NaCl 35,、HCl 70和HCl 35处理组黄豆表面菌落总数分别为4.33、0、2.67、0、2.53 lg CFU/g,第2天分别增至7.81、5.43、6.03、5.63和6.14 lg CFU/g。菌落总数在第2天出现明显增长,原因可能是,附着在种子上的微生物在种子发芽初期仍然处于休眠状态,在合适条件下,一段时间后微生物被激活并迅速生长繁殖。在第4天时,CK、NaCl 70、NaCl 35、HCl 70和HCl 35处理组黄豆芽菌落总数分别为8.59、6.19、7.28、6.40和7.26 lg CFU/g,SAEW处理组显著降低了黄豆芽表面菌落总数(P< 0.05)。与ACC为35 mg/L的SAEW相比,ACC为70 mg/L的SAEW具有更好的杀菌效果。不同电解液产生的相同ACC的SAEW对微生物的控制效果没有显著差异,说明ACC是SAEW杀菌的主要影响因素,电解质对其杀菌效果没有明显影响。各处理组大肠菌群、霉菌和酵母数与菌落总数的变化趋势相似。

a-菌落总数;b-大肠菌群;c-霉菌和酵母图1 黄豆发芽过程中不同处理组的微生物数Fig.1 The counts of natural microbiota on soybean sprouts treated by different solutions during seed germination注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.2 SAEW对黄豆发芽特性的影响
2.2.1 SAEW对黄豆吸水率的影响
如图2-a可知,各处理组间黄豆的吸水率无显著差异。在萌芽阶段,种子需要吸收充足的水分而膨大,进而种皮破裂、出现萌芽,因此,充分吸水是种子萌发的必要条件[19]。研究表明,糙米在SAEW中浸泡24 h后,与自来水处理相比,吸水率没有显著差异[18],与本研究结果相似。与自来水相比,SAEW处理对黄豆种子萌发时的吸水过程没有不利影响。
2.2.2 SAEW对黄豆发芽率的影响
由图2-b可知,SAEW处理组12 h时的黄豆发芽率与自来水处理组无明显差异,但24 h的发芽率显著高于自来水组,在发芽结束时,不同处理组的黄豆发芽率接近。有研究表明,SAEW处理对荞麦和萝卜的发芽率没有显著影响[13, 20],与本实验结果一致。周艳鑫等[21]用扫描电镜观察SAEW浸泡过的绿豆表面,发现SAEW可加重对绿豆表面的蜡状表皮结构的破坏。水被电解以后,水分子团簇结构变小,更容易进入细胞。因此经SAEW处理,黄豆种子表皮受到破坏,相比自来水处理组更容易破裂,从而有利于萌芽较早出现,但最终发芽率与自来水处理组趋于一致。
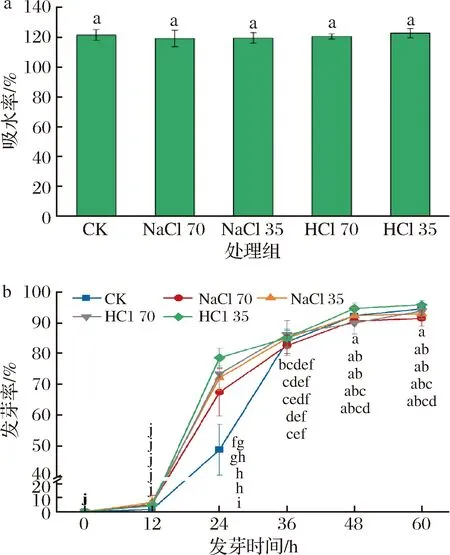
a-吸水率;b-发芽率图2 不同处理组黄豆的发芽特性Fig.2 The geimination properties soybean sprouts treated by different solutions
2.3 SAEW对黄豆芽生长指标的影响
黄豆发芽4 d后收获并测定其芽长、茎粗、鲜重,结果如表2所示。SAEW处理组黄豆芽的芽长较自来水处理组芽长短,ACC较大的SAEW对芽长的抑制更明显;然而,经SAEW处理的黄豆芽茎粗均大于自来水处理组;各处理组间黄豆芽鲜重没有显著差异。自来水处理的豆芽长而细,SAEW处理的豆芽短而粗。有研究表明,相比自来水处理组,经SAEW处理后荞麦芽的芽长较短,且高ACC(90 mg/L)的SAEW相比低ACC(10、30 mg/L)的SAEW有更显著的抑制作用[13],与本研究结果相似。SAEW处理虽然对黄豆芽的长度有抑制作用,但对其鲜重没有不利影响,因此,SAEW可以用于黄豆发芽。
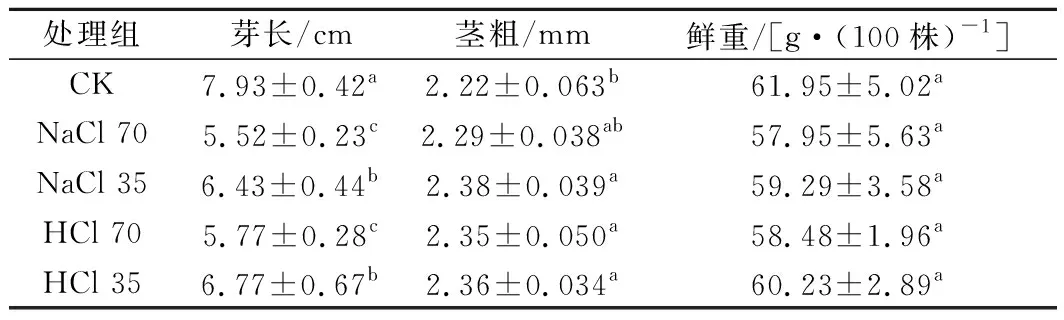
表2 不同处理组黄豆芽的生长指标Table 2 The growth properties of soybean sprouts treated by different solutions
2.4 SAEW对黄豆芽营养物质含量的影响
2.4.1 SAEW对黄豆芽VC含量的影响
如图3所示,CK、NaCl 70、NaCl 35、HCl 70和HCl 35处理组的黄豆芽VC质量分数分别为6.02、5.74、6.37、6.90和7.78 μg/g。以NaCl为电解质的SAEW对黄豆芽VC含量没有显著影响;HCl 35处理组黄豆芽中VC含量显著提高(P<0.05)。VC又称为抗坏血酸,是一种重要的水溶性抗氧化剂,有利于人体健康,并在植物生长中起着重要调节作用[22]。刘瑞等[23]发现,SAEW处理可以增加绿豆芽中的VC含量;赵德锟等[24]用SAEW处理鲜切云南红梨,虽然在贮藏期间样品VC含量降低,但从贮藏第3天开始,SAEW处理可以显著延缓VC的衰减,所以SAEW造成的微酸性环境可能有利于提高或保持果蔬中VC含量。研究表明,NaCl溶液处理降低黄豆芽、西兰花芽、盐芥的VC含量[25-27],在本研究中,以NaCl为电解质的SAEW中含有一定量的Na+,因此经其处理的黄豆芽VC含量小于以HCl为电解质的SAEW处理组。含Na+的SAEW处理如何影响成熟黄豆芽中的VC含量有待进一步研究。
2.4.2 SAEW对黄豆芽类黄酮含量的影响
类黄酮是蔬菜中常见的酚类化合物,具有较高的抗氧化活性[28]。如图3所示,CK、NaCl 70、NaCl 35、HCl 70、HCl 35处理组黄豆芽的类黄酮含量分别为1.58、1.48、1.42、1.78、1.85 mg/g,以NaCl为电解质的SAEW处理对类黄酮含量没有显著影响,HCl 35处理组黄豆芽的类黄酮含量显著提高(P<0.05)。有研究表明,SAEW能够提高绿豆萌发过程中多种抗氧化酶活性[29];贾国梁[30]研究发现,在山药的储存过程中,SAEW处理组样品的抗氧化能力较强,且保持了较高的类黄酮含量。由此可见,SAEW可能提高了黄豆芽的抗氧化能力,通过提高类黄酮合成酶(如苯丙氨酸解氨酶、查尔酮异构酶等)活性促进黄豆芽中类黄酮的积累。本研究中,在其他条件都相同的情况下,电解质为HCl的SAEW处理组黄豆芽的类黄酮含量均高于电解质为NaCl的SAEW处理组。研究表明,NaCl溶液处理降低了黄豆芽中多酚、黄酮的含量[25]。经过SAEW浸泡处理,绿豆表皮结构的破坏加重[21];次氯酸钠处理削弱了兜兰种子细胞壁的完整性[31];LIANG等[13]的研究表明,经过SAEW处理,相比自来水,荞麦吸收了更多的SAEW。经电解后,水分子团簇结构变小,水分子协同各种离子更容易进入植物细胞。因此,以NaCl溶液为电解质的SAEW可能破坏了黄豆芽表面组织结构,使大量Na+进入豆芽。黄豆是盐敏感型作物[32],Na+主要在大豆根中积累[33],大量Na+造成的离子毒性使细胞膜透性增加,豆芽生理紊乱、渗透失衡,耐受性降低,影响正常发芽过程,使类黄酮的合成受阻[34]。SAEW处理对黄豆芽类黄酮含量的影响机制还需要进一步研究。
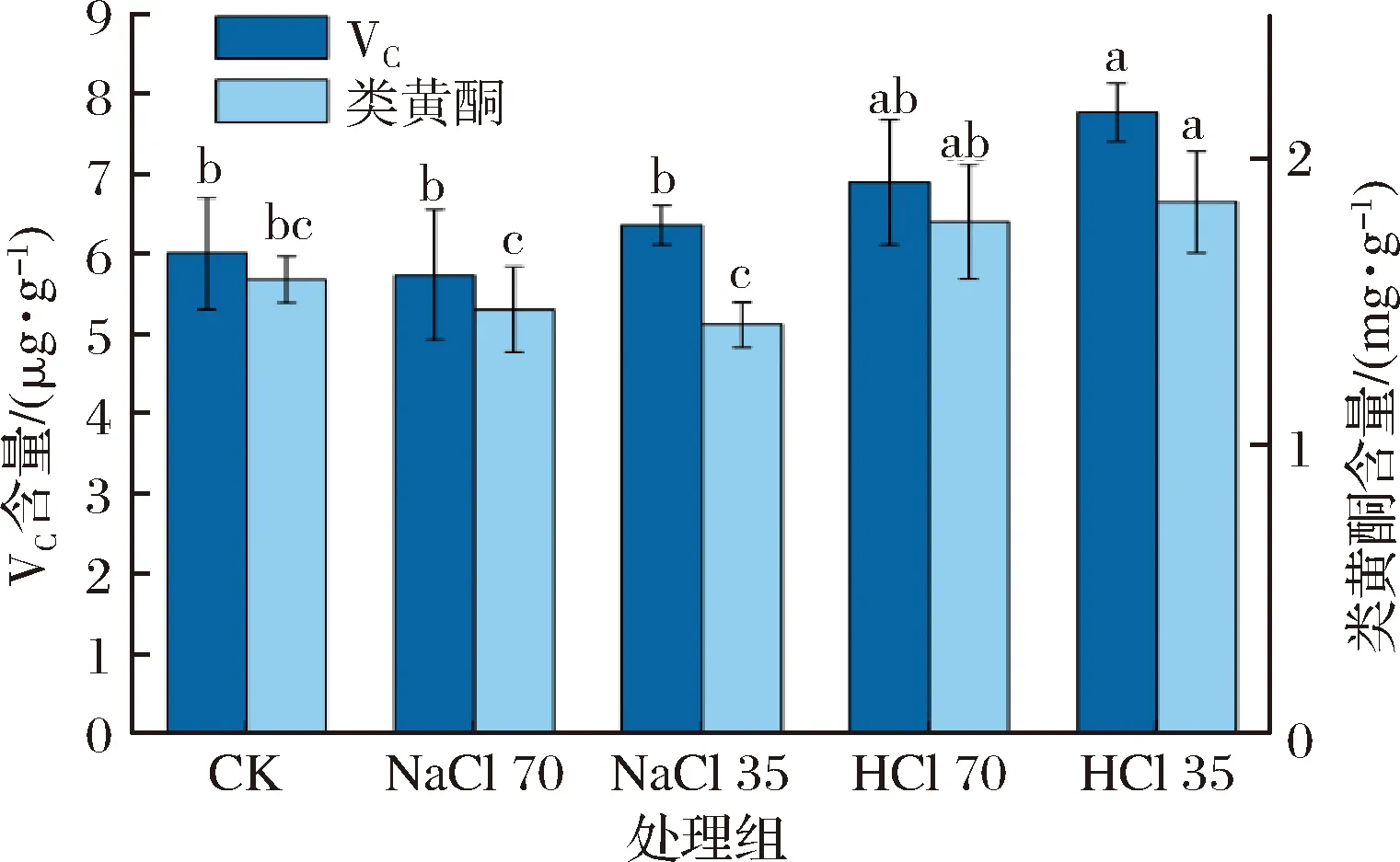
图3 不同处理组黄豆芽的营养特性Fig.3 The nutritional properties of soybean sprouts treated by different solutions
3 结论
不同电解质(NaCl和HCl溶液)、不同ACC(35和70 mg/L)的SAEW应用于黄豆发芽过程,能够有效降低菌落总数、大肠菌群、霉菌和酵母数,对黄豆的发芽和黄豆芽产量没有不利影响。并且以HCl为电解质的SAEW可提高黄豆芽的VC和类黄酮含量。不同电解质(NaCl和HCl溶液)对SAEW的杀菌效果、对黄豆芽的发芽特性和生物特性没有明显影响。同样以HCl为电解质,相比ACC为35 mg/L的SAEW,ACC为70 mg/L的SAEW对微生物的控制效果更好,但经较高ACC的SAEW处理的黄豆芽芽长较短、VC和类黄酮含量均略低。因此,从微生物安全性、芽苗菜食用性及营养等方面考虑,电解HCl溶液产生的ACC为35 mg/L的SAEW更适合黄豆芽的生产。
