银屑病皮损间充质干细胞对人角质形成细胞增殖及凋亡的影响
2020-10-29梁男男常文娟张开明
梁男男,常文娟,张开明
银屑病是一种免疫介导的慢性炎症性皮肤疾病,主要特点为角质形成细胞的异常增殖和分化,同时伴有免疫细胞的浸润。角质形成细胞是表皮最主要细胞类型,主要通过调节自身增殖和凋亡来维持细胞稳态,当受多种因素如炎性因子、趋化因子和钙离子浓度等影响时,细胞代谢紊乱,从而导致银屑病等各种皮肤病的发生[1]。间充质干细胞是一种多潜能干细胞,不仅参与皮肤组织再生,而且还通过分泌细胞因子影响皮肤微环境。前期研究发现银屑病患者皮损的间充质干细胞(dermis mesenchymal stem cells,DMSCs)细胞因子分泌异常[2,3],笔者推测DMSCs是否通过调节细胞因子的分泌从而影响KCs的增殖及凋亡。其中转化生长因子(TGF)-β1作为DMSCs分泌的一个重要细胞因子可以抑制角质细胞的增殖和分化[4]。本研究检测共培养后DMSCs对正常人表皮角质形成细胞(human normal keratinocytes cells,KCs)增殖及凋亡的影响,旨在分析细胞因子TGF-β1在其中的作用。
1 资料与方法
1.1 组织来源
银屑病皮损来源:选择2017年9月—2019年7月就诊于太原市中心医院皮肤科门诊并确诊为寻常性银屑病患者,男女各5例,年龄18~60岁,平均年龄36岁。就诊前3个月内未使用过糖皮质激素、维A酸及免疫抑制剂。正常皮肤组织取自我院泌尿外科及骨科手术切除皮肤,且患者无银屑病史,与患病组年龄、性别相匹配。患者均签署知情同意书,本课题经太原市中心医院医学伦理委员会批准通过。
1.2 试剂与仪器
胎牛血清和DMEM-F12(Hyclon公司),dispase酶和胰酶(Sigma公司),角质形成细胞培养基K-SFM(Gibco公司),12孔Transwell培养板(Corning公司),细胞增殖及细胞毒性检测试剂盒CCK-8(武汉博士德生物工程有限公司),AnnexinV-FITC/PI细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司),酶联免疫吸附试验(ELISA)检测试剂盒(上海西唐生物科技有限公司)。倒置显微镜(日本Olympus),流式细胞仪(BDFAC-SCalibur型),37℃恒温培养箱(Sheldon Manufacturing Inc)。
1.3 方法
1.3.1 KCs的分离与培养 无菌条件下将正常皮肤组织制备成1 mm3的组织团块,浸润于dispase酶中4℃过夜,第2天将组织进行真表皮分离,将剥离的表皮剪碎和胰酶一起转移至玻璃小瓶中,置于细胞培养箱中消化5~10 min,待组织从颗粒状变成团块状时用含10%的DMEM-F12培养基终止消化,反复吹打使细胞分离,用40 μm孔径滤网过滤,收集上清,离心后加入K-SFM培养基。细胞置于5% CO2饱和湿度培养箱中孵育24 h,待细胞贴壁后换液,以后每3 天全量换液1次,于倒置显微镜下观察细胞的生长状态。
1.3.2 DMSCs的分离和培养 于无菌操作台上将健康皮肤和银屑病皮损组织分别制备成1 mm3的组织团块,加入dispase酶4℃过夜,第2天机械分离真表皮,将真皮组织尽量剪碎,置于含10%FBS的DMEM-F12培养基中,用滴管反复吹打组织使细胞充分分离,随后用40 μm孔径滤网过滤,收集上清液,800 r/min,离心6 min,弃上清液,加入DMEM-F12重悬细胞。细胞置于37℃,5%CO2培养箱中孵育,待细胞贴壁后换液,以后每3 天全量换液1次。
1.3.3 分组 实验设置3个组:①KCs单纯培养组,②健康对照组(健康人DMSCs与KCs共培养组),③试验组(银屑病皮损DMSCs与KCs共培养组)。将培养至P3的DMSCs重悬,调整浓度为2×105种在Transwell板的上室,同理将KC细胞以相同浓度种在Transwell板的下室,上下室分别加入相对应的培养基,置于37℃,5%CO2培养箱中孵育96 h。
1.3.4 细胞增殖检测方法 去掉Transwell 小室,根据CCK-8检测试剂盒说明书,将共培养后的KC细胞制成细胞悬液,细胞计数后于96孔板每孔加入100 μl细胞悬液,约为1×104个细胞,每组细胞设5个复孔,同时设置空白孔(不含细胞,只有培养基)、对照孔(单独培养的细胞)和实验孔(共培养后的细胞),培养箱中孵育24 h。待检测前2 h每孔加入10 μl CCK-8溶液,于450 nm的酶标仪检测各孔A值。细胞存活率(%)=(实验组A值-空白组A值/对照组A值-空白组A值)×100%。
1.3.5 细胞凋亡检测方法 去掉Transwell 小室,用不含EDTA的胰酶消化下室KC细胞,收集1×105个细胞,用PBS洗涤细胞2次,800 r/min,离心5 min。弃去上清,加入500 μl Binding Buffer轻轻吹散细胞,避免出现细胞团块,再分别加入5 μl AnnexinV-FITC和5 μl PI,混匀,室温避光反应15 min后上机检测。早期凋亡率=(凋亡细胞量/总细胞量)×100%。
1.3.6 ELISA法检测TGF-β1浓度 待细胞共培养96 h后,收集细胞上清,参照ELISA试剂盒说明书检测TGF-β1浓度。
1.4 统计学方法
所有数据均用SPSS16.0处理,定量数据采用均数±标准差(±s)表示,均数比较采用单因素方差分析或t检验。
2 结果
2.1 细胞形态
倒置相差显微镜下观察银屑病患者和健康人群分离的DMSCs,培养7 d后,细胞均呈贴壁生长,生长状态良好,两组形态无明显差异,大多呈长梭形,少数呈三角形或多边形(图1a,图1b)。KCs呈典型上皮样特征,呈铺路石样,高核质比,细胞紧密排列(图1c)。
2.2 DMSCs上清对细胞存活率的影响
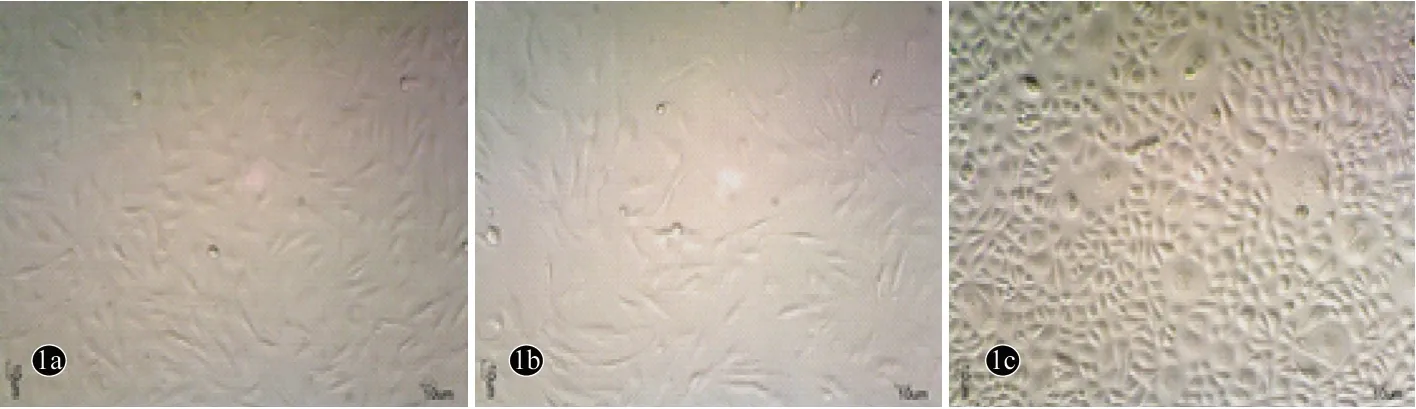
图1 DMSCs 和KC在倒置相差显微镜下的形态特点(×40)
按表1设置浓度梯度,将银屑病皮损和健康人的DMSCs上清以不同比例(1:1,2.5:1, 5:1)分别加入KCs培养基中预处理,结果显示与KCs单纯培养组相比,共培养组细胞存活率普遍有所升高,且患银屑病皮损组比健康人组的细胞存活率更高(P<0.05);而健康人组在5:1比例时,与KCs单纯培养组相比,KCs细胞存活率无统计学差异(表1)。
表1 不同浓度DMSCs上清作用于KC后对细胞存活率的影响 (±s,n=5)
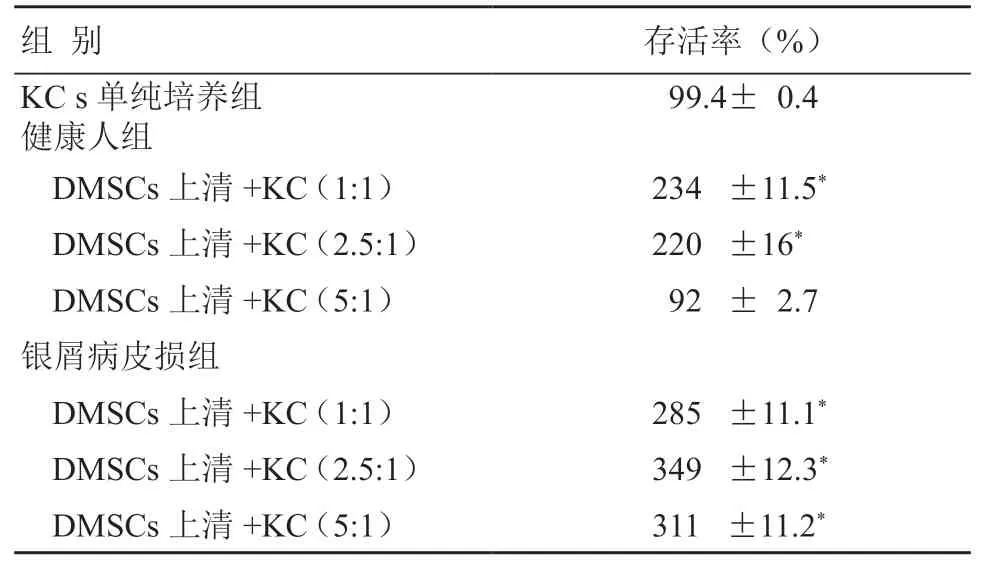
表1 不同浓度DMSCs上清作用于KC后对细胞存活率的影响 (±s,n=5)
注:与单纯培养组比较,*P<0.05
?
2.3 银屑病DMSCs对KCs存活率的影响
明确了细胞上清对KCs的促进增殖作用后,再用Transwell共培养技术进一步研究二者之间的相互作用关系,结果与KCs单纯培养组相比,健康对照和试验组细胞存活率均有所升高(P<0.05),且试验组较健康对照组的细胞存活率更高(P<0.05)(表2)。

表2 银屑病DMSCs对KC存活率的影响 (x¯ ±s,n=7)
2.4 银屑病DMSCs对KC凋亡的影响
用流式细胞仪检测发现,与单纯KC培养组相比,共培养组细胞凋亡率均有所升高(P<0.05),但患病组较健康组的细胞凋亡率反而下降(P<0.05)(表3,图2)。
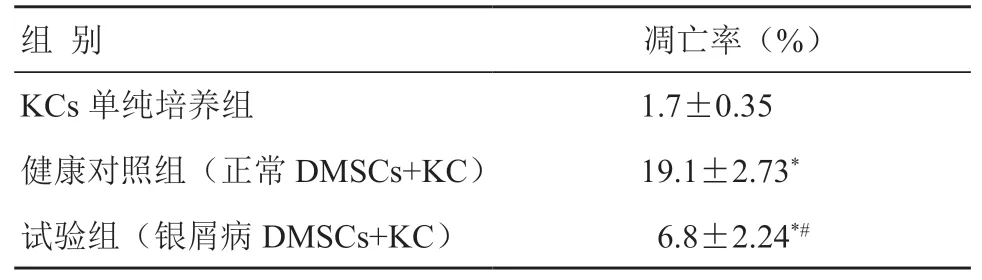
表3 银屑病DMSCs对KC凋亡率的影响 (x¯ ±s,n=7)
2.5 银屑病DMSCs对细胞因子TGF-β1的影响
用ELISA检测细胞上清中TGF-β1水平,发现共培养后TGF-β1浓度下降(P<0.05),且患病组与健康组相比降低的更明显(P<0.05)(表4)。

图2 DMSCs作用于KC后对细胞凋亡的影响(x¯ ±s,n=6)

表4 银屑病DMSCs对TGF-β1的影响 (x¯ ±s,n=6)
3 讨论
银屑病是一种由遗传、感染、免疫等多种因素相互作用引起的一种慢性炎症性皮肤病。最常见的是寻常性银屑病,组织病理表现为角化不全或过度角化、棘层增厚、颗粒层消失[5],说明银屑病是一种表皮过度增生的皮肤病,而KCs是组成表皮的最主要成分。正常情况下,KCs通过免疫防御、增殖分化来维持皮肤稳态,KCs从基底层逐渐向外层增殖和迁移来保护皮肤免受外界损伤和刺激[6]。银屑病患者细胞微环境发生改变,细胞因子、趋化因子和细胞内信号通路发生变化,导致细胞周期缩短[7],所以KCs在银屑病中发挥重要作用。间充质干细胞是一种多能干细胞,具有自我更新、自我复制、无限增殖及多向分化的特点,可通过分泌细胞因子减少炎症、减少细胞凋亡。银屑病DMSCs生物学功能异常,通过分泌多种细胞因子包括趋化因子、TGF-β1、白细胞介素(IL)-22和IL-8等参与炎症反应和免疫应答[8]。其中TGF-β1是一种多功能细胞因子,不仅参与细胞分化和组织修复,研究发现TGF-β1可以通过降低c-myc水平干预细胞周期进程,从而抑制KCs的增殖和分化[9,10];同时TGF-β1还被认为是一种抗炎细胞因子,与受体TGF-βRⅠ和Ⅱ结合,促进Smad2和Smad3磷酸化,形成复合物,易位入核调节下游靶基因[11]。
本实验采用Transwell技术,模拟DMSCs和KCs在皮肤组织中的生理环境,进一步研究二者之间的相互作用关系。首先,用不同浓度的DMSCs的培养上清来孵育KCs,结果显示与正常单纯培养组相比,不论是正常DMSCs还是银屑病DMSCs上清普遍可以显著提高KCs的细胞存活率,但二者之间没有浓度依赖性,可能是由于随着上清比例的加大,适宜KCs的培养基相对减少,导致细胞增殖反而有所下降。随后进行共培养实验,CCK-8检测细胞存活率,流式细胞仪检测细胞凋亡发现,试验组与KCs单纯培养组相比,细胞增殖和凋亡均有所增强;与健康对照组相比,细胞增殖加强,凋亡降低,说明银屑病皮损DMSCs可以促进KCs增殖,促进KCs凋亡能力减弱,从而导致银屑病皮损发生。为了探究其中机制,笔者检测TGF-β1,发现共培养后TGF-β1水平明显降低,进一步验证了DMSCs通过改变细胞微环境影响KCs的增殖及凋亡。
综上所述,本实验证明银屑病DMSCs可能通过改变TGF-β1分泌水平来调节KC的增殖和凋亡,从而参与银屑病的发生发展。了解DMSCs对KCs的作用机制有利于为银屑病的治疗和预防提供新的思路和靶点。
