发酵剂对发酵香肠蛋白质降解及多肽抗氧化能力的影响
2020-10-28冯美琴
冯美琴,余 頔,孙 健,
(1.金陵科技学院动物科学与技术学院,江苏 南京 210038;2.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏 南京 210095)
发酵香肠是发酵肉制品的典型代表之一,具有风味独特、营养价值高、肉品质构好、易于消化等特点。随着近年来发酵剂的广泛应用及加工过程中参数的严格控制,发酵香肠的生产逐步进入到规模化、标准化和高效化的现代化生产阶段,使得发酵香肠成为发酵肉制品中产量最大的产品之一[1]。然而,发酵香肠含有大量的脂肪,其在加工贮藏过程中的过度氧化会影响发酵香肠的感官和营养品质,缩短货架期,带来安全隐患。近年来,动植物蛋白源获得的抗氧化肽因其活性强、结构稳定、安全系数高等优点引起了研究者们广泛关注。赵谋明[2]和刁静静[3]等发现将不同来源的抗氧化肽添加到香肠中均能起到较好地抑制氧化的作用,但这些外源抗氧化肽的提取过程复杂,在实际应用中受到限制。在发酵香肠体系中,Sun Weizheng[4]和Gallego[5]等分别从广式腊肠、西班牙、意大利和比利时干发酵香肠中提取到了抗氧化肽,其抗氧化活性随生产工艺、原料和发酵剂等因素不同存在差异。
蛋白质是发酵香肠重要组成成分,在长期发酵和成熟过程中依靠肌肉内源蛋白酶和微生物蛋白酶的共同作用降解成多肽和游离氨基酸。考虑到腌制剂及发酵条件对内源蛋白酶的抑制作用,发酵剂分泌的蛋白酶对多肽形成起着重要的作用。常用的微生物发酵剂包括乳酸菌、凝固酶阴性葡萄球菌、酵母和霉菌等[6]。Candogan[7]和Aro[8]等发现接种发酵剂促进了发酵香肠蛋白质的降解,特别是混合发酵剂。Fernández等[9]发现接种乳酸片球菌MS200和小牛葡萄球菌RS34可以增强伊比利亚干发酵香肠“salchichón”水溶性蛋白提取物氧化自由基吸收能力。此外,大量研究证明,小分子多肽的抗氧化活性强于其亲本蛋白或高分子质量多肽[10-11]。
目前,关于通过选择接种适合的发酵剂促进发酵香肠蛋白水解产生内源性抗氧化肽的研究鲜有报道。植物乳杆菌(Lactobacillus plantarum)CD101和模仿葡萄球菌(Staphylococcus simulans)NJ201由课题组筛选自传统中式香肠,具有较强的蛋白酶水解活性(在含1 mg/mL肌浆蛋白的琼脂板透明圈直径分别为(23.71±1.58)、(18.47±0.83)mm;含1 mg/mL肌原纤维蛋白的琼脂板透明圈直径分别为(22.90±0.16)、(20.38±0.51)mm)[12-13]。在课题组先前研究中,将该混合发酵剂在无菌肌浆蛋白提取物中孵育4 d,其降解产物多肽抗氧化能力显著增强[14];将该混合发酵剂接种至发酵香肠中能够一定程度抑制脂肪和蛋白的氧化[15]。因此,本研究将L.plantarumCD101和S.simulansNJ201作为发酵剂接种到发酵香肠中,以自然发酵香肠作为对照组,探究发酵剂对发酵香肠蛋白质的降解及多肽抗氧化活性影响,以期提高发酵香肠抗氧化能力,为通过内源性抗氧化肽抑制香肠氧化提供一定理论依据。
1 材料与方法
1.1 材料与试剂
L.plantarumCD101(NCBI编号为MG798695);S.simulansNJ201(NCBI编号为MG798688)。
猪后腿肉、猪背膘、猪肠衣 江苏省苏食肉品有限公司;盐、蔗糖、姜粉、五香粉、白胡椒粉 江苏苏果超市有限公司;葡萄糖 南通奥凯生物技术开发有限公司;异抗坏血酸钠 郑州拓洋实业有限公司;亚硝酸钠杭州龙山化工有限公司;MRS Broth培养基、MRS Agar培养基、MSA培养基、PCA培养基 青岛海博生物科技有限公司;氯化钠、氢氧化钠、甲醇、胰蛋白胨、三氯乙酸、碘化钾、硼酸、磷酸二氢钠、磷酸氢二钠、冰醋酸、正己烷 国药集团化学试剂有限公司;浓盐酸、浓硫酸 南京化学试剂股份有限公司;Triton X-100索莱宝科技有限公司;牛血清蛋白、磺基水杨酸麦克林有限公司;10%及12%蛋白预制胶 美国Bio-Rad公司;预染蛋白Marker(10~250 kDa) 美国Thermo Fisher科技公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;4×上样缓冲液、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)法总抗氧化能力检测试剂盒、铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)法总抗氧化能力检测试剂盒 上海碧云天生物技术有限公司;实验试剂均为分析纯。
1.2 仪器与设备
TC 12E绞肉机 意大利Sirman公司;VF608灌肠机德国Handtmann公司;KBF 240恒温恒湿箱 德国Binder公司;FE20 pH计 美国Mettler Toledo公司;Ultra Turrax T25高速匀浆机、RV10旋转蒸发仪 德国IKA公司;Avanti J-E落地式高速冷冻离心机 美国Beckman Coulter公司;K1160全自动凯氏定氮仪 济南海能仪器股份有限公司;PowerPac Basic电泳仪、Universal Hook凝胶成像仪 美国Bio-Rad公司;Model 8200型超滤杯、超滤膜(3 kDa) 美国Millipore公司;N-EVAPTM 112氮吹仪 美国Organomation公司;Spectral Max M2e多功能酶标仪 美国MD公司;L-8900A 氨基酸自动分析仪日本Hitachi公司。
1.3 方法
1.3.1 发酵剂的活化与制备
L.plantarumCD101于MRS液体培养基37 ℃培养18 h;S.simulansNJ201于MSA液体培养基30 ℃培养18 h;分别活化3 次后,菌液按需进行离心(12 000×g,5 min,4 ℃),弃去上清液,然后用无菌水反复洗涤沉淀3 次,重悬备用。
1.3.2 发酵香肠制作
参考曹辰辰等[15]的方法,制作发酵香肠。取新鲜猪瘦肉,剔除表面筋膜,切成大小均匀长条,漂洗后于4 ℃备用;猪背膘切成薄片,漂洗后于-20 ℃预冻。瘦肉和预冻的背膘使用筛板孔径为10 mm的绞肉机搅碎。按新鲜猪瘦肉与猪背膘质量比8∶2,其他成分以肉质量为基础,添加量为食盐2%、蔗糖1%、葡萄糖1%、亚硝酸钠0.015%、异抗坏血酸钠0.05%、姜粉0.1%、白胡椒粉0.1%、五香粉0.1%,发酵剂浓度为107CFU/g。
工艺流程:原料肉的选择→漂洗→绞肉→低温腌制→搅拌→灌肠→恒温发酵→干燥成熟。
以不添加任何发酵剂自然发酵香肠为对照组;以107CFU/g接种量按照1∶1接种L.plantarumCD101和S.simulansNJ201的香肠为接种组。在30 ℃、相对湿度80%的条件下放入恒温恒湿箱发酵24 h后,在15 ℃、相对湿度75%缓慢发酵3 d,最后以12 ℃、相对湿度72%条件干燥成熟,在第37天得到发酵香肠样品。
1.3.3 pH值的测定
按照GB 5009.237—2016《食品pH值的测定》[16]的方法用pH计测定。
1.3.4 微生物活菌数的测定
取10 g样品用无菌剪刀剪碎后,与90 mL含有0.3%胰蛋白胨的无菌生理盐水一起加入无菌均质袋中,均质90 s。混合均匀后即为稀释度为10-1的样品匀液。继续梯度稀释至适当浓度进行接种,培养48 h后计数。使用PCA培养基测定细菌总数;MRS培养基测定乳酸菌数量;MSA培养基测定葡萄球菌数量。
1.3.5 总氮(total nitrogen,TN)和非蛋白氮(nonprotein nitrogen,NPN)含量的测定
TN含量按照GB 5009.5—2016《食品中蛋白质的测定》[17]的方法进行测定。
NPN提取参考Hughes等[18]的方法并稍作修改。称取5 g样品,加入20 mL 2%的TCA溶液,冰浴匀浆(13 500 r/min,20 s×3)。随后离心(10 000×g,4 ℃,20 min)收集上清液。使用全自动凯氏定氮仪对上清液中非蛋白氮含量进行测定。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
发酵香肠中肌浆蛋白和肌原纤维蛋白提取和电泳分别参考Mauriello[19]和Zhou Changyu[20]等的方法。
1.3.7 多肽含量的测定
发酵香肠中多肽的提取参考Xing Lujuan等[21]方法并稍作修改。称取13 g样品加入100 mL pH 7.2 磷酸缓冲溶液,冰浴匀浆3 次(18 000 r/min,10 s×3),4 ℃静置2 h后离心(12 000×g,4 ℃,20 min)。取上清液,经纱布过滤后加入3 倍体积40%乙醇,静置过夜(12 h)。之后继续离心(12 000×g,4 ℃,20 min),上清液经0.45 μm滤膜抽滤。滤液使用旋转蒸发仪浓缩去除乙醇,之后用纯水定容至500 mL,为粗肽。分别取上述粗肽250 mL,使用超滤杯配合截留分子质量为3 kDa的超滤膜进行超滤分离,得到分子质量小于3 kDa的小分子多肽。每次上样量为50 mL,氮气压力0.02 MPa。
发酵香肠中多肽含量的测定根据Church等[22]方法并稍作修改。邻苯二甲醛混合试剂配方如下:取40 mg邻苯二甲醛溶解于1 mL甲醇中,依次加入25 mL 0.1 mol/L四硼酸钠溶液、2.5 mL 20% SDS和100 μLβ-巯基乙醇,最后用纯水定容至50 mL。该试剂现用现配。取100 μL的上述肽液与2.0 mL邻苯二甲醛混合试剂,室温孵育2 min。随后在340 nm波长处测定吸光度。以胰酪蛋白胨作为标准蛋白绘制标准曲线,计算发酵香肠肽液中的多肽浓度,并转化香肠中多肽含量。
1.3.8 多肽抗氧化能力的测定
取上述多肽液进行抗氧化能力测定。DPPH自由基清除能力的测定参考Zhu Chaozhi等[23]的方法;ABTS阳离子自由基清除能力的测定参考Wiriyaphan等[24]的方法;还原能力的测定参考Jiang Haiping等[25]的方法。以1 mg/mL谷胱甘肽作为阳性对照。
1.3.9 游离氨基酸的测定
发酵香肠中游离氨基酸含量的测定参照Qi Jun等[26]的方法并稍作修改。称取2.5 g样品加入20 mL 3 mg/mL的磺基水杨酸,10 000 r/min冰浴匀浆20 s×3。12 000×g、4 ℃离心15 min后,取4 mL上清液加2 mL正己烷,混合均匀后静置分层。取水相通过0.22 μm滤膜过滤。使用氨基酸自动分析仪对氨基酸含量进行测定。
1.4 数据分析
每个处理重复3 次,结果以平均值±标准误表示。采用SAS 8.0统计软件对数据分析,用Two-Samplet-test方法进行假设检验,One Way ANOVA方法进行方差分析,用Duncan多重比较,P<0.05,差异显著。使用Origin 2018绘图软件作图。
2 结果与分析
2.1 发酵剂对发酵香肠pH值与微生物活菌数的影响

表1 发酵香肠的pH值与微生物活菌数Table 1 pH and viable bacterial counts of fermented sausages
发酵香肠较低的pH值不仅能赋予其独特口味,而且可以抑制腐败和致病菌的生长,促使蛋白质凝固,提高香肠的安全性和稳定性[27]。发酵香肠pH值降低主要依靠乳酸菌通过代谢糖类产生大量的乳酸及其他有机酸[28]。如表1所示,接种组的pH值显著低于对照组(P<0.05),与田建军等[29]的研究一致。这是由于接种组在香肠制作初期添加107CFU/g的L.plantarumCD101,该菌在发酵阶段适宜温湿度下具有快速产酸的能力[12]。同时,pH值在初始阶段快速下降也将抑制其他微生物生长[30],使得香肠在第37天成熟时,接种组乳酸菌、葡萄球菌、菌落总数均显著性低于对照组(P<0.05)。对照组的产酸菌主要来源于原料肉与环境,其初始数量相对较少(约5(lg(CFU/g))),且产酸能力不一。
2.2 发酵剂对发酵香肠TN和NPN含量的影响
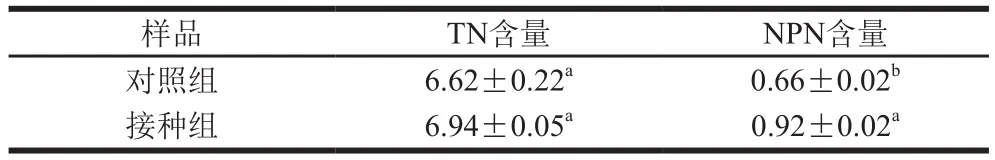
表2 发酵香肠的TN和NPN含量Table 2Total nitrogen and non-protein nitrogen contents of fermented sausages mg/100 g
如表2所示,2 组香肠的TN含量没有显著差异(P>0.05),说明2 组香肠在加工过程中因水分损失含氮物质没有差异。NPN含量指除蛋白以外含氮化合物的总含量,包括氨基酸、多肽、氨及铵盐等含氮化合物。接种组的NPN含量显著高于对照组(P<0.05),说明添加发酵剂促进了蛋白质降解。韩鲜娜等[31]在接种清酒乳杆菌和木糖葡萄球菌熏马肠中发现,在成熟初期对照组与接种组NPN含量相当,而在成熟后期接种组NPN含量迅速上升,在第28天时接种组NPN含量是对照组的1.44 倍,与本实验结果相似。NPN含量的增加也有利于微生物蛋白酶利用NPN生成小分子多肽。
2.3 发酵剂对发酵香肠的SDS-PAGE的影响

图1 发酵香肠的SDS-PAGE图谱Fig.1 SDS-PAGE patterns of sarcoplasmic and myofibrillar proteins from fermentd sausag
如图1A所示,发酵香肠在成熟37 d后,在高浓度食盐作用下肌浆蛋白发生变性[30],条带基本保持稳定。相比于对照组,接种组在130~250 kDa处条带染色强度降低,31 kDa处条带消失,小于15 kDa的低分子质量条带染色强度增加,说明接种发酵剂促进了发酵香肠肌浆蛋白的水解。
如图1B所示,2 组发酵香肠的肌球蛋白重链(220 kDa)均已发生强烈降解。接种组的肌动蛋白(45 kDa)、原肌球蛋白(40 kDa)和肌钙蛋白(37 kDa)条带染色强度降低,在38 kDa处出现新的条带。此外,与肌浆蛋白相似,接种组在分子质量小于20 kDa的低分子质量条带染色强度增加。在对照组香肠中也观察到这种积累,但没有接种组香肠的染色强度深。该结果与Aro等[8]报道的接种了L.sakei和S.carnosus发酵香肠相似。以上结果表明,接种发酵剂促进了发酵香肠中肌原纤维蛋白的水解。蛋白降解主要依靠内源蛋白酶和微生物蛋白酶的共同作用。Casaburi等[32]发现,接种发酵剂的香肠中内源酶活性要高于未接种发酵剂的香肠。由乳酸菌产生的乳酸可以刺激内源蛋白酶的活性[33],从而有利于微生物蛋白酶发挥作用,促进蛋白继续降解。
2.4 发酵剂对发酵香肠多肽含量的影响
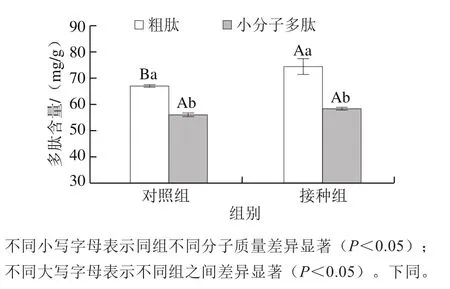
图2 发酵的香肠多肽含量Fig.2 Peptide contents of fermented sausages
如图2所示,对照组和接种组的粗肽含量分别为66.97 mg/g和74.29 mg/g,接种组的含量显著高于对照组(P<0.05),这一结果与接种组SDS-PAGE图谱中分子质量小于20 kDa处条带的染色强度增强相吻合,进一步证明混合发酵剂对发酵香肠中蛋白质降解和小分子多肽积累的有效性。Mejri等[34]在发酵骆驼肉香肠成熟过程中发现,分子质量在3 kDa以上的多肽浓度减小,而分子质量在3 kDa以下的多肽浓度增加。在本实验中,接种组分子质量小于3 kDa的小分子多肽略高于对照组,分别为55.84 mg/g和58.29 mg/g,没有显著性差异(P>0.05),这可能是由于发酵剂同时具有较好氨肽酶活性。这些分子质量小于3 kDa的多肽通常具有更好的生物活性。
2.5 发酵剂对发酵香肠多肽抗氧化能力的影响

图3 发酵香肠多肽的抗氧化能力Fig.3 Antioxidant capacity of peptides extracted from fermented sausages
如图3所示,接种组粗肽和小分子多肽的DPPH自由基清除活性、ABTS阳离子自由基清除活性、FRAP值均显著高于对照组(P<0.05),这表明接种发酵剂能显著增强发酵香肠多肽的抗氧化能力。Geeta等[35]发现接种L.plantarum可以提高鸡肉肠抗氧化能力。Ayyash等[36]报道了发酵骆驼肉香肠抗氧化活性的变化,发现接种组DPPH自由基和ABTS阳离子自由基清除活性强于对照组。多肽的抗氧化活性与多肽的氨基酸组成、空间结构和疏水性有关,一些独特的氨基酸序列可能具有较强的抑制或阻断氧化链式反应的能力[37-38]。DPPH自由基是一种脂溶性自由基,接种组多肽的高DPPH自由基清除活性说明接种组发酵剂中微生物蛋白酶水解蛋白时暴露出更多疏水性氨基酸,使其更容易与DPPH自由基结合而发挥作用。Liu Dongmei等[39]指出位于N端的疏水性氨基酸有利于多肽的抗氧化活性。同时,发酵剂中微生物蛋白酶水解使得多肽的带电氨基酸残基暴露,使其与Fe3+-TPTZ结合能力增强,导致FRAP值显著升高[40]。
值得注意的是,即使在相对较低浓度下,相同处理组小分子多肽的抗氧化能力显著高于粗肽(P<0.05)。杨方等[41]在接种L.plantarum的发酵白鲢鱼糜中发现分子质量较小的多肽快速增加。同时,对不同分子质量范围的多肽与抗氧化活性之间进行相关性分析,发现分子质量在1~5 kDa多肽与ABTS阳离子自由基清除率、DPPH自由基清除率之间有较好的相关性。这可能由于过长的肽链使一些具有抗氧化活性的氨基酸残基被包埋,而小分子多肽更容易捕获自由基中的电子[42]。以上结果说明,该发酵香肠多肽的抗氧化能力主要来源分子质量小于3 kDa的多肽。
2.6 发酵剂对发酵香肠游离氨基酸组成的影响

表3 发酵香肠中游离氨基酸组成Table 3 Free amino acid composition of fermented sausages
如表3所示,游离氨基酸是非蛋白氮的重要组成部分,它们对提升发酵肉制品的风味和营养价值有重要作用[43]。在总游离氨基酸含量上,接种组总游离氨基酸含量显著高于对照组(P<0.05),为对照组的1.43 倍,表明接种发酵剂具有良好的氨肽酶活性,可以显著提高发酵香肠中游离氨基酸的含量。除Asp、Ser外,其他游离氨基酸在接种组中的含量均显著高于对照组(P<0.05)。其中,Glu、Ala、Lys、Leu、Thr、Phe、Val在2 组中均有较大贡献,约占总游离氨基酸含量70%,与其他报道相似[44]。Glu有助于鲜味的表达;Ala、Thr有助于甜味的表达。Val、Leu是一些风味化合物重要的前体支链氨基酸,在接种组浓度较高。乳酸菌可将支链氨基酸通过转氨酶转化为相应的α-keto酸。这些酸可以进一步代谢为发酵香肠典型的香气化合物,如2-甲基丙酸和3-甲基丁烷分别来自Val和Leu[45]。Phe可以通过微生物转化为苯丙酮酸,然后氧化成苯甲醛,这也是在发酵肉类中典型的风味化合物。接种组中人体必需氨基酸的含量也显著高于对照组(P<0.05),总含量分别为420.42 mg/100 g和293.36 mg/100 g。Demeyer等[46]在来自意大利、比利时和挪威的香肠中发现成熟后期,碱性氨基酸Lys显著升高(P<0.05),与本实验结果相同。碱性氨基酸可与不饱和脂肪酸反应生成盐,从而抑制不饱和脂肪酸氧化反应的发生[47]。除此之外,具有抗氧化活性的氨基酸[48](Met、Tyr、His、Lys、Cys),在接种组中占总游离氨基酸的比例比对照组更高,分别为22.81%和25.59%。
3 结 论
本实验探究了接种发酵剂对发酵香肠蛋白质降解及多肽抗氧化能力的影响。结果表明,相比自然发酵,接种混合发酵剂L.plantarumCD101和S.simulansNJ201促进了发酵香肠蛋白质降解。发酵剂有助于NPN含量增加;微生物蛋白酶可以利用NPN生成小分子质量多肽。根据SDS-PAGE图谱,接种组在分子质量小于20 kDa条带处出现明显累积。从接种组提取的粗肽及分子质量小于3 kDa多肽的DPPH自由基清除活性、ABTS阳离子自由基清除活性及FRAP值均显著高于对照组,小分子多肽抗氧化能力均显著高于粗肽。同时接种发酵剂促进发酵香肠中游离氨基酸的释放,有助于提升发酵香肠风味及营养特性。这些结果为通过接种功能性微生物发酵剂产生内源性抗氧化肽从而抑制发酵香肠氧化提供新的思路。
