限制性酶解调控燕麦蛋白结构特性与抗氧化功能
2020-10-28郑召君李嘉欣李进伟刘元法
郑召君,王 曼,李嘉欣,李进伟,刘元法
(江南大学食品学院,江苏 无锡 214122)
近年来,蛋白质的市场需求量不断增加,加之动物蛋白价格不断攀升,开发利用来源广泛、成本低廉的植物蛋白已成为食品领域重点关注的话题。作为蛋白含量最高的禾谷类粮食作物,燕麦(Avena sativaL.)约含9.7%~17.3%的蛋白质,必需氨基酸含量丰富。据报道,燕麦蛋白的功效比值为2.25~2.38,蛋白质净利用率可达69.1%~72.4%,蛋白消化率为90.3%~94.2%,营养价值高且成本低,是开发人类食品的优质蛋白源[1]。然而,燕麦蛋白在食品体系常见的中性环境中性能较差,极大限制了其在人类食品中的推广应用[2]。因此,寻求适宜的方法提高燕麦蛋白性能是促进燕麦蛋白高效利用的必要条件。
酶解技术是目前提高蛋白质性能较为有效且常用的方法。蛋白酶作用于大分子蛋白使其降解为肽或氨基酸,有助于改变食物蛋白的结构特性,而结构又与其功能之间关系密切[3]。大量研究表明,酶解改变豌豆蛋白[4]、大米蛋白[5]、花生蛋白[6]和大麻蛋白[7]等植物蛋白的结构,进而改善其功能特性。上述研究也表明,过度水解限制蛋白特性的发挥,甚至产生异味,而限制性水解有利于提高蛋白的功能特性。限制性酶解可导致蛋白结构部分解离,改变其构象稳定性,从而暴露更多的可电离基团和疏水基团,降低蛋白分子质量并将肽片段释放到溶液中[8]。例如,芸豆蛋白经碱性蛋白酶水解制备酶解产物,其中水解度为4%的酶解产物具有良好的乳化稳定性和氧化稳定性[9]。由此可知,水解度是酶解改性的关键调控因子,而水解度高低受蛋白酶特异性的影响。木瓜蛋白酶是食品工业最常用的植物蛋白酶,其酶解产物多具有抗氧化等生物学潜能[10]。例如,Wang Bin等[11]利用木瓜蛋白酶水解锤头鲨肌肉蛋白,其酶解产物具有1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐阳离子自由基清除能力;Al-Shamsi等[12]研究发现,骆驼乳蛋白经木瓜蛋白酶水解后的抗氧化活性提高,有效抑制水包葡萄籽油乳液和鱼糜的脂质过氧化。
综上所述,蛋白酶水解调控蛋白的结构与功能,然而关于限制性酶解对燕麦蛋白结构与功能的影响尚不明确。因此,本实验选用燕麦蛋白为研究对象,利用木瓜蛋白酶对其进行限制性酶解,深入解析不同水解度条件下燕麦蛋白结构特性以及抗氧化功能的变化,进一步评价其在2 种食品体系中的抗氧化作用,以期为燕麦蛋白的深度开发及其在食品中的应用提供科学依据与理论参考。
1 材料与方法
1.1 材料与试剂
燕麦 十月稻田农业科技有限公司;木瓜蛋白酶(2 400 U/mg) 北京百灵威科技有限公司;DPPH、菲洛嗪 美国Sigma-Aldrich公司;二硫苏糖醇(DL-dithiothreitol,DTT)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 上海麦克林试剂公司;其他化学试剂均为分析纯。
1.2 仪器与设备
Sorvall Lynx 4000落地式离心机 美国Thermo Fisher公司;Ultrospec 7000PC紫外-可见分光光度计 美国通用电气公司;SpectraMax-190酶标仪 美谷分子仪器(上海)有限公司;台式恒温振荡器 上海博讯实业有限公司;FD-1A-50真空冷冻干燥机 上海豫明有限公司;Rancimat 892油脂氧化稳定仪 瑞士万通公司;Zetasizer nano ZS纳米粒度及ZETA电位仪 英国马尔文公司;F-7000荧光分光光度计 日本日立公司;Chirascan V100圆二色光谱仪 英国应用光物理公司;T25高速乳化均质机 英国IKA公司;偏振光显微镜德国徕卡公司。
1.3 方法
1.3.1 燕麦蛋白的制备
燕麦米粉碎后过80 目筛,所得燕麦粉以1∶4(g/mL)的料液比加入正己烷进行脱脂处理,磁力搅拌3 h后过滤去除正己烷,随后以料液比1∶6(g/mL)加入正己烷搅拌脱脂6 h,去除滤液后的滤饼置于通风橱中过夜风干获得脱脂燕麦粉。之后以脱脂燕麦为原料,参考Zhong Lei等[13]方法采用碱溶酸沉法提取燕麦蛋白并进行冷冻干燥成粉,凯氏定氮法测定其蛋白质质量分数为(80.03±2.60)%。
1.3.2 燕麦蛋白酶解
称取适量燕麦蛋白粉溶于去 离 子 水 ( 1∶10, g/mL) ,100 Hz超声处理45 min,调节溶液至木瓜蛋白酶最适酶解pH 7.0,将底物溶液置于55 ℃恒温振荡器中保温10 min后加入2%木瓜蛋白酶开始酶解,当水解度分别达到2%、3%、4%、5%、6%和7%时收集酶解样品(实际水解度分别为1.95%、3.02%、4.22%、5.07%、6.23%和6.99%),置于90 ℃水浴锅中灭活15 min,而后冷却至室温,调节酶解液pH值至中性,8 000 r/min离心15 min,收集上清液并冷冻干燥成粉,燕麦蛋白肽粉置于-20 ℃密封保存备用。水解度参考Nielsen等[14]的邻苯二甲醛法进行测定。
1.3.3 Tricine十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
根据Schägger[15]的Tricine SDS-PAGE方法,采用4%浓缩胶和16%分离胶分析燕麦蛋白及其酶解产物的分子质量分布,上样量为15 μL。在恒压30 V状态下开始电泳,待样品进入分离胶后调节电压为110 V。电泳结束后,对蛋白凝胶进行考马斯亮蓝染色以及甲醇-冰醋酸脱色,置于凝胶成像仪中采集电泳图像。
1.3.4 紫外吸收光谱测定
燕麦样品溶于超纯水配制成蛋白质量浓度为0.10 mg/mL的溶液,以超纯水作空白,利用紫外分光光度计对其进行紫外扫描,扫描波长范围为200~800 nm,记录紫外扫描图谱。
1.3.5 圆二色光谱测定
利用超纯水将燕麦蛋白及其酶解产物稀释至0.10 mg/mL,采用圆二色光谱仪分析其二级结构。扫描波长范围为185~265 nm,扫描速率为100 nm/min,光径为1 mm,3 次平行测样,结果以摩尔椭圆率θ表示。
1.3.6 外源性荧光光谱测定
参考Evangelho等[16]的方法,采用外源性荧光探针ANS检测燕麦蛋白及其酶解产物的表面疏水性变化。首先将样品溶于10 mmol/L磷酸盐缓冲液(pH 7.0)配制成蛋白质量浓度为1 μg/mL的溶液,而后在1.5 mL样品稀释溶液中加入20 μL ANS(8 mmol/L)并混匀,置于荧光分光光度计进行光谱扫描,扫描波长范围400~700 nm,激发波长390 nm,狭缝宽度为5.0 nm。
1.3.7 抗氧化活性测定
1.3.7.1 DPPH自由基清除率测定
参考Arise等[17]的方法,并稍作修改。分别将燕麦蛋白及其酶解产物等比倍比稀释,取50 μL稀释液与50 μL 0.1 mmol/L DPPH-无水乙醇溶液混合均匀,室温下避光静置30 min后,于517 nm波长处测定样品的吸光度,按式(1)计算酶解前后燕麦蛋白的DPPH自由基清除率:
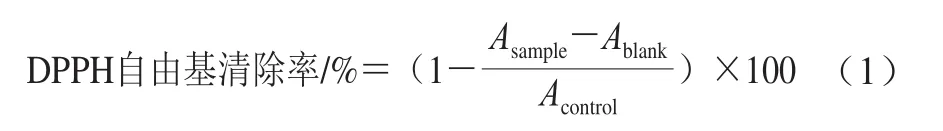
式中:Asample为加入燕麦蛋白及其酶解产物后DPPH溶液的吸光度;Ablank为燕麦蛋白及其酶解产物的吸光度;Acontrol为未加燕麦蛋白及酶解产物时DPPH溶液的吸光度。
1.3.7.2 金属离子螯合能力测定
参考Taheri等[18]的测定方法,略作修改。将蛋白样品进行等比倍比稀释,取50 μL稀释液依次与100 μL FeCl2溶液(20 μmol/L)、100 μL菲洛嗪(0.5 mmol/L)溶液混匀,室温孵育10 min,于波长562 nm处测定反应液的吸光度As。同时,以50 μL超纯水替代稀释液作为对照组,测其吸光度A1,50 μL酶解液与200 μL超纯水作为空白组,测吸光度A0,按式(2)计算金属离子螯合能力:
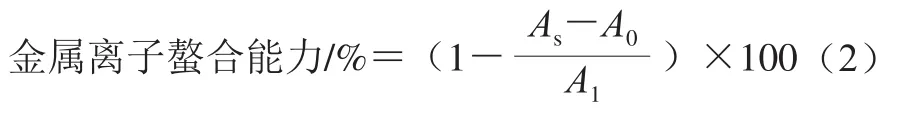
1.3.8 氧化诱导时间测定
参考Teixeira等[19]的方法,测定燕麦蛋白肽对葵花籽油氧化诱导时间的影响。称取3.0 g葵花籽油与质量分数0.5%燕麦蛋白肽或质量分数0.5‰生育酚混合均匀,超声处理1 h后置于油脂氧化稳定仪,温度(120±1.6)℃、气流速率1.0 L/h条件下测定其氧化诱导时间。
1.3.9 乳液氧化稳定性评价
将30%葵花籽油、1%吐温20以及69%超纯水混合,于室温条件下磁力搅拌30 min,然后用高速乳化均质机在12 000 r/min条件下均质2 min,再经高压均质处理获得乳液。随后加入0.4 g/L燕麦蛋白肽或谷胱甘肽均质混匀,无抗氧化剂添加的乳液作为对照。硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)法测定丙二醛(次级氧化产物)含量,具体方法如下:取1.5 mL乳液与1.0 mL 0.01 g/mL硫代巴比妥酸溶液以及2.5 mL 0.1 g/mL三氯醋酸溶液充分混匀,沸水浴孵育30 min后冰浴冷却5 min,2.5 mL溶液与等体积三氯甲烷混匀并在4 500 r/min离心10 min,收集上清液以测定波长532 nm处吸光度。
1.4 数据统计与分析
本研究所有数据至少重复测定3 次,采用JMP 13统计软件中的Student’s法检验数据的差异显著性,并通过OriginPro 2016软件作图。
2 结果与分析
2.1 限制性水解燕麦蛋白的电泳分析
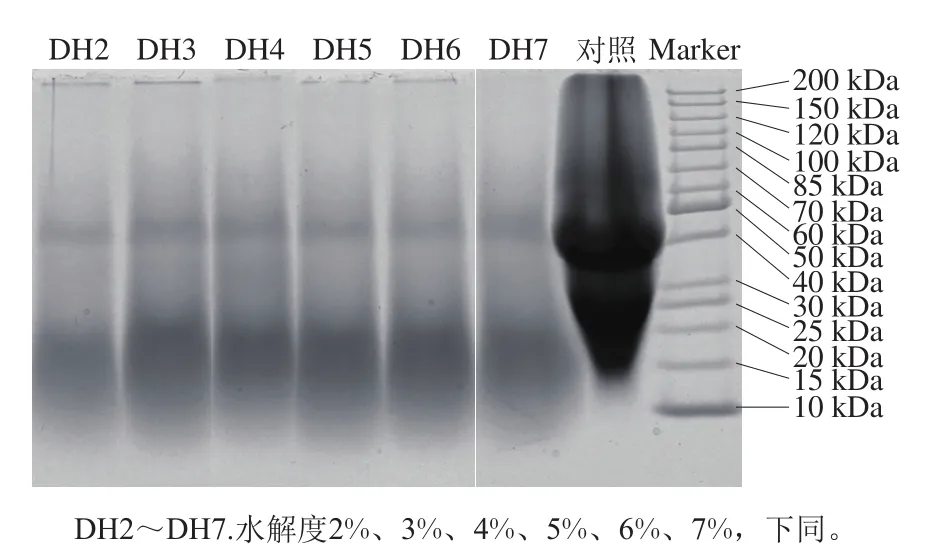
图1 不同水解度的燕麦蛋白SDS-PAGE图Fig.1 SDS-PAGE patterns of oat protein isolate hydrolysates with different DHs
如图1所示,未经酶解处理的燕麦蛋白(对照)显示出2 条清晰的电泳条带,其分子质量主要集中在35~45 kDa和20~30 kDa之间,分别对应燕麦球蛋白中的酸性多肽链和碱性多肽链[20]。而经木瓜蛋白酶水解的燕麦蛋白的电泳图谱发生明显变化,40 kDa左右的蛋白条带明显变浅,且随着水解程度加剧,蛋白条带逐渐模糊不清,表明该类蛋白被大量水解。同时发现小于20 kDa的蛋白条带显著增多,说明大分子蛋白被木瓜蛋白酶降解为分子质量较小的肽段。在水解度2%~7%条件下,随水解度增加蛋白条带呈轻微变浅趋势,这与Ahmadifard等[21]利用木瓜蛋白酶水解大豆蛋白和米糠蛋白以及Xu Xingfeng等[5]利用胰蛋白酶水解大米谷蛋白(水解度0.5%~6%)的电泳结果相似。整体看,木瓜蛋白酶作用于燕麦球蛋白的酸性多肽和碱性多肽等片段,致使大分子蛋白降解产生小分子肽。
2.2 限制性水解对燕麦蛋白结构特性的影响
2.2.1 紫外-可见光光谱分析

图2 不同水解度下燕麦蛋白紫外吸收光谱变化Fig.2 Effects of enzymatic hydrolysis on UV-Vis spectrum of oat isolate protein
如图2可知,燕麦蛋白及其酶解产物在可见光区域没有明显变化,而在200~350 nm波长处存在紫外特征吸收峰(280 nm和210 nm左右)。酶解前后的燕麦蛋白均在波长280 nm处有相对弱的紫外吸收峰,这主要是因为肽链中酪氨酸和色氨酸的π→π*跃迁产生了吸收带[22-23]。而在波长210 nm左右存在的强吸收峰是肽键中C=O发生n→π*跃迁所形成的经典肽吸收峰[24]。酶解前后燕麦蛋白的紫外吸收光谱存在明显差别,主要表现在峰形和峰强度。与未酶解的对照组相比,燕麦蛋白酶解产物的特征吸收峰窄而尖,且紫外光谱发生蓝移,这可能是因为酶解导致肽键断裂,暴露芳香族发色团并改变蛋白构象[25-26]。此外,在较低水解度(水解度2%~6%)时,燕麦蛋白酶解产物的紫外吸收峰的峰形、峰位以及峰强度变化不明显,然而其峰强度在水解度7%时达到最高值,这是由于蛋白内部的芳香族氨基酸残基如苯丙氨酸、酪氨酸和色氨酸等随水解进程而释放于水中,从而增加了紫外吸收强度。
2.2.2 圆二色光谱分析
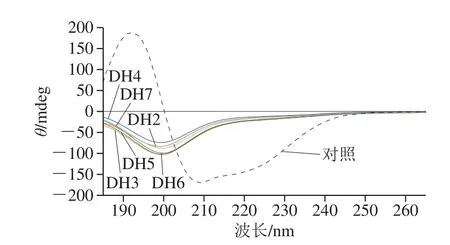
图3 不同水解度下燕麦蛋白圆二色光谱变化Fig.3 Effects of enzymatic hydrolysis on CD spectrum of oat isolate protein
如图3所示,未经酶解的燕麦蛋白在波长190~200 nm处呈正峰,波长208 nm和220 nm左右有负峰,表明其具有α-螺旋结构;同时在波长210~220 nm有负峰,表明β-折叠结构的存在,这与Zhong Lei等[13]的研究结果一致。而经过木瓜蛋白酶水解后,α-螺旋的含量明显下降,向β-转角和无规卷曲等二级结构形式转化,类似的现象也发现于酶解的大豆蛋白中[26-27]。此外,燕麦蛋白在水解度2%~7%时以无规卷曲结构为主,表明蛋白经酶解后由有序变得无序,二级结构遭到明显破坏。Lin Songyi等[28]研究发现,抗氧化五肽SHCMN的部分α-螺旋转换成无规卷曲和β-转角结构,有助于活性位点暴露,进而提高其抗氧化能力。由此推知,酶解后的燕麦蛋白应具有较强的抗氧化潜能。
2.2.3 荧光光谱分析
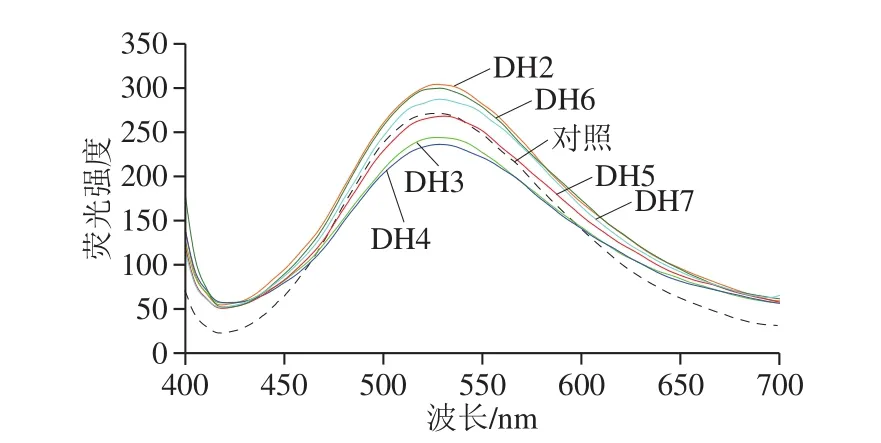
图4 不同水解度下燕麦蛋白荧光光谱变化Fig.4 Effects of enzymatic hydrolysis on fluorescent spectrum of oat isolate protein
酶解前后的燕麦蛋白构象发生改变,而决定其构象的关键因素之一是蛋白的表面疏水性。ANS是测定蛋白表面疏水性最常见且有效的荧光探针,其与蛋白质结合产生的荧光强度与疏水性呈正相关[5,22]。基于此,本实验选用ANS荧光探针研究燕麦蛋白酶解前后的疏水性差异。如图4所示,与未酶解处理的对照组相比,燕麦蛋白在水解度2%时荧光强度显著增加并达到峰值,这表明木瓜蛋白酶水解破坏蛋白质分子,从而暴露其内部的疏水基团。而随着水解度逐渐增加,荧光强度反而降低,这说明随着水解进行,暴露出的部分疏水氨基酸残基被掩埋,更多的亲水基团被释放于极性环境中,蛋白质结构被破坏[29]。
2.3 限制性水解对燕麦蛋白Zeta电位的影响
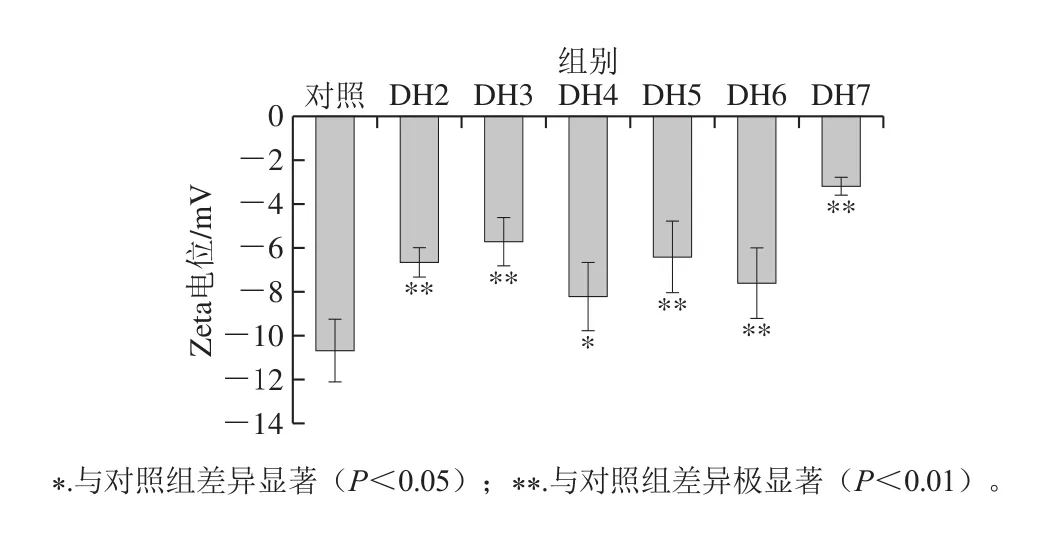
图5 燕麦蛋白水解过程Zeta电位变化Fig.5 Change in zeta-potential of oat protein isolate during limited hydrolysis
蛋白质Zeta电位大小主要受带电基团以及氨基酸残基分布的影响[30]。由图5可知,酶解前后的燕麦蛋白Zeta电位均表现为负值,表明其表面带有大量负电荷,静电斥力使颗粒散落分布而不易发生聚集[31]。所有酶解产物的电位绝对值均显著低于未酶解的燕麦蛋白(P<0.05),其原因可能是酶解过程释放的带正电荷氨基酸多于带负电荷的氨基酸。就酶解产物而言,Zeta电位绝对值的变化趋势为水解度4%>6%>2%>5%>3%>7%,但除末者(水解度7%)外,各酶解产物间的负电位差距不明显(P>0.05),这说明低水解度对酶解产物的Zeta电位影响甚微。
2.4 限制性水解对燕麦蛋白抗氧化活性的影响
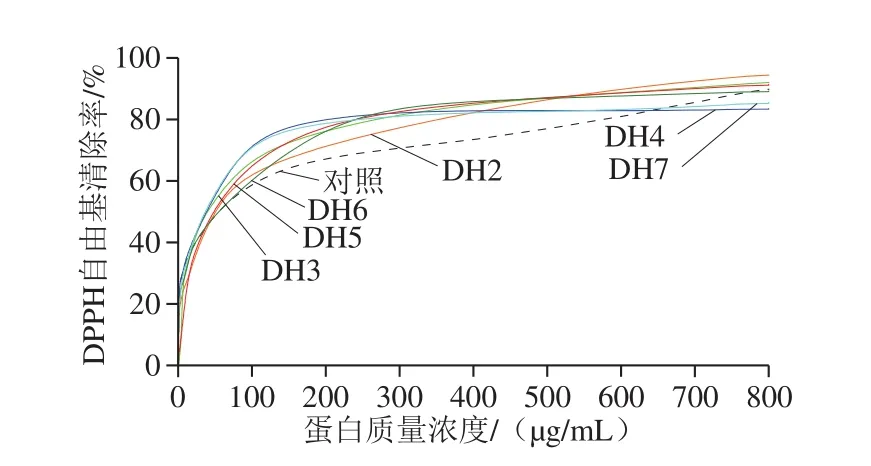
图6 水解对燕麦蛋白DPPH自由基清除率的影响Fig.6 Effects of enzymatic hydrolysis on DPPH radical scavenging activity of oat protein isolate
如图6所示,燕麦蛋白及其酶解产物的DPPH自由基清除率随蛋白质量浓度的增加而呈逐渐上升趋势,直至达到稳定水平。燕麦蛋白酶解产物的DPPH自由基清除速率均高于未酶解的对照组,表明酶解有助于活性肽段的释放,从而提高其抗氧化能力。不同水解度酶解产物的DPPH自由基清除率各有差异,其中水解度4%和水解度7%具有最高的DPPH自由基清除速率,IC50分别为36.83 μg/mL和37.68 μg/mL;而水解度6%和水解度2%清除DPPH自由基速率最低,其IC50分别为51.46 μg/mL和57.45 μg/mL。此外,燕麦蛋白的水解度与其DPPH自由基清除率无直接相关关系,这与已有研究报道结果一致[32-34]。整体来说,燕麦蛋白酶解产物水解度4%的DPPH自由基清除率最强。
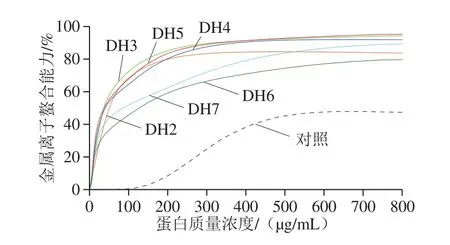
图7 水解对燕麦蛋白金属离子螯合能力的影响Fig.7 Effect of enzymatic hydrolysis on metal ion chelating activity of oat protein isolate
由图7可知,与DPPH自由基清除率相似,燕麦蛋白及其酶解产物的金属离子螯合能力呈现明显的质量浓度依赖性。而未经酶解的燕麦蛋白展现出较低的金属离子螯合速率,其金属离子螯合能力低于50%。相反地,燕麦蛋白经酶解后均展现出优秀的金属离子螯合能力,尤其是水解度在2%~5%之间时,其IC50维持在33 μg/mL左右,如水解度4%时,IC50为33.42 μg/mL。然而随着水解度上升至6%或7%,酶解产物的金属离子螯合能力略有下降,其IC50分别为51.95 μg/mL和50.11 μg/mL。综合而言,燕麦蛋白酶解产物的金属离子螯合能力显著优于前期报道的植物源蛋白酶解产物,如大麻蛋白[35]、大豆蛋白[36]以及菜籽蛋白[37]等。
2.5 燕麦蛋白肽对葵花籽油氧化稳定性的影响
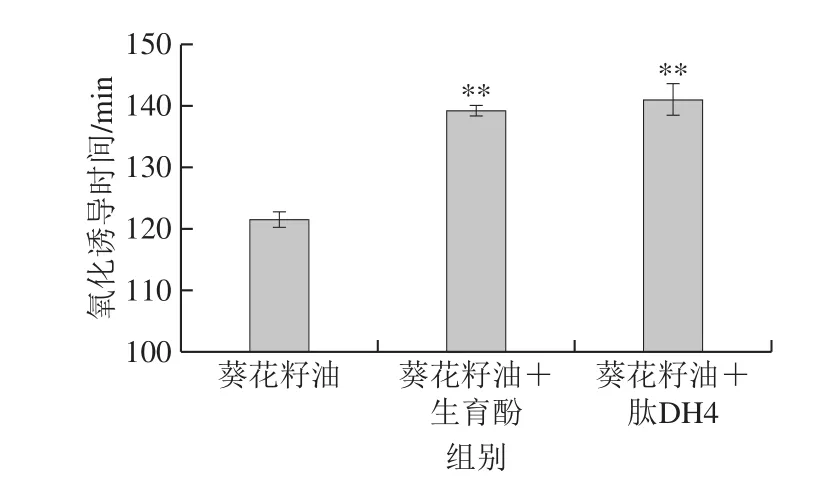
图8 燕麦蛋白肽DH4对葵花籽油氧化诱导时间的影响Fig.8 Effect of oat protein peptide with 4% DH on the induction period of sunflower oil
燕麦蛋白在水解度为4%时具有适宜的理化特性以及最佳抗氧化活性,因此本实验进一步分析水解度4%的燕麦蛋白肽(简称为肽DH4)对不饱和植物油氧化稳定性的影响。氧化诱导时间是衡量油脂氧化稳定性的通用指标,主要表征油脂在高温条件下快速生成氧化产物所需时间[38]。如图8所示,未添加抗氧化剂的葵花籽油的氧化诱导时间为(121.50±1.27)min,极显著低于含有生育酚和肽DH4的葵花籽油(P<0.01)。添加肽DH4的葵花籽油的氧化诱导时间为(141.00±2.55)min,高于添加生育酚的葵花籽油(139.20±0.85)min。由此可见,燕麦蛋白肽DH4可有效延缓葵花籽油的氧化诱导时间,这可归因于其良好的自由基清除能力,抑制自由基链式反应,从而抑制过氧化物的形成。
2.6 燕麦蛋白肽对乳液氧化稳定性的影响
食品等反应体系的复杂性直接影响抗氧化剂的活性,因此通过对TBARS(油脂次级氧化产物)进行测定以评估燕麦蛋白肽DH4对水包葵花籽油乳液氧化稳定性的影响。从图9可以发现,乳液的TBARS含量随存储时间的延长而逐渐上升,在第6天时达到最大值(2.46±0.03)mg/kg。相较而言,谷胱甘肽和肽DH4的添加可有效抑制TBARS的生成,其中肽DH4的作用效果最为显著。值得注意的是,含有肽DH4的乳液在存储4 d内的TBARS含量最低,始终维持在2.0 mg/kg以下,且在存储8 d后仍显示出低的TBARS含量(1.37±0.01)mg/kg,相较于无抗氧化剂添加的乳液,肽DH4可降低43.27%的TBARS产量。

图9 燕麦蛋白肽DH4对水包油乳液氧化稳定性的影响Fig.9 Effects of oat protein peptide with 4% DH on the oxidative stability of sunflower oil-in-water emulsion

图10 燕麦蛋白肽DH4对水包油乳液氧化稳定性的影响Fig.10 Effect of oat protein peptide with 4% DH on the oxidative stability of sunflower oil-in-water emulsion
由图10可知,无抗氧化剂添加的乳液体系中乳滴形状规则且分布均匀,乳滴粒径较小且大小均一,但贮存4 d后发生聚集形成大乳滴,乳液逐渐趋于不稳定状态。而添加谷胱甘肽的乳液在贮存1 d后就出现乳滴大小不均一现象,且随着时间的延长,颗粒尺寸变大,说明谷胱甘肽降低了乳液的稳定性。相较于谷胱甘肽,燕麦蛋白肽DH4添加的乳液在6 d贮藏期内液滴较小且较为均一,这与上述TBARS产量的结果较为一致。究其原因,可能是带负电荷的燕麦蛋白肽DH4形成的静电斥力使乳滴均匀分布,从而保证乳液显示出良好的稳定性[39-40]。而乳液在贮藏末期(8 d)出现部分聚集,这可能是由于氧化产物的生成以及小肽从油/水界面的解吸造成的。
3 结 论
本研究利用木瓜蛋白酶对燕麦蛋白进行限制性酶解,系统表征了低水解度条件下燕麦蛋白结构特性以及抗氧化功能,并探讨了抗氧化活性强的燕麦蛋白肽对含油食品体系氧化稳定性的影响。结果表明,经木瓜蛋白酶水解后燕麦蛋白的分子质量由大分子蛋白向小分子肽迁移,进而影响其结构特性。与未酶解的对照组相比,酶解后燕麦蛋白的紫外吸收光谱发生蓝移,荧光光谱结果显示蛋白三级结构发生明显变化。此外,木瓜蛋白酶限制性酶解使燕麦蛋白由有序的α-螺旋结构向无序的无规卷曲和β-转角结构转换,说明酶解后蛋白结构被破坏,活性位点暴露,有助于提升燕麦蛋白的抗氧化潜能。酶解后的燕麦蛋白DPPH自由基清除率和金属离子螯合能力显著提高,尤其是在水解度为4%时,IC50分别为36.83 μg/mL和33.42 μg/mL。此外,燕麦蛋白肽DH4可显著提供葵花籽油的氧化诱导时间并提高乳液的氧化稳定性,在油脂、乳液体系等食品工业中具有重要的理论指导意义以及潜在的应用价值。
