葛根素通过SIRT1/PGC-1α信号通路对2型糖尿病小鼠胰腺线粒体的氧化应激损伤保护作用的研究
2020-10-28徐小惠黄英华黄燕军
徐小惠,黄英华,陈 铭,黄燕军,梁 韬
(广西医科大学 1.附属肿瘤医院药学部, 2.附属口腔医院药剂科,3.药学院,广西 南宁 530021)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种潜在威胁生命健康的内分泌代谢性的全球性疾病,机体自身生理或病理缺陷的因素或过量饮食及运动不足等原因造成的肥胖,都会导致机体胰岛β细胞分泌的胰岛素障碍,进而引起高血糖。在全球约4.4亿的糖尿病患者中,90%属于T2DM,而且T2DM的发病率呈年轻化的趋势,已成为严重影响人类健康及生活质量的公共卫生问题[1]。临床上,常选择注射外源性胰岛素或口服抗糖尿病药物来治疗T2DM[2]。但T2DM的治疗失效窗窄,及在治疗后易出现低血糖、体重增加等副作用现象,限制了其在临床上的广泛使用。且大部分药物是在压榨已受损的胰岛组织的基础上增加胰岛素分泌维持机体的血糖平衡,并未对受损的胰腺组织进行修复,故难以阻止胰腺功能的逐步减退[3]。因此积极探索T2DM的作用靶点及治疗药物,对于T2DM的防治具有十分重要的现实意义。
豆科多年生落叶藤本植物野葛PuerarinLobata(Wild)Ohwi根部中主要成分异黄酮类化合物葛根素(puerarin,PR)对T2DM、糖尿病肾病、糖尿病心肌炎、等糖尿病并发症均有良好的治疗效果[4-5]。国内外的研究及本课题组的前期研究已证实,PR能有效的降低T2DM的空腹血糖(fasting blood glucose,FBG),提升血清胰岛素水平,改善氧化应激胰腺组织功能及线粒体结构的损伤[6-7]。而我们前期的研究证实,PR调控糖代谢紊乱及氧化应激机制与SIRT1、PGC-1α蛋白及相关因子有关。但PR对该通路的上游、下游因子的作用仍需进一步探讨研究,如相关下游通路、组织中的能量及ROS合成、线粒体呼吸链变化规律等。故本研究以链脲佐菌素(streptozotocin,STZ)与高脂高糖饮食联合诱导的方法构建的T2DM模型,探讨PR通过沉默信息调节因子2 相关酶1 (silent mating type information regulation 2 homolog 1,SIRT1)/过氧化物酶体增殖物激活受体γ 辅助激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)信号通路对T2DM小鼠胰腺的线粒体氧化应激损伤的保护作用。
1 材料
1.1 实验动物SPF级,体质量(20±2)g的昆明种小鼠60只,♀♂各半,购自广西医科大学实验动物中心,合格证号:SCXK(桂)2019-0005。小鼠饲养于通风良好的环境,室温(18~25) ℃,相对湿度40%~70%,12 h光照昼夜循环。本研究已经过广西医科大学伦理委员会批准。
1.2 药品与试剂二甲双胍片,海南皇隆,181221;STZ,Sigma公司,B1943;羟自由基(hydroxyl free radical,·OH)、活性氧(reactive oxygen species,ROS)、三磷酸腺苷(adenosine triphosphate,ATP)试剂盒均购于南京建成生物工程研究所,批号:190719、190726、190724;锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)、过氧化氢酶(catalase,CAT)ELISA试剂盒均购于晶美生物工程有限公司,批号:20190815、20190807;线粒体呼吸链复合物Ⅰ、Ⅲ、Ⅳ(mitochondrial respiratory chain complexⅠ、Ⅲ、Ⅳ, Complex Ⅰ、Ⅲ、Ⅳ)试剂盒均购于南京建成生物工程研究所,批号:190722、190727、190721;cDNA逆转录试剂盒,Fermentas公司,批号:00019014;总RNA提取试剂盒,天根公司,批号:K1984;线粒体融合素1(Mitofusins 1,Mfn1)、视神经萎缩蛋白1(optic atrophy 1,OPA1)、NF-E2相关因子1(NF-E2 related factor 1,NRF1)、线粒体转录因子A(mitochondrial transcription factor A,TFAM)一抗均购自英国Abcam公司。
1.3 主要仪器血糖仪(ACCU-CHEK Performa); 9602A-酶标仪(北京艾普生设备有限公司);ABI VeritiRT-PCR仪(ABI公司);Mini-Protean Tetra垂直电泳仪、转膜及显影设备(美国Bio-Rad公司);GelDoc EZ凝胶电泳成像分析系统(美国Bio-Rad公司)。
2 方法
2.1 T2DM小鼠模型建立及分组、给药根据文献[5],向小鼠尾静脉注射低剂量STZ 25 mg·kg-1,高脂高糖饲料喂养8周后,检测小鼠FBG。将FBG≥11.1 mmol·L-1的小鼠以随机数字表法随机分成模型组(Mod)、二甲双胍组(Metformin) 40 mg·kg-1·d-1、PR-20组(PR 20 mg·kg-1·d-1)、PR-40组(PR 40 mg·kg-1·d-1)、PR-80组(PR 80 mg·kg-1·d-1),各组小鼠连续灌胃8周,每日1次。另设10只小鼠为空白对照组(Con),尾静脉注射等体积的生理盐水,普通饲料喂养。空白和模型对照组灌胃给予等量生理盐水。
2.2 胰腺线粒体的分离提取[8]将胰腺组织剪碎后放置于离心管中,加入预冷1 000 μL PBS液,冰浴3 min后,600×g的转速4 ℃下离心30 s,弃上清液后,加入4 ℃的胰酶消化液80 μL后冰浴条件下放置20分钟。600×g转速离心30 min,弃上清液。加入预冷的线粒体分离试剂,600×g的转速离心30 s,弃上清液。低温条件下再次加入预冷的线粒体分离试剂后匀浆。1 200×g的转速离心15 min,弃上清液后得到胰腺组织线粒体沉淀。所有离心均在4 ℃温度下进行。
2.3 Western blot 法检测胰腺组织中加入RIPA 强效裂解液( 含1% PMSF) 制成约10%的匀浆液,冰上静置30 min 后,放置于4 ℃ 高速冷冻离心机,转速12 000 r·m-1离心5 min,分离上清液至新的EP 管中,提取胰腺组织中总蛋白。将配置好SDS-PAGE 胶置于电泳槽中,待用蛋白置于水锅中煮沸5 min 后,混匀,上样孔中分别加入Marker及样品蛋白20 μL,转移至PVDF膜,5%脱脂奶粉封闭,洗膜,加入相对应的一抗,4 ℃环境下孵育过夜, TBST 溶液洗膜,加入稀释的二抗,水平摇床中孵育60 min,TBST 溶液洗膜,暗室中曝光显影。GelDoc EZ凝胶电泳成像分析系统扫描,ImageJ 软件分析蛋白条带,β-actin 蛋白条带校正。
2.4 Real time PCR(RT-PCR)法检测按试剂盒说明书方法提取胰腺组织中的总RNA。将提取的总RNA反转录为cDNA,根据SIRT1、PGC-1α基因序列设计引物( Tab 1)。反应条件:60 ℃,30 s;95 ℃,30 s,95 ℃,3 s;PCR 扩增40 个循环。每批模板均同时进行内参β-actin 和目的基因的扩增反应。
2.5 观察指标给药结束后,血糖仪检测FBG。切除部分胰腺组织,10%多聚甲醛固定后进行HE染色,观察其病理变化。试剂盒法检测胰腺组织中·OH、ROS含量。ELISA法检测胰腺组织中MnSOD、CAT的活性。试剂盒检测胰腺组织中ATP及线粒体的ComplexⅠ、Ⅲ、Ⅳ的活性。蛋白免疫印迹法检测胰腺组织中线粒体生物合成因子NRF1、TFAM、线粒体融合因子Mfn1、OPA1的蛋白表达。RT-PCR检测SIRT1、PGC-1α mRNA在胰腺中的表达。
3 结果
3.1 PR对T2DM小鼠FBG的影响与空白组相比,模型组小鼠经链脲佐菌素诱导后空腹血糖明显升高(P<0.05)。与模型组比较,PR各给药剂量组小鼠和二甲双胍组小鼠FBG均降低(P<0.05)(Tab 2,Fig 1)。
3.2 PR对T2DM小鼠胰腺组织的病理学观察空白组小鼠胰岛结构饱满整齐、无萎缩情况,且数量较多。模型组小组胰腺组织中胰岛较分散,胰岛数目较少,形成呈长条撕裂型,同时空泡化严重,可见核固缩或核缺失的死亡细胞。二甲双胍组小鼠胰岛结构及胰岛细胞内排列较完整均匀,有轻度萎缩,空泡化程度低,核缺失的死亡细胞少。葛根素各给药组小鼠胰岛数目及胰岛内细胞数目增加,胰岛形态及萎缩程度有所好转,空泡数量及死亡细胞较模型组少(Fig 2)。
Tab 2 Changes in FBG of mice in each
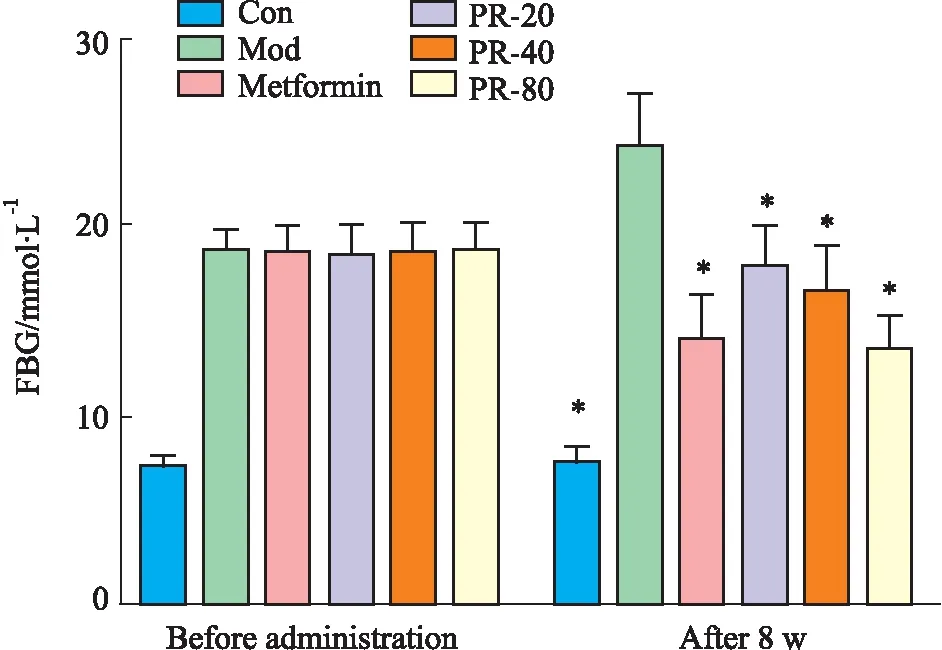
Fig 1 Changes in FBG of mice in each group
3.3 PR对T2DM小鼠胰腺组织中·OH、ROS含量及Mn-SOD、CAT活性的影响与空白组相比,模型组小鼠胰腺组织中·OH、ROS含量明显增加,Mn-SOD、CAT的活性降低(P<0.05)。二甲双胍、PR各剂量干预组小鼠胰腺组织·OH、ROS含量显著降低,Mn-SOD、CAT的活性增加(P<0.05)(Tab 3)。
3.4 PR对T2DM小鼠胰腺线粒体的ComplexⅠ、Ⅲ、Ⅳ活性和腺组织中ATP含量的影响与空白组相比,模型组小鼠胰腺线粒体ComplexⅠ、Ⅲ、Ⅳ活性降低和胰腺组织ATP含量明显减少(P<0.05)。与模型组相比,二甲双胍、葛根素各剂量干预组小鼠胰腺线粒体ComplexⅠ、Ⅲ、Ⅳ活性提高和胰腺组织ATP含量增加(P<0.05)(Tab 4,Fig 3)。

Fig 2 Pathological observation of PR on pancreastissues of T2DM mice(×400)
3.5 PR对T2DM小鼠胰腺中NRF1、TFAM、Mfn1、OPA1蛋白表达的影响与空白组相比,模型组小鼠胰腺组织中线粒体生物合成因子TFAM、NRF1及线粒体融合因子Mfn1、OPA1蛋白表达减少(P<0.05)。与模型组相比,二甲双胍、PR各剂量干预组小鼠胰腺的线粒体生物合成因子TFAM、NRF1及线粒体融合因子Mfn1、OPA1蛋白表达增加(P<0.05)(Tab 5,Fig 4)。
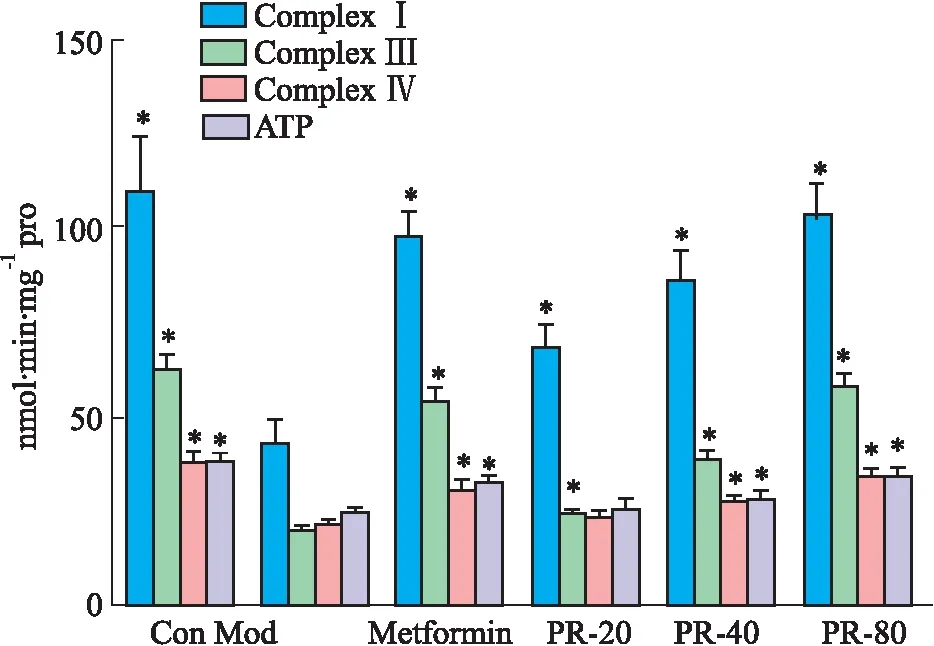
Fig 3 Changes of ComplexⅠ,Ⅲ,Ⅳ activity and ATPcontent in each group
3.6 PR对T2DM小鼠胰腺组织中SIRT1、PGC-1α mRNA表达的影响模型组小鼠胰腺组织SIRT1、PGC-1α mRNA表达较空白组少(P<0.05)。与模型组相比,二甲双胍、葛根素各剂量干预组小鼠胰腺SIRT1、PGC-1α mRNA表达增加(P<0.05)(如Tab 6,Fig 5)。
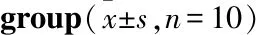
Tab 3 Changes of ·OH, ROS content and Mn-SOD, CAT activity in each
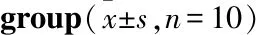
Tab 4 Changes of Complex I, III, IV activity and ATP content in each
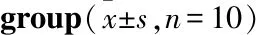
Tab 5 Changes of NRF1, TFAM, Mfn1, OPA1 protein expression in each

Tab 6 Changes of SIRT1 and PGC-1α mRNA expression
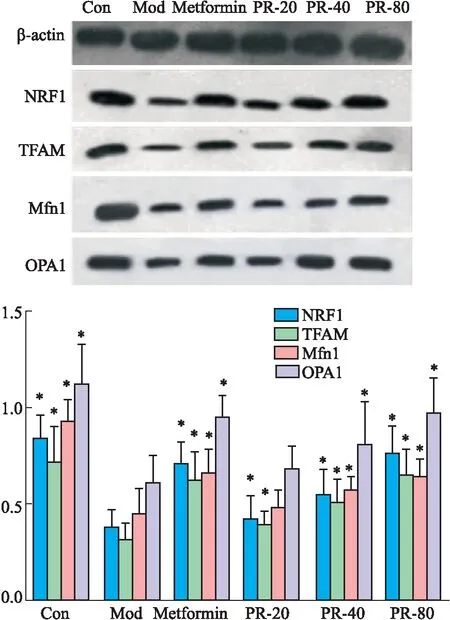
Fig 4 Changes of NRF1, TFAM, Mfn1 and OPA1 proteinexpression in each group
4 讨论
SIRT1属于Sirtuins蛋白家族,可通过去乙酰化活化其下游的PGC-1α、FOXO、p53等多种蛋白质和转录因子,对机体的糖脂代谢、氧化应激、细胞凋亡、线粒体呼吸功能有着调节功能[9],对细胞恢复能量代谢稳态及氧化应激稳态有着重要的影响作用。PGC-1α是SIRT1所调控的下游蛋白,其不仅可促进线粒体生物合成,还增强不同组织细胞有氧呼吸功能[10]。

Fig 5 Changes of SIRT1 and PGC-1α mRNAexpression in each group
研究认为,线粒体氧化应激产生的过多ROS是导致IR、β细胞的结构受损及功能障碍的关键因素[11-12]。高脂高糖的内环境可促使胰腺组织中线粒体呼吸链的代谢过程中产生大量的ROS、·OH,但由于组织中Mn-SOD、CAT活性下降,对ROS、·OH的清除能力下降,ROS、·OH在组织及线粒体内堆积增加而造成对胰腺及胰腺中的线粒体内外膜造成氧化应激损伤,使线粒体相关的基质蛋白表达、酶类、呼吸链复合物活性降低,合成ATP的能力下降,从而加剧氧化应激对胰腺的损伤[13]。本研究结果表明,PR能提高胰腺组织中CAT、Mn-SOD的活性及ATP含量,降低·OH、ROS的含量,同时增加胰腺线粒体中ComplexⅠ、Ⅲ、Ⅳ活性。
线粒体生物合成因子TFAM、NRF1和线粒体融合因子Mfn1、OPA1是反映线粒体生物学特性的敏感指标,其表达水平在一定程度上代表线粒体的功能状态,是保证膜结构完整及维持正常膜电位,防止细胞凋亡的重要因子[14]。线粒体利用不断分裂、融合可达到其在细胞内的动态平衡,而线粒体的融合和分裂间的平衡与线粒体呼吸所产生的氧自由基的量有着密切的关系[15]。TFAM、NRF1、Mfn1、OPA1的表达受到PGC-1α的诱导,调控着线粒体氧化磷酸化复合物的表达[16]。本研究结果表明,PR能增加胰腺组织中NRF1、TFAM、 Mfn1、OPA1蛋白及SIRT1、PGC-1α mRNA表达。
综上所述,PR能降低2型糖尿病小鼠的血糖、增加抗氧化因子CAT、Mn-SOD的活性,增强对ROS、·OH的清除能力,提高线粒体生物合成因子TFAM、NRF1及线粒体融合因子Mfn1、OPA1蛋白表达,改善氧化应激对胰腺的病理损伤,从而达到对T2DM小鼠的抗糖尿病作用,其作用机制与PR调控SIRT1/PGC-1α信号通路有着密切的关系。另外,胰腺的线粒体功能、结构、数量对T2DM的发生、病情的进展有着重要的联系。而线粒体功能调节、形态结构的改善需要通过减少氧化应激及维持线粒体融合与分裂的动态平衡。通过干预T2DM线粒体融合与分裂、减少ROS的生成及堆积,改善氧化应激损伤,可能是机体改善T2DM 的途径之一。
(致谢:本实验研究在广西医科大学口腔医院和广西医科大学科学实验中心进行,在此非常感谢各位实验人员对本实验研究所付出的艰辛和努力。)