归芪多糖延缓细胞衰老的分子作用机制
2020-10-28罗阿苗蒲秀瑛张凯丽田昌义柴鹏弟夏晓雨
罗阿苗,蒲秀瑛,张凯丽,田昌义,陈 博,苏 慧,柴鹏弟,夏晓雨
(兰州理工大学 生命科学与工程学院,甘肃省中藏药筛选评价及深加工重点实验室,兰州 730050)
衰老是指人体对环境的生理和心理适应性逐渐下降并逐渐死亡的现象,它涉及细胞、组织、器官和全身水平的变化,是一个多因素过程,可导致功能下降,最终导致死亡。为对抗衰老,目前已对衰老的机理进行了广泛研究,细胞衰老是被普遍认可的衰老原因之一。细胞衰老可分为复制性细胞衰老和早发性细胞衰老。1965年,Hayflick[1]发现细胞具有增殖极限,首次提出正常人胚肺成纤维细胞系(WI-38)是研究细胞衰老的经典试验模型之一。根据目前的报道,许多试剂如过氧化氢(H2O2)、DNA破坏剂、放射线等都可以诱导WI-38细胞过早衰老,即细胞的固有复制寿命会因外力而缩短[2-3]。细胞衰老是一个复杂的过程,其特征是体积变大,形状扁平,皮肤中肥大细胞的分泌活性增加[4],DNA损伤反应(DDR)和应激反应等。如今,中药复方成为研究的热点,有学者指出,复方人参皂苷制剂可显著增强小鼠免疫功能[5]。另外,中药复方多糖可在体外通过调控信号转导通路而影响淋巴细胞免疫功能[6],这提示,中药活性物质在调节机体功能方面扮演了重要角色。研究表明,归芪多糖抗氧化活性强[7],可以降低衰老过程中p53和p16蛋白的表达,通过调节细胞周期和促进细胞增殖来延缓细胞衰老[8]。但是,其具体的作用途径(尤其是其上游调节子和下游转录因子)仍不清楚。Sirtuins是NAD+依赖性的组蛋白脱乙酰基酶,可通过赖氨酸脱乙酰基作用来调节蛋白质的活性和稳定性,从而调节衰老过程[9]。其中Sir 2是酵母中已知的长寿因子,参与调节由卡路里限制(CR)引起的抗衰老和延长寿命的作用。人类Sirtuin家族中有7 个公认的成员:SIRT1~SIRT7,其中SIRT1与酵母Sir 2的同源性最高,并且是Sirtuins家族中研究最深入的成员,在抵抗各种压力和调节细胞凋亡,细胞能量,新陈代谢和细胞衰老中起着重要作用[10]。众所周知,老化与氧化应激密切相关。细胞内线粒体是动物体内氧化呼吸和能量转换的主要场所,对氧化应激下活性氧(ROS)产物的刺激极为敏感。大量研究报道,氧化应激会首先攻击细胞内部的线粒体,引起其结构破坏和功能障碍,进而影响体内各种系统疾病的发生和发展[11]。研究表明,SIRT1可能是调节氧化应激下细胞防御能力的关键因素[12]。因此,及时发现和治疗线粒体异常可延缓衰老,进而预防老年性疾病的发生和发展。本研究旨在探讨归芪多糖延缓细胞衰老的分子机制,并阐明归芪多糖-SIRT1(线粒体)-衰老之间的关系。
1 材料与方法
1.1 药材和试剂
当归和黄芪购自甘肃岷县顺发药材有限公司(甘肃岷县),归芪多糖由甘肃省高校中藏药筛选评价及深加工重点实验室制备,其中碳水化合物含量为82%,阳性药物白藜芦醇RES购自Sigma(美国),SIRT1抑制剂Ex527购自Sigma(美国),细胞培养基DMEM购自Hyclone(美国),胎牛血清(FBS)购自四季青(中国)。SIRT1,p53,CyclinD1一抗购自CST(美国),内参基因β-actin、辣根过氧化物酶标记的山羊抗小鼠IgG和辣根过氧化物酶标记的山羊抗兔IgG购自中杉金桥(中国)。细胞衰老特异性β-半乳糖苷酶染色试剂盒购自江苏碧云天(中国),线粒体膜电位试剂盒、ATP含量测定试剂盒和活性氧测定试剂盒购自南京建成生物公司(中国)。
1.2 细 胞
1.3 试验设计与分组
培养至第18代的WI-38细胞分为正常对照组(C),过氧化氢诱导组(H2O2),归芪多糖组(AAP)、阳性药物白藜芦醇组(RES),归芪多糖联合Ex527组(A + E),白藜芦醇联合Ex527组(R+ E)。过氧化氢诱导组每天给200 μmol/L H2O2作用2 h,持续4 d。药物组每天用药物干预2 h后,再用H2O2诱导2 h,持续4 d。白藜芦醇浓度设定为30 μmol/L[13],Ex527浓度设定为5 μmol/L[14]。正常对照组细胞正常培养不做任何处理。
1.4 AAP毒性研究
将细胞暴露于质量浓度为0.003 125、0.012 5、0.05、0.2、0.8、3.2 mg/mL的AAP中48 h。使用MTT(Biofrox,Germany)比色法在490 nm下测定吸光值,计算细胞活力。
1.5 细胞形态变化
药物处理完毕后,在倒置显微镜下(江南永新光学有限公司)观察细胞形态并拍照。
1.6 细胞活力评估
按“1.3”对细胞进行分组处理,结束后采用MTT比色法,于490 nm处测定吸光值,评价各组细胞的活力。
1.7 蛋白质免疫印迹
各组药物处理结束后,使用裂解液获取细胞蛋白,测定各组细胞蛋白浓度,将等量(10 μg)的细胞蛋白进行SDS聚丙烯酰胺凝胶电泳,并转移至PVDF膜(Millipore,美国)。在室温下用50 g/L脱脂奶粉封闭溶液封闭2 h,在4 ℃下与目标一抗(SIRT1,p53,CyclinD1)孵育过夜,然后在室温下与相应的二抗孵育2 h。使用ECL发光液(Biosharp,中国)检测蛋白条带,并在凝胶成像系统(UVP,USA)中成像,使用Image J分析目标条带。
1.8 细胞内活性氧的检测
各组细胞药物处理完成后,按照细胞活性氧水平测定试剂盒(南京建成)说明书进行操作。小心吸弃孔板中细胞培养基,加入制备好的荧光探针2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)(将DCFH-DA加入培养基中,稀释至终浓度为10 μmol/L),在37 ℃,体积分数5% CO2培养箱中孵育30 min-1 h。孵育后,将细胞1 000 g离心5 min,收集沉淀,PBS洗涤 2 次后重悬细胞,通过流式细胞仪(BD Accuri C 6 Plus)FITC荧光进行检测。
1.9 细胞线粒体膜电位的测定
细胞经药物处理后,PBS洗涤 2 次,1 100 g离心5 min,收集约1×106个细胞。将10×孵育缓冲液稀释10倍制备1×孵育缓冲液。使用JC-1工作溶液均匀悬浮细胞,在37 ℃,体积分数5%CO2培养箱中孵育15-20 min。将细胞重悬于 1×孵育缓冲液中,并通过流式细胞仪分析(Ex=488 nm;Em=530 nm)。FITC通道FL1检测绿色荧光,PI通道FL2检测红色荧光。
1.10 细胞线粒体膜肿胀度的测定
细胞分组处理后,离心收集细胞。将1~2.5 mL的线粒体分离试剂加入细胞中,冰浴条件下反应10-15 min。将细胞悬浮液转移至玻璃匀浆器中,匀浆20下,600 g 4 ℃下离心10 min,取上清,11 000 g、4 ℃下继续离心10 min,沉淀物即细胞线粒体。使用含有PMSF的线粒体裂解液裂解线粒体以获得线粒体蛋白,使用BCA蛋白质量浓度测定试剂盒(碧云天)测量线粒体蛋白浓度,调整每组细胞线粒体蛋白质量浓度为0.5 mg/mL。在线粒体悬浮液中加入反应缓冲液(蔗糖250 mmol/L,KH2PO45 mmol/L,琥珀酸钠 3 mmol/L,pH 7.2)至3 mL,于分光光度计 520 nm处测量OD值,并记录0、2、4、6、8、10和20 min时的A520值[15],计算肿胀度。
以2005—2015年海南省初始数据为依据,计算海南省旅游经济评价指数、生态环境评价指数、两系统的综合评价指数T、耦合度C及耦合协调度D。参照学术界的通用标准,划分耦合协调度等级(见表2)。
1.11 细胞中的线粒体ATP含量
各组细胞经处理后,收集细胞,调节细胞数目为1×106,并向收集的细胞中加入300~500 μL热双蒸水,匀浆破碎。将匀浆的细胞悬液置于沸水浴中加热10 min,取出抽提1 min,按照ATP含量测定试剂盒说明书操作,于分光光度计 636 nm处测量样品OD值。
1.12 统计学分析
使用Graph Pad Prism 5.0进行单向方差分析。每个试验至少重复 3 遍,数据以“平均值±标准差”表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 AAP的细胞毒性
由图 1 可知,在试验质量浓度范围(0.003 125~3.2 mg/mL)内,细胞存活率均不低于90%,提示AAP安全无毒,并且随着AAP质量浓度的增加,细胞存活率先升高后降低,最佳促生长质量浓度为0.012 5 mg/mL。重复 3 次,结果一致,因此,在后续试验中将AAP的剂量设定为0.012 5 mg/mL。
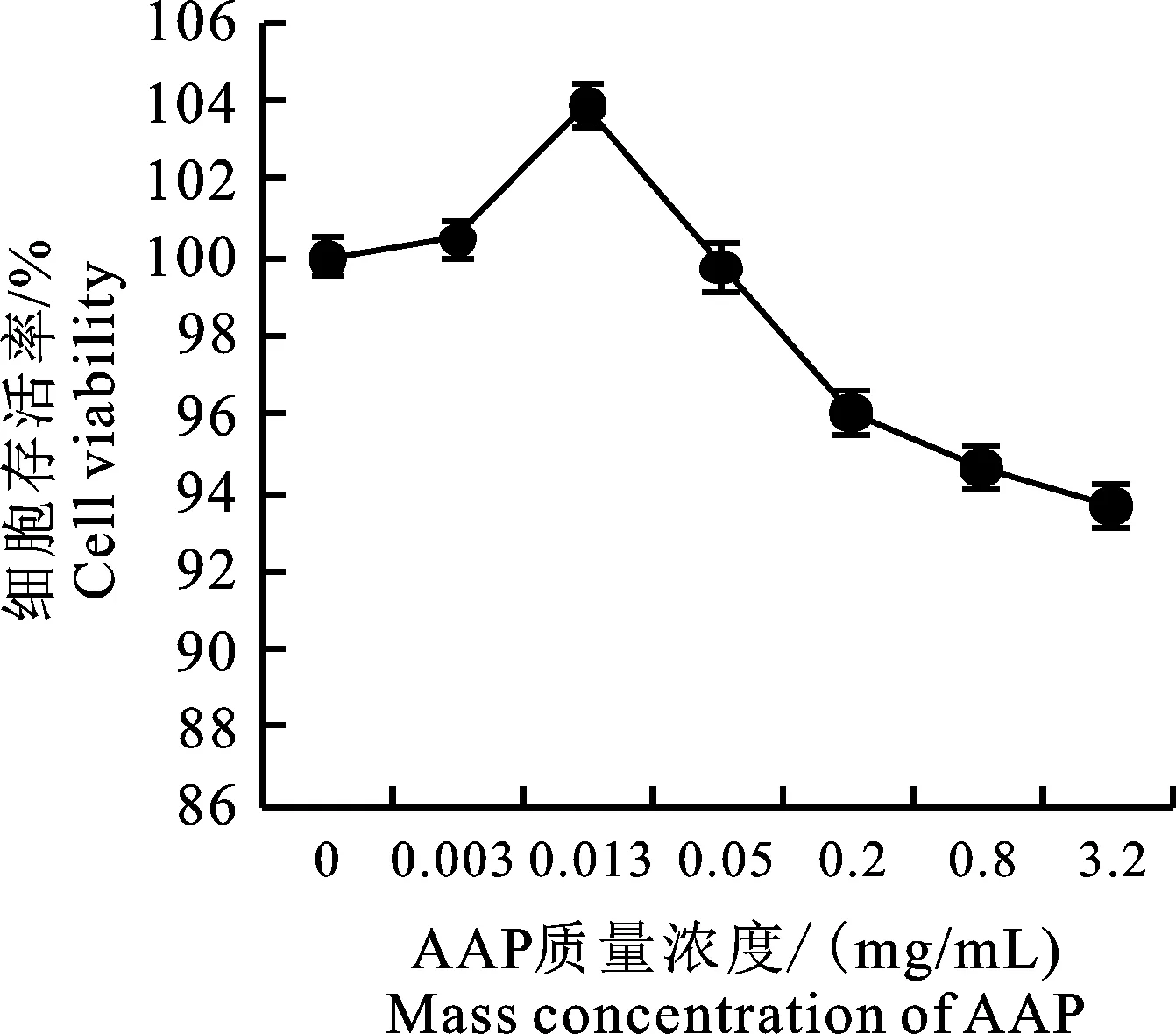
图1 归芪多糖效应图
2.2 AAP对细胞形态的影响
衰老细胞通常表现出一系列形态学变化,如细胞体积增加,出现颗粒物和空泡,形状扁平,折光性增强,出现多形核等[16]。因此,药物干预后细胞的形态变化见图2,正常对照组的细胞(C)体积较小,密度较大,多呈纤维状,少数为圆形,边界清晰,细胞排列整齐。诱导衰老组(H2O2)细胞密度减少,并出现衰老样变化,如体积变大,边界模糊,细胞内出现空泡和颗粒物,细胞形状不规则等。AAP干预后,细胞密度增加且衰老样变化减少,而该现象在Ex527预处理的细胞中未被观察到,此结果与阳性药物白藜芦醇组一致。以上结果表明,AAP可减少细胞衰老样变化,并且这种作用与SIRT1有关。
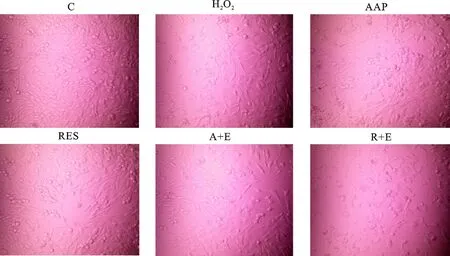
图2 细胞形态图(×200)
2.3 AAP对细胞活力的影响
为探讨AAP对细胞活力影响的具体程度,采用MTT检测各组细胞的活性,结果如图3所示,H2O2诱导后,细胞活力显著降低,AAP增加细胞活力,降低细胞衰老程度,且与阳性药物白藜芦醇作用相当,而在Ex527预处理的细胞中未发现细胞活力的增加。结果提示,归芪多糖能够改善H2O2带来的细胞衰老样变化,并且可能与SIRT1有关。
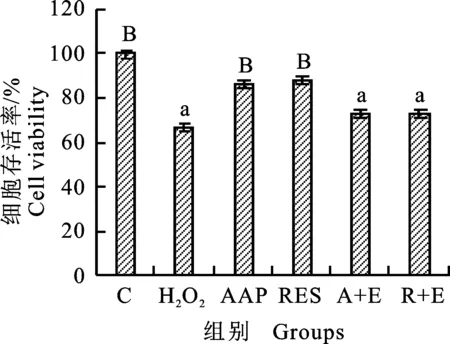
不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下同
2.4 SIRT1、CyclinD1和p53的表达水平检测
在正常的人类细胞中,p53或p21基因的失活可以延长细胞的复制寿命[17]。此外,研究表明,ROS/p53/p21信号通路在衰老中起着至关重要的作用[18]。研究[19]还显示,人参,三七和川芎提取物可以通过改变p16-cyclin D/CDK-Rb通路因子的表达来延迟大鼠血管平滑肌细胞的衰老。蛋白质检测结果如图4和图5所示,与正常对照组相比,H2O2组中SIRT1和CyclinD1蛋白的表达水平明显降低,p53蛋白的表达水平显著升高,AAP的干预显著提高SIRT1和CyclinD1蛋白的表达水平,同时下调p53蛋白的表达水平,Ex527逆转以上相应作用,白藜芦醇对以上蛋白产生同样的调控作用,且与AAP相比无显著性差异。此结果表明,AAP和白藜芦醇通过影响p53、CyclinD1及其下游信号分子的表达达到其抗衰老作用,而这些通路很有可能是经过SIRT1直接或间接调控的。
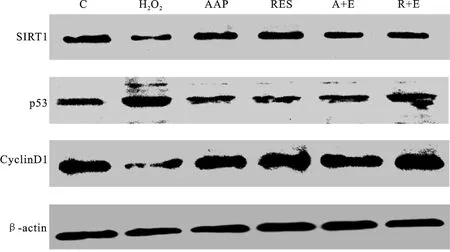
图4 蛋白表达结果
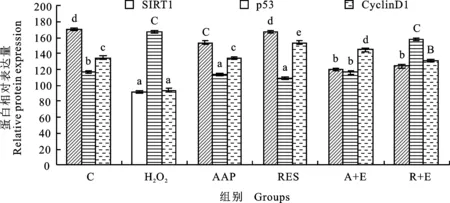
图5 蛋白表达水平
2.5 细胞内ROS水平的改变
ROS水平检测是基于荧光染料DCFH-DA(2,7-二氯二氢荧光素二乙酸酯)的荧光强度变化来定量检测细胞内活性氧种类的最常用方法。DCFH-DA本身没有荧光,可以自由穿过细胞膜。进入细胞后,它可以被细胞中的酯酶水解生成DCFH,而DCFH不会穿透细胞膜,因此探针很容易在细胞中积聚。细胞中的活性氧可以氧化非荧光DCFH,产生荧光DCF。荧光强度与活性氧水平成正比。结果如图6和图7所示,AAP明显降低H2O2所诱导的细胞内活性氧的水平,而在Ex527预处理的细胞中未发现这样的趋势,同样的趋势也出现在白藜芦醇组中,这表明AAP和白藜芦醇可通过降低细胞内活性氧的水平来延缓细胞衰老,且可能是由SIRT1介导的。
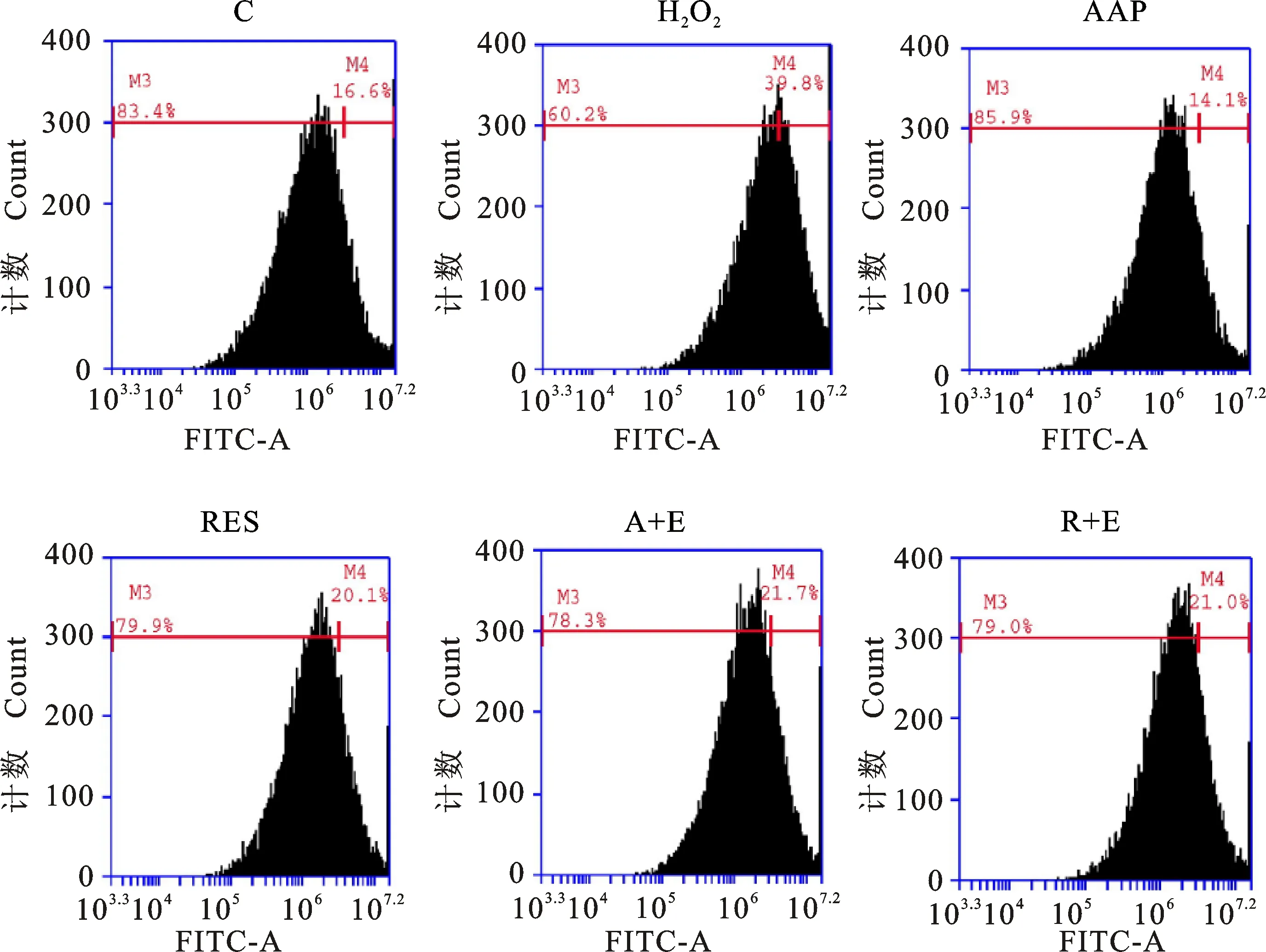
图6 活性氧测定结果
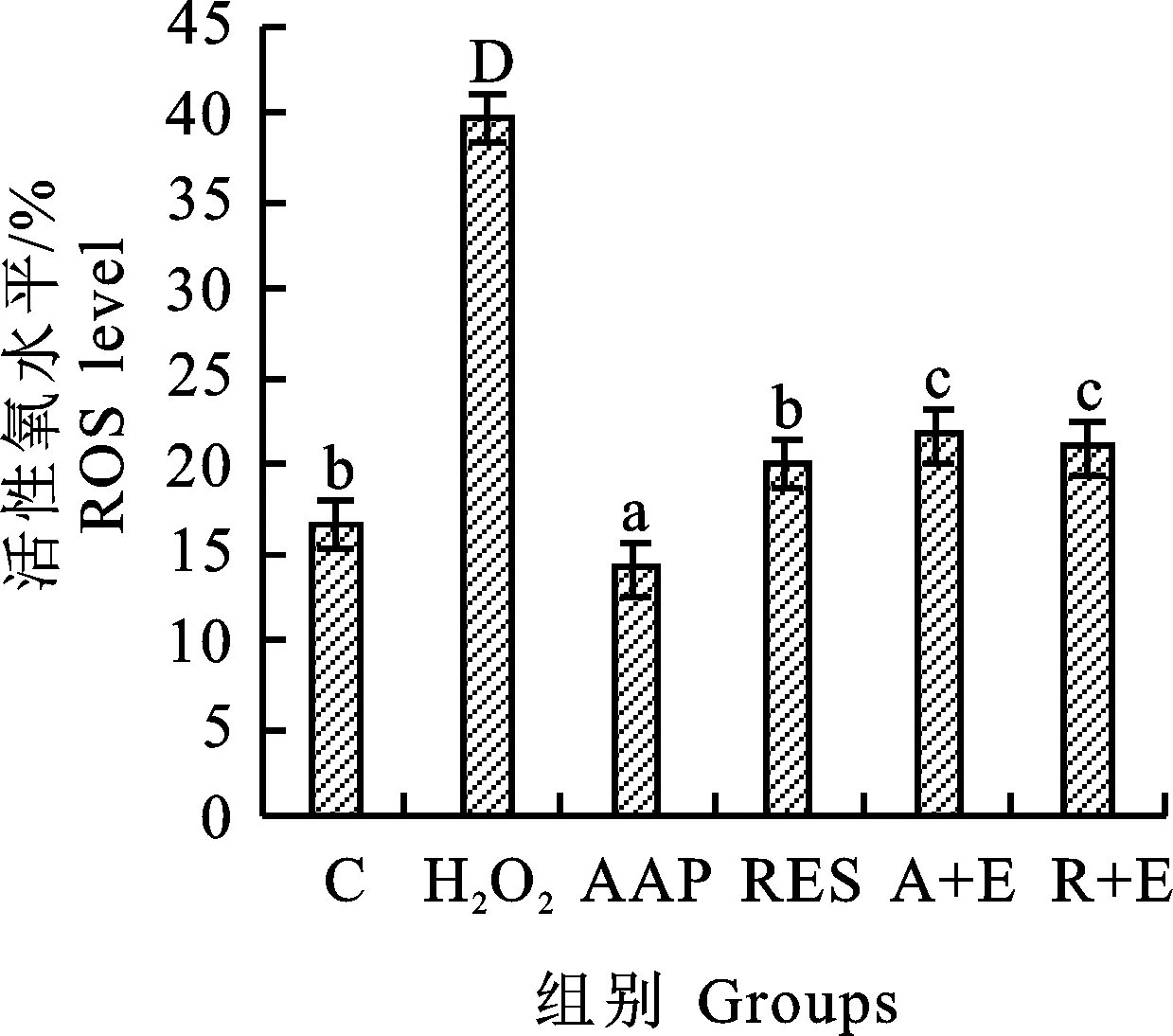
图7 活性氧水平
2.6 各组细胞线粒体膜电位水平
大量研究[20-21]表明线粒体与细胞凋亡密切相关。其中,线粒体膜电位的破坏被认为是凋亡级联过程中的最早事件之一,其发生在核凋亡特征(染色质浓缩,DNA断裂)出现之前。线粒体膜电位一旦崩溃,细胞凋亡是不可逆的[22]。JC-1是一种阳离子脂质荧光染料,用作检测线粒体跨膜电位的指示剂,可以通过正常细胞膜将其收集在细胞中。正常健康线粒体的膜电位具有极性,发出的光为红色荧光,可通过流式细胞仪FL2通道检测;细胞凋亡时,线粒体跨膜电位被去极化,红光强度减弱,发出绿色荧光。结果表明,H2O2诱导的细胞线粒体检测到的红色荧光强度显著减弱,而在AAP和白藜芦醇干预后有所增强,并且Ex527消除了该作用,如图8和图9所示,结果提示影响线粒体膜电位可能也是AAP抵抗WI-38细胞衰老的途径之一,且可能是通过影响SIRT1蛋白的表达所获得。
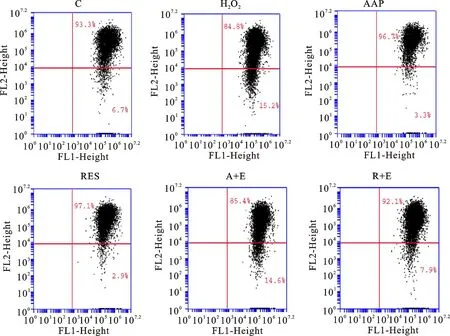
图8 线粒体膜电位测定结果
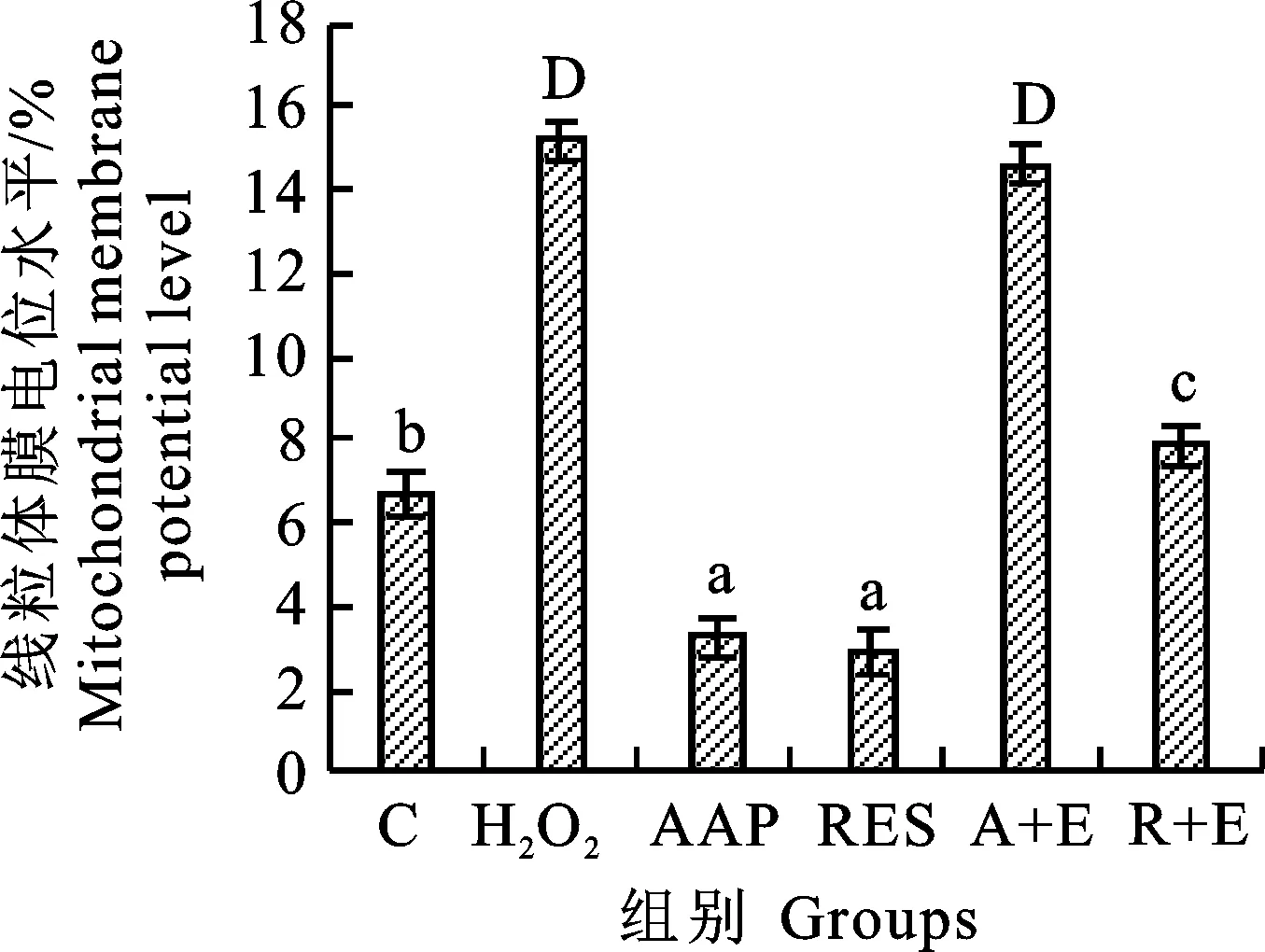
图9 线粒体膜电位
2.7 各组细胞线粒体肿胀水平
研究表明,细胞衰老发生后,线粒体会肿胀[23]。此外,在代谢异常的大鼠中同样发现线粒体肿胀现象[24]。结果如图10和图11所示,H2O2诱导后,线粒体反应液在520 nm处的吸光度随时间降低,而AAP干预组在20 min内A520没有显著变化,Ex527处理的细胞呈现出和H2O2组相同的趋势,白藜芦醇显示出与AAP同样的作用。该结果提示,AAP和白藜芦醇可能通过影响线粒体活性和肿胀程度来延缓衰老,这个过程中需要SIRT1的参与。
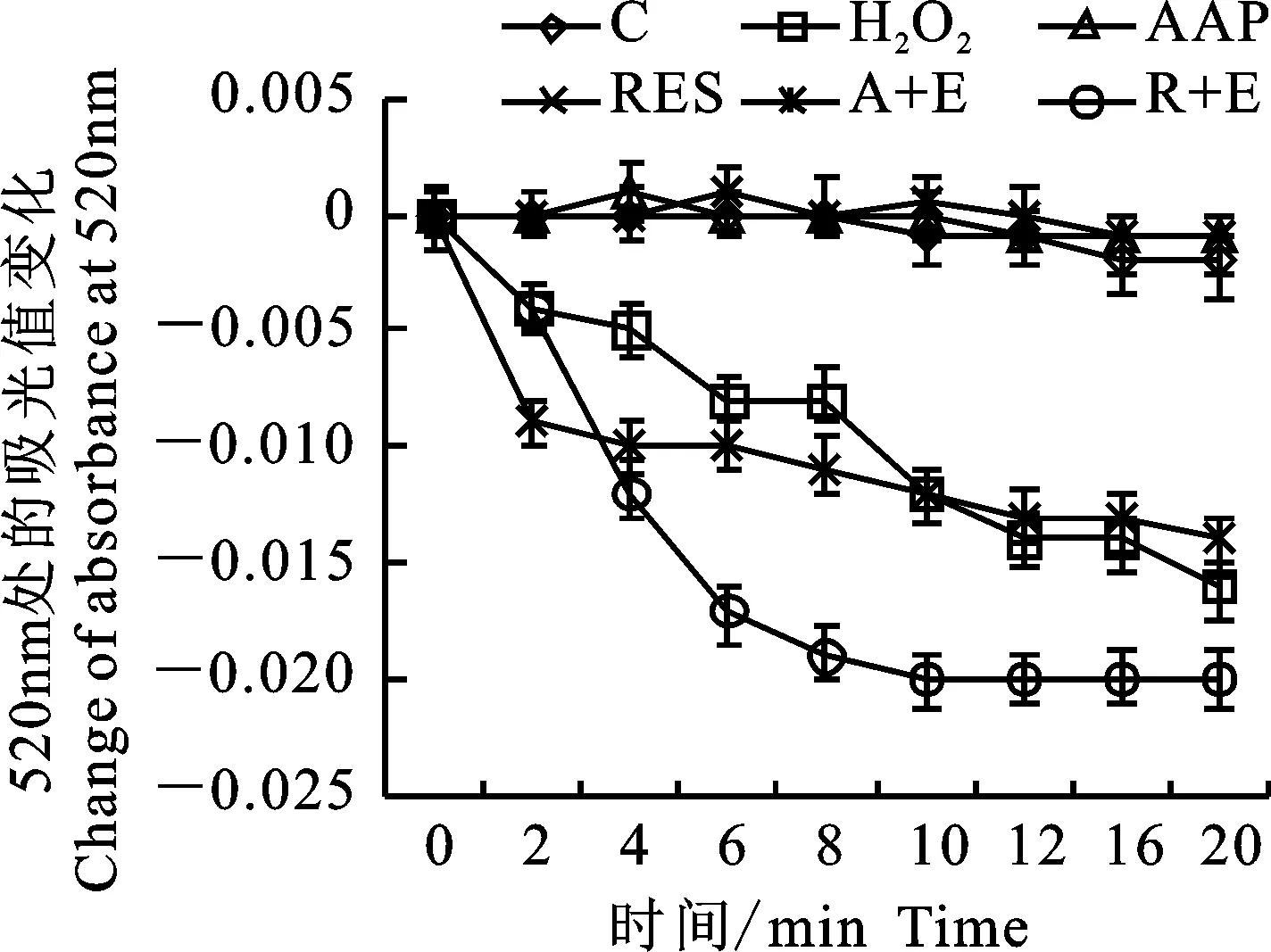
图10 线粒体反应液A520
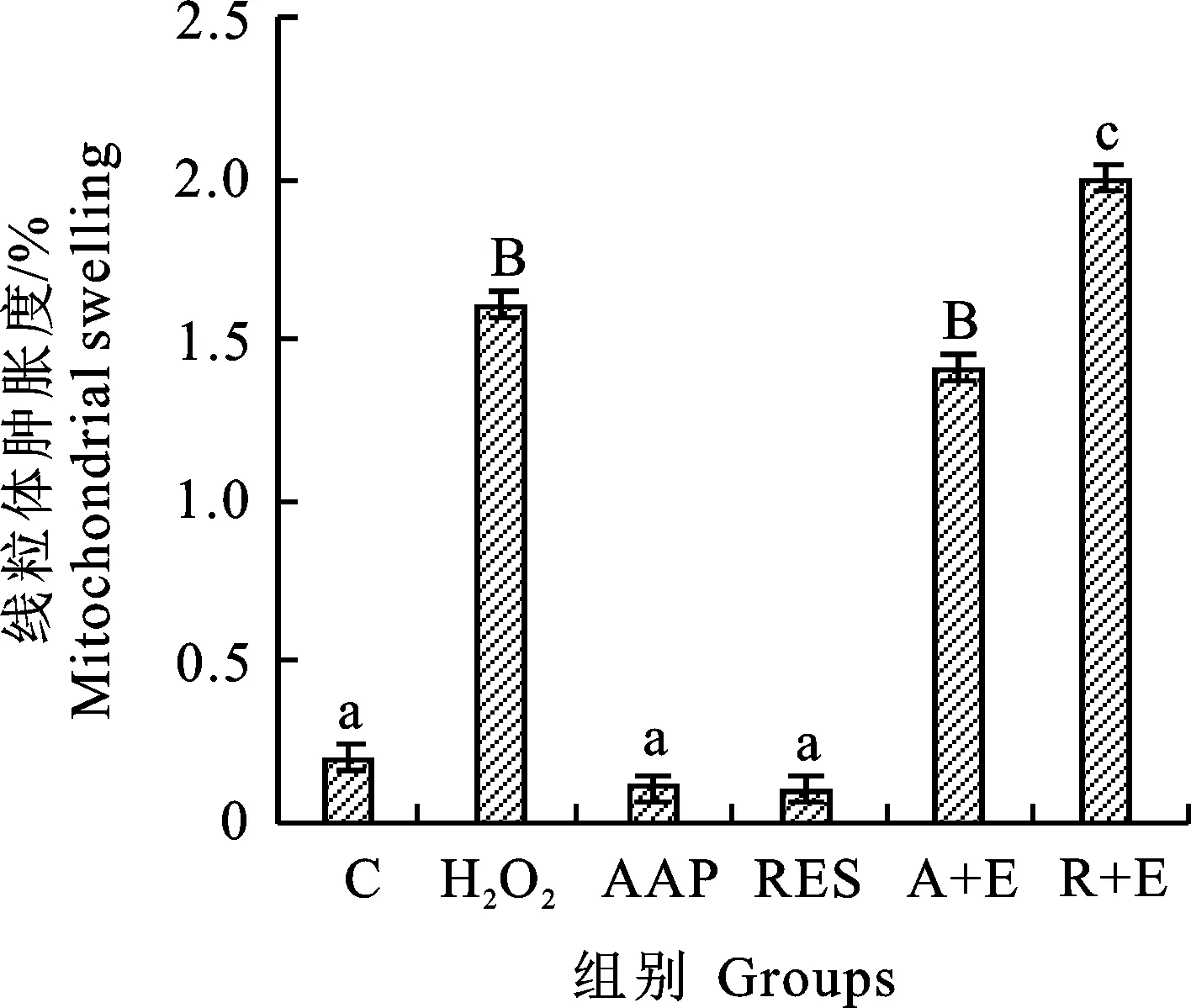
图11 线粒体肿胀度
2.8 各组细胞线粒体中ATP的水平
ATP是体内能量转化的最基本载体,其含量变化与每个器官的能量代谢直接相关。通常在细胞凋亡,坏死或中毒状态下,ATP水平会降低,ATP水平降低表明线粒体功能受损。
通常,ATP水平的降低和线粒体膜电位的降低是同时发生的,且细胞凋亡和ROS水平升高与ATP水平的变化密切相关[25]。通过检查各组细胞中ATP的水平,进一步证实AAP延缓WI-38衰老的事实及其与线粒体和SIRT1之间的关系。如图12所示,AAP可显著提高ATP含量,同样,Ex527逆转这种作用,同时,在白藜芦醇组中看到同样的趋势。ATP水平和线粒体膜电位的变化进一步证实AAP抵抗WI-38细胞衰老的过程与线粒体密不可分,并且这种变化与SIRT1蛋白密切相关。
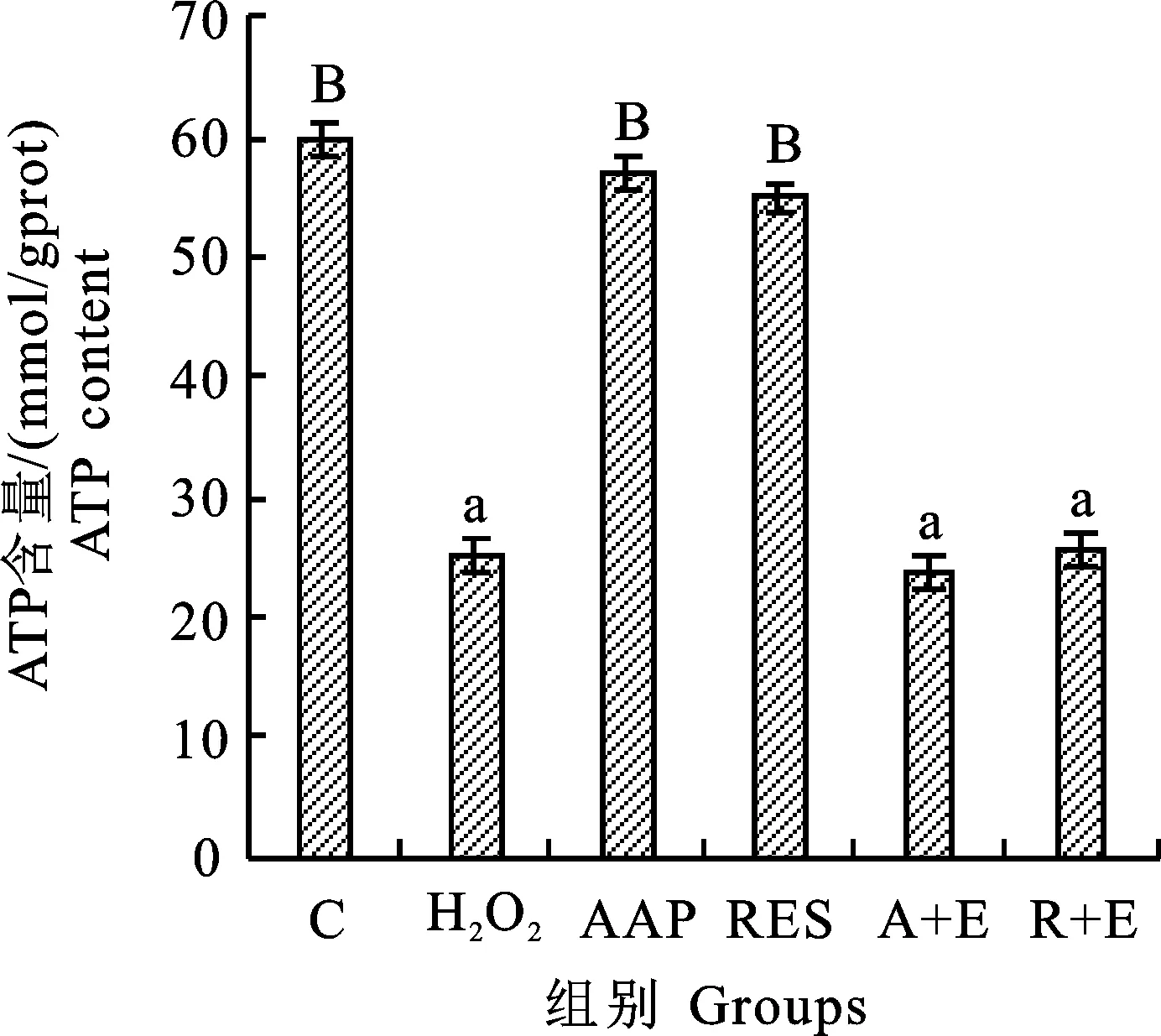
图12 ATP含量
3 讨 论
21世纪,人类正面临着“人口老龄化”的巨大挑战,与年龄有关的退化性疾病如心血管疾病,阿尔茨海默氏病和帕金森综合症等已成为老年人死亡的主要原因之一。延缓衰老成为当今生命科学研究的热点,也是整个社会面临的严峻挑战。众所周知,细胞衰老是不可逆的生命过程,当衰老发生时,细胞仍然具有基本的新陈代谢,但是它们的增殖能力会随着时间的流逝逐渐消失,并最终走向死亡[26]。因此研究细胞衰老的机制极为重要和紧迫。导致细胞衰老的因素很多,包括炎症因子,DNA损伤,线粒体受损,分子信号传导途径的影响,致癌基因的诱导以及外界因素的刺激等。Limane于1989年提出线粒体衰老假说,线粒体与衰老之间的关系也受到广泛关注,它的性状变化与人类衰老和疾病密切相关,被称为衰老的生物钟[27]。有研究发现,SIRT1和细胞衰老及代谢功能存在一定的联系,体外使用SIRT1抑制剂后,细胞表现出依赖于p53途径的死亡[28],此外,SIRT1基因的缺陷会加剧肥胖小鼠的脂肪功能障碍[29]。这表明,SIRT1及其下游信号分子与细胞凋亡及衰老密切相关。CyclinD1在细胞的G1/S相变中起关键作用,它的表达增强可促进细胞增殖[30]。另外,细胞凋亡发生后,线粒体膜发生肿胀,通透性增加,线粒体膜电位出现去极化[24]。同时,线粒体结构和功能的受损会使ROS含量增加,从而导致线粒体ATP合成减少[31],最终导致能量缺乏,细胞衰老[32]。
兰州理工大学生命科学与工程学院临床前分子药理课题组前期结果已发现,AAP通过降低衰老大鼠肾脏组织中AGS、MDA和PC的含量,延缓大鼠肾脏的衰老[33],并促进G1期受阻的衰老细胞进入S期,下调p53和p16蛋白的表达,进而延缓细胞衰老[8],然而,AAP延缓衰老的分子机制及其与SIRT1和线粒体的关系未知。
本研究使用MTT法评估AAP对细胞的毒性,结果显示,在0.003 125~3.2 mg/mL内,AAP对细胞无任何毒性,表明AAP具有无毒无害的特点。接着,采用H2O2刺激建立衰老细胞模型来探索AAP延缓衰老的分子机制,发现归芪多糖能够显著增强细胞活力,改善H2O2所致的细胞衰老,同时,还呈现出减少细胞内p53的表达,升高SIRT1和CyclinD1的表达水平的特性,推测,AAP可能是通过调控p53,CyclinD1以及其他与SIRT1相关的上下游信号蛋白,直接或间接影响SIRT1的表达。另外,归芪多糖抵抗细胞内H2O2导致的线粒体功能受损的状态,如活性氧水平升高、线粒体膜肿胀度增加、线粒体膜电位去极化以及ATP含量下降等,并使其恢复正常,而这些作用在使用SIRT1抑制剂Ex527的细胞中并未发现,AAP对细胞产生与阳性药物白藜芦醇同样的作用,进一步证实,AAP可被开发为一种抗衰老药物和SIRT1促进剂。另外,AAP延缓衰老是否也对其他细胞有效,需要进一步研究。
综上所述,SIRT1和线粒体在归芪多糖延缓细胞衰老的过程中扮演着重要的角色,该结果为后期SIRT1介导的抗衰老药物的研发奠定一定科学基础。
