金纳米粒子在比色传感器中的应用研究
2020-10-27张慢乐廖诗晴郭美彤何婧琳长沙理工大学化学与生物工程学院电力与交通材料保护湖南省重点实验室细胞化学湖南省重点实验室湖南长沙404重庆市计量质量检测研究院重庆403
唐 玲,张慢乐,廖诗晴,郭美彤,何婧琳*,曹 忠*(.长沙理工大学化学与生物工程学院,电力与交通材料保护湖南省重点实验室,细胞化学湖南省重点实验室,湖南长沙404)(.重庆市计量质量检测研究院,重庆403)
0 引言
金纳米粒子(AuNPs),通常粒径分布在1~100 nm之间,又称胶体金,是一种非常稳定的纳米材料,已被广泛研究和应用[1-2]。AuNPs因其所具有的较强的亲和力、独特的光学、热学、电子学、高催化活性、生物相容性等物理化学性质,已被广泛应用于生化传感、免疫分析、电化学分析和生物医学等领域[3-6]。
AuNPs的表面等离子体共振特性导致其最大特征吸收峰波长在紫外-可见光区域随粒子尺寸、形貌和粒子间距离的变化而移动,并伴随着颜色的变化[7]。AuNPs可以通过与目标物质形成共价键或非共价键引起纳米粒子的聚集(或抗聚集)来建立光学传感技术。AuNPs的聚集会使溶液由酒红色变为蓝色,相应的表面等离子体带由520 nm向610~670 nm移动[8-9]。此外,基于目标触发制备的功能性AuNPs可用于检测各种生物标志物[10-11],基于AuNPs的比色传感器具有简单、快速、高灵敏度等优点,已广泛应用于污水处理、食品检测、疾病诊断等领域的实时现场监测和快速检测[12-14]。该文将从AuNPs的合成、性质及其在传感器中的应用前景进行综述。
1 AuNPs的合成
AuNPs因其独特的物理化学性质而越来越受到科学家们的关注。AuNPs的制备方法主要分为物理法和化学法[15-16]。物理方法包括真空冷凝、电弥散、超声和激光消融。物理方法可以控制AuNPs的形状,但通常需要大型设备[17],且方法复杂,纳米颗粒的粒径分布不均匀。化学方法包括柠檬酸还原法、巯基配体法、种子晶体生长法以及电化学和光化学方法[18]。下面介绍几种常用的AuNPs合成方法。
1.1 柠檬酸钠还原法
柠檬酸还原法,也被称为Turkevich-Frens法,是Turkevich[19]首先描述的一种简单的水相氧化还原法,是目前合成AuNPs常用的方法之一。首先将一定浓度的氯金酸溶液煮沸,加入一定量的柠檬酸钠溶液,Au(III)被还原并聚集形成金芯。通过静电相互作用,离子(H+,AuCl4-)吸附在金芯表面,形成稳定的胶体金溶液[20]。柠檬酸钠作为还原剂,可以作为配体修饰AuNPs的表面,以防止AuNPs的聚集和沉淀[21]。图1是用经典的柠檬酸钠还原法制备的AuNPs(13 nm)的透射电镜表征图。该方法简单,制备的AuNPs分散性好,粒径分布均匀。粒径受氯金酸与柠檬酸钠的比例影响,通过改变比例可以控制在3~100 nm范围内[22]。
1.2 巯基配体法
在巯基配体法中,将氯金酸和巯基配体添加到双相或单相溶剂中,然后加入强还原剂(硼氢化钠)将Au3+还原为AuNPs。巯基配体可以通过Au-S键与AuNPs表面结合[21]。该方法制备的AuNPs尺寸分布较窄,一般在0.8~8 nm之间。根据溶剂的极性,该方法可分为单相和双相法。在单相法中[23],使用水溶性的巯基配体,如巯基乙酸、半胱氨酸或谷胱甘肽作为配体,在水中制备具有良好分散性的AuNPs。双相法中经常使用烷基硫醇作为配体,制备的AuNPs具有良好的油溶性,且在有机溶剂中稳定[24]。Brust-Schiffrin法[25]是一种经典的巯基配体法,它以四辛基溴化铵为试剂,将氯金酸从水相转移到有机相,然后分别以NaBH4和硫醇作为还原剂和配体制备AuNPs。四辛基溴化铵可作为相转移剂和稳定剂保护AuNPs[26]。
1.3 种子晶体生长法
在种子生长法中,以水相氧化还原法制备的小AuNPs为种子,以氯金酸溶液为生长溶液,将氯金酸还原到AuNPs表面,生成大的AuNPs[27]。如图2所示,通过控制晶体与生长溶液的比例,可以制备出球形、棒状和三角形等不同尺寸和形貌的颗粒[28]。El-Sayed等[29]以十六烷基三甲基溴化铵修饰的AuNPs为种晶,制备了轴向比可控的金纳米棒。

图2 在不同条件下合成的AuNPs的TEM(插图SEM)图像[28]Fig.2 TEM(inset SEM)images of Au nanoparticles synthesized under different conditions[28]
2 AuNPs在比色传感中的应用
对于AuNPs而言,纳米粒子之间的距离缩短或纳米粒子的粒径变大,体系的颜色由酒红色逐渐变成紫色或者蓝色。AuNPs聚集引起的颜色变化为比色分析提供了基础[30-31]。基于AuNPs的比色分析的主要优点是分子识别事件可以转化为颜色变化,肉眼可以很容易地观察到[32]。重要的是,由于AuNPs的消光系数极高,因此基于AuNPs的比色测定法具有极高的灵敏度,并已用于检测包括DNA和蛋白质在内的许多物质[33]。
2.1 基于交联的AuNPs的聚集
在交联比色法中,AuNPs表面上的目标化合物与配体形成络合物,从而缩短了颗粒间距离并引起聚集[34]。该方法需要用特定的配体对纳米粒子进行修饰。通常,配体的一个末端应具有巯基,而另一末端应具有可以与靶标结合的官能团。配体的巯基可以通过强Au-S键与AuNPs的表面结合[35]。在目标物的存在下,配体也与目标物结合,缩短了AuNPs之间的距离并引起聚集[36]。Yan等[37]基于AuNPs的交联或非交联聚集提出了两种独立的比色策略,用于同时监测多个miRNA(图3)。通过引入Y形DNA结构和两种类型的DNA修饰的AuNPs,可以轻松开发出三输入DNA AND逻辑门,并以AuNPs的交联聚集作为信号输出。为了提高灵敏度并缩短反应时间,通过进一步使用形成双链体和杂交链反应的三条DNA链来修饰逻辑门,且AuNPs的非交联聚集可用于评估初始miRNA输入的浓度。
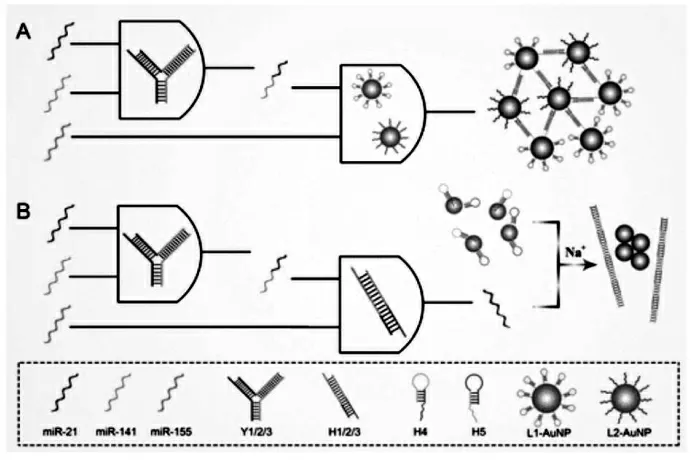
图3 (A)交联和(B)非交联策略检测多种miRNA的插图[37]Fig.3 Illustration of Multiple miRNAs Detection with(A)CA and(B)NCA Strategies[37]
2.2 基于盐老化的AuNPs聚集
在盐老化方法中,有柠檬酸钠还原法得到的AuNPs对柠檬酸的亲和力很弱,柠檬酸很容易被更强的配体取代。通过加入NaCl,德拜长度缩短,AuNPs可以更接近彼此,进入一个有吸引力的范德华力区,而范德华力区是其聚集的原因。AuNPs具有非常大的Hamaker常数(即很强的范德华力),这使得它们特别容易聚集。柔性的单链DNA(ssDNA)可以暴露其碱基,吸附在AuNPs上;而双链DNA(dsDNA)具有稳定的双螺旋几何结构,暴露在外的带负电的磷酸盐骨架,与AuNPs之间发生静电相互作用,因此dsDNA不会被吸附。基于ssDNA和dsDNA对AuNPs的不同的结合特性,已经被广泛用于比色生物传感器的制备,根据粒子间的距离变化,检测AuNPs从红色到蓝色(聚集)或从蓝色到红色的颜色变化(抗聚集)。
大多数的分析都是通过AuNPs的聚集来实现的,而很少的分析是通过AuNPs的抗聚集机制来实现的。将游离的特异性适体(DNA/RNA片段,核酸适体或非巯基有机小分子)与AuNPs混合,并通过弱相互作用与其表面结合。在高盐浓度下,纳米颗粒保持分散并呈红色。目标物与适体之间的结合力更强使配体脱离AuNPs的表面,从而导致AuNPs聚集,颜色从红色变为蓝色。Wang等[38]介绍了一种基于AuNPs的比色检测和杂交链反应(HCR)扩增的高灵敏度、特异性DNA检测方法。如图4所示,设计了两种发夹式辅助探针,其末端为ssDNA,能够稳定AuNPs,有效防止其在盐诱导下的聚集。目标DNA与发夹辅助探针杂交,触发HCR反应形成dsDNA聚合物。因此,没有ssDNA的末端,形成dsDNA聚合物后,AuNPs的稳定性较差,当盐浓度增加时,AuNPs发生聚集。随后,在胶体溶液中观察到溶液颜色从红色到蓝色的变化。该系统设计简单,使用方便。这种策略消除了对酶反应、分离过程、化学修饰和精密仪器的需要。检测和识别过程可以用肉眼看到。重要的是,该方案为确定完全匹配的目标寡核苷酸和单碱基对不匹配的目标之间提供了高选择性。
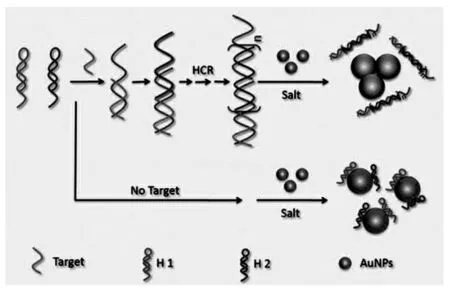
图4 使用金纳米颗粒和杂交链反应扩增技术对DNA进行高灵敏比色检测的示意图[38]Fig.4 Schematic of Highly Sensitive Colorimetric Detection of DNA by the Use of Gold Nanoparticles and Hybridization Chain Reaction Amplification[38]
基于AuNPs的无标记比色检测的各种策略已经有许多报道。人们普遍认为,游离适配体可以保护AuNPs免受盐诱导的聚集,而靶向适配体不能。然而,这些研究只考虑了适配体与靶标的结合,以及适配体对AuNPs的吸附,而没有考虑AuNPs对靶标的吸附。其中,刘珏文教授团队[39]报道了腺苷(Ade)吸附使柠檬酸包封的AuNPs不稳定,腺苷的Kd仅为7.7 μmol/L,而ATP吸附稳定AuNPs是因为三磷酸基带负电荷(图5),吸附的ATP抑制了DNA的吸附。使用适体和非结合突变体,无论DNA序列如何,ATP和鸟苷5'-三磷酸(GTP)具有相同的比色响应,腺苷和鸟苷也是如此,表明颜色变化主要反映了核苷和核苷酸的吸附,而不是适体结合。在此文中,以Ade和ATP为模型,详细阐述了靶标、适体和AuNPs的相互作用。

图5 通过适体和金纳米颗粒感测腺苷和ATP[39]Fig.5 Sensing Adenosine and ATP by Aptamers and Gold Nanoparticles[39]
2.3 基于静电吸附的AuNPs的聚集
盐诱导的AuNPs聚集是一个相对复杂的动力学过程,并且样品的颜色不断变化,难以进行定量测量[40-41]。大多数研究都在单个样品中测量了AuNPs的吸光度,时间点和吸光度可能仍会随时间发生显著变化。新鲜制备的AuNPs由于其负电荷而被其表面柠檬酸盐配体所稳定[42],加盐通过降低AuNPs的负电势来屏蔽电荷排斥[43]。Liu等[44]提出降低负电荷密度的另一种方法是:吸附阳离子分子以中和表面电荷,这能带来更快的颜色变化和潜在的更稳定的聚集体。通过使用带正电荷的分子进行电荷中和,例如DNA染色染料SYBR Green I(SG),以实现AuNPs的高效且稳定的组装(图6a)。DNA染色染料通常带正电[45],他们发现SG可以在少数几种化合物中形成高度稳定的AuNPs聚集体,颜色可能会保留几天。另外,所显影的颜色比盐诱导的颜色要稳定得多,SG的电荷中和作用通过zeta电位测量得到证实。由于SG可以嵌入dsDNA螺旋中并被dsDNA屏蔽[46-47],因此SG诱导的聚集也可以通过dsDNA的形成或解离来调节。这样,与盐诱导的聚集相比,SG诱导的AuNPs组装可演变为具有多种优势的灵活生物传感平台,具有更强烈和稳定的颜色变化以及更高的灵敏度。SG诱导的AuNPs组装被开发为无标记的比色传感平台(图6b),得益于强烈的颜色变化,这种新的传感策略允许视觉检测限低至0.1 nmol/L DNA,比盐诱导的策略低50倍。
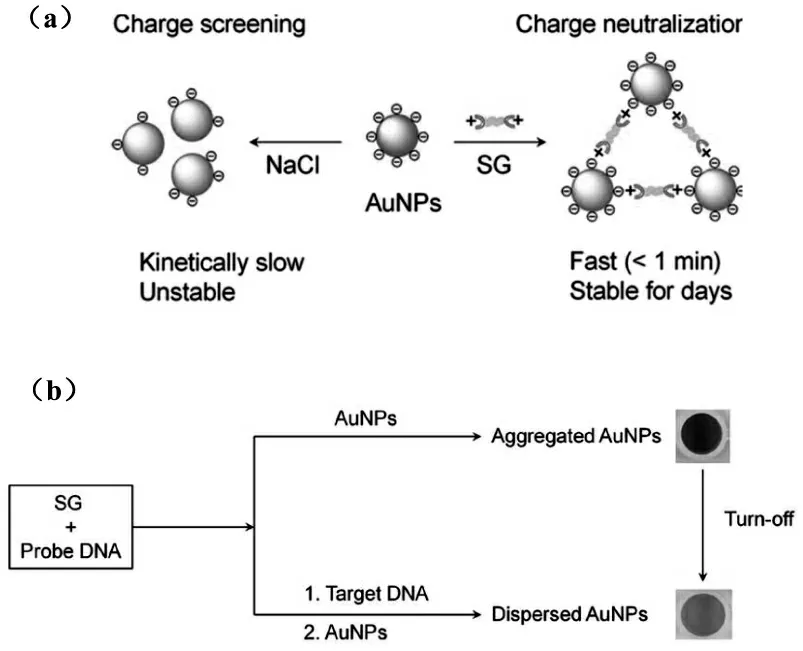
图6 (a)NaCl电荷筛选和SG电荷中和的示意图。(b)使用所提出的SG诱导AuNPs聚集的DNA分析的示意图[44]Fig.6(a)schematic illustration of charge screening of NaCl and charge neutralization of SG.(b)schematic illustration of the DNA analysis using the proposed SG-induced aggregation of AuNPs[44]
带正电荷的金纳米颗粒((+)AuNPs)可以有效区分长链DNA和短链DNA,从而为比色分析检测提供了一种简单直观的方法。由于带正电荷的AuNPs与带负电荷的DNA链之间的静电吸附作用,当直接向(+)AuNP中添加ssDNA或dsDNA时,AuNP溶液的颜色从红色变为蓝色,而片段DNA不能诱导(+)AuNP溶液的颜色变化。基于此构建了一系列的由长短链对AuNPs的不同作用的比色传感器,其中Li等[48]描述了一种简单,快速且通用的比色法,使用(+)AuNPs作为探针来测量核酸酶活性。如图7所示,当将ssDNA或dsDNA直接添加到(+)AuNPs中时,AuNP溶液显示出从红色到蓝色的颜色变化,而片段化的DNA无法诱导(+)AuNPs溶液的颜色变化。S1核酸酶对ssDNA或RNA的磷酸二酯键具有内切和外切水解活性,并产生单核苷酸或寡核苷酸片段,以该酶为模型,以提供该方法的原理验证实验。ssDNA用作核酸酶底物,(+)AuNPs和聚阴离子DNA之间的静电吸引导致AuNPs聚集,这导致溶液快速的红到蓝颜色变化。在存在核酸酶的情况下,ssDNA水解成小片段,AuNPs溶液保持红色。因此,可以用肉眼或简单的比色法方便地测量核酸酶活性。
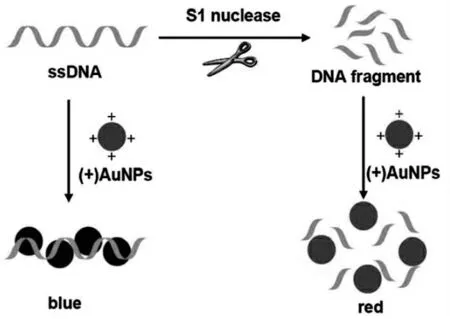
图7 基于带正电的金纳米颗粒((+)AuNPs)的颜色变化的核酸酶活性的比色测定[48]Fig.7 Colorimetric assay of nuclease activity based on the color change of the positively charged gold nanoparticles((+)AuNPs)[48]
3 结论与展望
AuNPs作为一种多功能纳米材料具有广阔的应用前景。AuNPs具有良好的电子学和物理学特性、易于表面修饰等优点,使得AuNPs成为学术研究领域中被研究最广泛的纳米材料之一。AuNPs聚集(或抗聚集)过程中的颜色变化为比色传感提供了一个良好的检测策略,利用该策略可实现任何直接或间接触发AuNPs聚集(或抗聚集)的目标物的比色分析。基于AuNPs的比色传感器具有灵敏度高、无需昂贵设备、操作简单、响应迅速等特点,可广泛应用于生物、医学等领域的快速检测和现场检测。
然而,在AuNPs比色传感器的广泛应用之前,还有几个关键问题需要解决。首先,目前的AuNPs制备方法无法满足合成高度均匀纳米材料的广泛应用需求,且大多数传统的合成过程需要较长的时间和繁琐的洗涤步骤,这极大地限制了此类传感器的实际应用。其次,在实际应用中,对于构建基于金纳米粒子的比色传感平台而言,实现对目标分子的定量检测至关重要。尽管丰富的颜色变化已经满足了用肉眼进行更精确检测的需求,但是用肉眼进行颜色辨别暂不能对目标物进行最准确的检测。总之,通过逐步解决难点,该检测策略将会因其显著的优势受到广泛关注,为这项技术从实验室到大规模应用的转变带来机遇和挑战。
