基于Mo/WSe2/血红素复合纳米材料的比色法对葡萄糖的检测
2020-10-27朱志佳谷梦巧杨馥瑞杨云慧
于 霄,朱志佳,谷梦巧,李 慧,杨馥瑞,蔡 晴,杨云慧,胡 蓉
(云南师范大学化学化工学院,云南昆明650500)
0 引言
近年来,糖尿病患病率逐渐升高,糖尿病已经成为危害人类健康的危险疾病,同时也是导致人类死亡的主要疾病之一[1]。糖尿病患者血液或尿液中葡萄糖含量变化较大,可以通过测定人体血液中葡萄糖的含量为糖尿病的诊断提供重要的依据。因此,开发简单、快速地检测和诊断血液中葡萄糖的含量对糖尿病的预防和治疗有着重要的意义。
测定葡萄糖的方法主要有分光光度法[2]、比色法[3]、高效液相色谱法[4]、极谱法[5]及毛细管电泳法等[6]。相比于其它分析方法,荧光和比色检测可以快速、灵敏和选择性地对目标物做出响应。
2007年,Yan等[7]发现四氧化三铁纳米粒子具有过氧化物模拟酶的特性,随着科研工作者的不断深入研究和探索,纳米材料过氧化物酶被广泛应用于催化研究领域并取得一系列新的研究成果。例如,具有催化作用的纳米材料模拟酶有金属纳米材料、贵金属纳米材料、复合材料和金属硫化物纳米材料等。
层状过渡金属硫族化物(如MoSe2、WSe2、WS2和MoS2等)及其复合材料具有良好的热/化学稳定性及导电性,生物相容性,低毒性和大的比表面积等性质,吸引了科研工作者的广泛关注[8-9]。WSe2是一种典型的层状过渡金属硫族化物,具有类似石墨烯的结构。Mo/WSe2是由钼/钨金属层夹在两个底层即由三个原子层(Se-Mo/W-Se)通过弱范德华力相互作用堆积而成,具有较强的吸附能力、较高的反应活性、较强的催化性能等优点,因此,层状Mo/WSe2近来已被用于生物传感器[10-11]。然而,Mo/WSe2复合纳米材料的辣根过氧化物模拟酶性质鲜有报道。
该文利用Mo/WSe2材料具有过氧化物酶性质的特点,以Mo/WSe2材料为主体,设计合成Mo/WSe2/血红素复合功能纳米材料,利用其对葡萄糖与葡萄糖氧化酶反应产生的过氧化氢对TMB的氧化,可实现对葡萄糖的检测。
1 实验部分
1.1 仪器与试剂
电子分析天平(ME104E)德国赛多利斯集团,pH计(PHS-29A)上海精科雷磁,离心机(TGL16)长沙湘智离心机仪器有限公司,紫外/可见分光度计(METASH)上海元析仪器有限公司,超声波清洗器(ST2200HP)上海科导超声仪器有限公司,真空干燥箱(DZF-6020型)上海博迅实业有限公司,实验室纯水系统上海和泰仪器有限公司,VTX-E混旋仪 倍捷科技,CS501超级恒温器重庆实验设备厂;
二硒化钨(WSe2),纳米钼粉(Mo),血晶质,Tris-HCl,TMB,硫酸(H2SO4),购自阿拉丁试剂有限公司(中国,上海);过氧化氢30%(H2O2)购于天津风船化学试剂科技有限公司(中国,天津);丙酮(C3H6O)购于云南杨林工业开发区汕滇药业有限公司(中国,昆明),葡萄糖氧化酶购于北京索莱宝科技有限公司(中国,北京),β-D葡萄糖购于百灵威科技有限公司(中国,北京)。
1.2 功能化的Mo/WSe2/血红素复合材料的制备
按溶剂比为DMSO∶H2O=4∶6配制1 mg/mL的血红素(Hemin)溶液备用。称取0.10 g聚乙烯吡咯烷酮(PVP)溶于10 mL 50%的乙醇溶液备用。分别称取WSe2(0.50 g)和Mo粉(0.50 g)溶于10 mL PVP溶液中,加入15 mL NaOH(0.03 g/mL)溶液,紧接着超声(100 W、25~30℃)6 h;超声后的再在10000 r/min下离心20 min,取下层1/3的沉淀物,即制备成Mo/WSe2。取Mo/WSe2500 μL加入1 mg/mL的Hemin 500 μL,超声60 min。即制备成Mo/WSe2/血红素复合纳米材料。
1.3 葡萄糖的测定
①将β-D葡萄糖(30 μL,1~10 mmol/L)、葡萄糖氧化酶(30 μL,5.0 mg/mL)与Tris-HCl(50 μL,10 mmol/L,pH7.40)在37℃的恒温培育箱培育8 min,按照顺序分别加入Mo/WSe2/血红素复合纳米材料(30 μL)、TMB(100 μL)和Tris-HCl(80 μL,10 mmol/L,pH7.40),显色80秒(避光),加入硫酸(50 μL,1.0 mol/L)终止反应,利用紫外分光光度计测其吸光度值(波长范围为400~500 nm)。
②将β-D葡萄糖(30 μL,1~10 mmol/L)、葡萄糖氧化酶(30 μL,5.0 mg/mL)与Tris-HCl(50 μL,10 mmol/L,pH7.40)在37℃的恒温培育箱培育8 min,按照顺序分别加入Mo/WSe2/血红素复合纳米材料(30 μL)、TMB(100 μL)和Tris-HCl(80 μL,10 mmol/L,pH7.40),显色20 min(避光),拍照记录下显色照片。
2 结果与讨论
2.1 材料表征图
采用X射线衍射(XRD)对不同材料进行表征,如图1所示,图1(a)为金属钼;图1(b)二硒化钨。
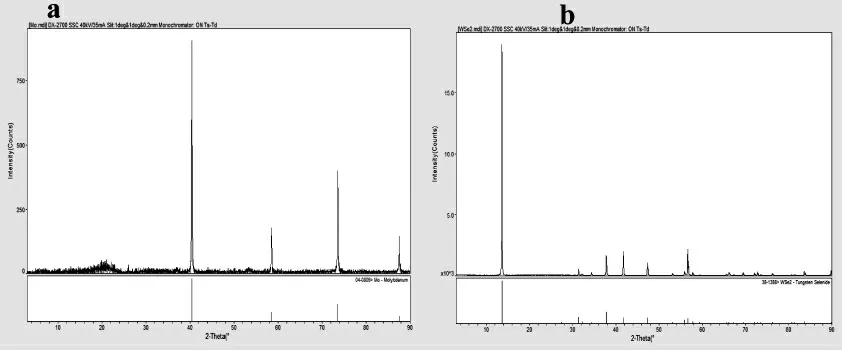
图1 不同材料的XRD图(a:金属钼;b二硒化钨)Fig.1 XRD patterns of different materials.(a)Molybdenum metal;(b)Tungsten diselenide
图2 为复合纳米材料(a)、金属钼(b)和二硒化钨(c)的透射电镜图(TEM),从图2可以看出,合成的纳米复合材料呈片状。

图2 不同材料的透射电镜图(a:复合纳米材料;b:金属钼;c:二硒化钨)Fig.2 TEM of different materials.(a)Composite nanomaterials;(b)Molybdenum metal;(c)Tungsten Selenide
2.2 葡萄糖的检测原理
合成的Mo/WSe2/血红素复合纳米材料具有纳米模拟酶的性质,其活性类似于天然的过氧化物酶,能够有效地催化葡萄糖在葡萄糖氧化酶的催化下氧化产生的H2O2对3,3',5,5'-四甲基联苯胺(TMB)氧化,产生一种特殊的蓝色反应,通过肉眼或者吸光度测定的方法间接测定葡萄糖的浓度。
2.3 不同材料对过氧化氢的催化性能
取3个试管,各加入β-D葡萄糖(30 μL,3 mmol/L)、葡萄糖氧化酶(30 μL,5.0 mg/mL)与Tris-HCl(50 μL,10 mmol/L,pH7.40),在37℃的恒温培育箱培育8 min,在第一支试管中加入Mo/WSe2/血红素复合纳米材料(30 μL),第二支试管中加入Hemin(30 μL,0.05 mg/mL),第三支试管中加入Mo/WSe2纳米片(30 μL,浓度为1/20倍),然后按照顺序继续在每支试管中都加入TMB(100 μL)和Tris-HCl(80 μL,10 mmol/L,pH7.40),显色20 min(避光),加入硫酸(50 μL,1.0 mol/L)终止反应,利用紫外分光光度计测其吸光度值(波长范围为400~500 nm)。如图3所示,Mo/WSe2/血红素复合纳米材料的显色效果远好于单独的Mo/WSe2纳米片及单独的血红素。
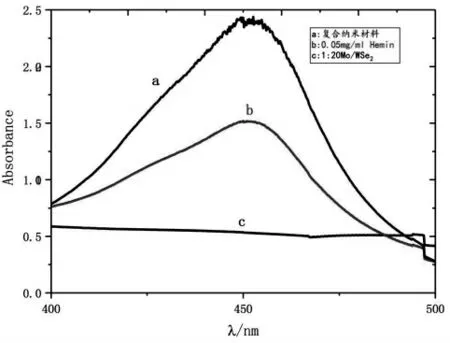
图3 不同材料对过氧化氢的催化性能Fig.3 Catalytic properties of different materials for hydrogen peroxide
2.4 实验条件的优化
2.4.1 培育时间对吸光度的影响
β-D葡萄糖和葡萄糖氧化酶发生反应产生H2O2需要一定的时间,因此考察了在其它条件相同的情况下,β-D葡萄糖和葡萄糖氧化酶的培育时间对吸光度的影响。结果如图4所示,在培育时间为8 min时得到的吸光度值最大,因此,选择培育时间为8 min。
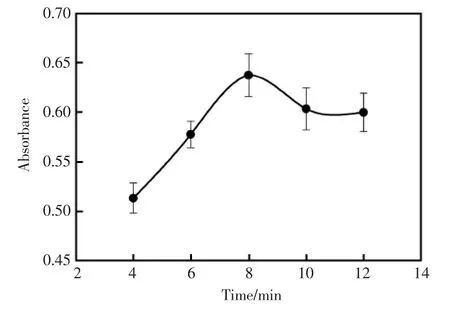
图4 β-D葡萄糖和葡萄糖氧化酶的培育时间对吸光度值的影响Fig.4 The effect of β-D glucose and glucose oxidase incubation time on absorbance value
2.4.2显色时间对吸光度的影响
在避光条件下,考察了TMB催化H2O2反应产生蓝色反应的时间对吸光度的影响,结果见图5。当显色时间为80 s时,其吸光度值达到最大,因此选择80 s作为最佳显色时间。

图5 TMB的显色时间对吸光度值的影响Fig.5 The effect of TMB color development time on absorbance value
2.4.3 葡萄糖氧化酶浓度对吸光度的影响
葡萄糖氧化酶作为催化剂,对过氧化氢的产生起到关键作用。对其浓度进行优化,结果见图6。从图中可看出,当其浓度为5 mg/mL时,吸光度值最大。因此选择5 mg/mL为最佳葡萄糖氧化酶浓度。
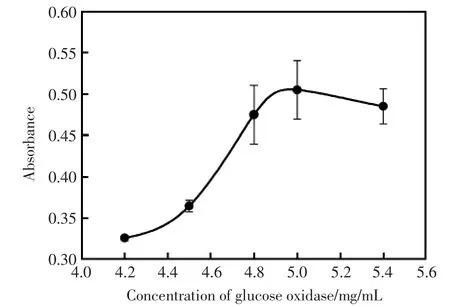
图6 不同浓度的葡萄糖氧化酶对吸光度值的影响Fig.6 The influence of different concentrations of glucose oxidase on absorbance
2.4.4 显色剂TMB的体积对吸光度的影响
TMB作为催化反应的底物,其浓度对酶催化显色反应会有很大的影响作用。固定其它优化条件不变,改变加入TMB的体积,对其测定吸光度值,结果见图7。当TMB体积达到100 μL时,吸光度值最大。
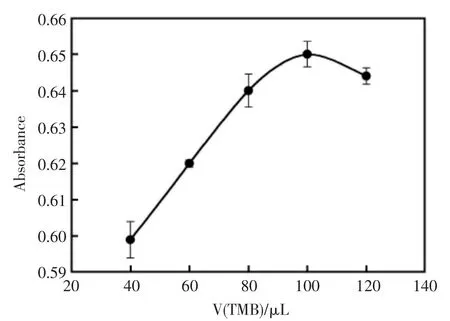
图7 TMB体积的对吸光度值的影响Fig.7 The influence of TMB volume on absorbance value
2.5 不同浓度的葡萄糖检测
在最优条件下,对不同浓度的葡萄糖进行定量测定得到标准曲线(见图8),图9为测定不同浓度的葡萄糖的吸收曲线。吸光度与葡萄糖浓度1~10 mmol/L范围内有线性关系,检测限为0.3 mmol/L,线性方程为y=0.0353x+0.2984,相关系数R2=0.96。
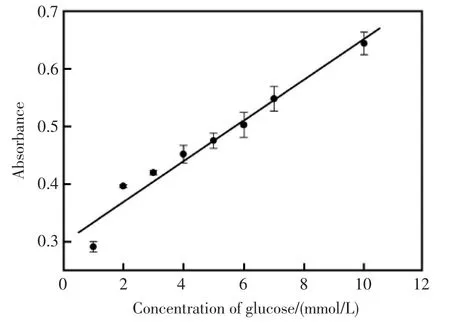
图8 测定不同浓度葡萄糖的校正曲线Fig.8 Calibration curve for measuring different concentrations of glucose
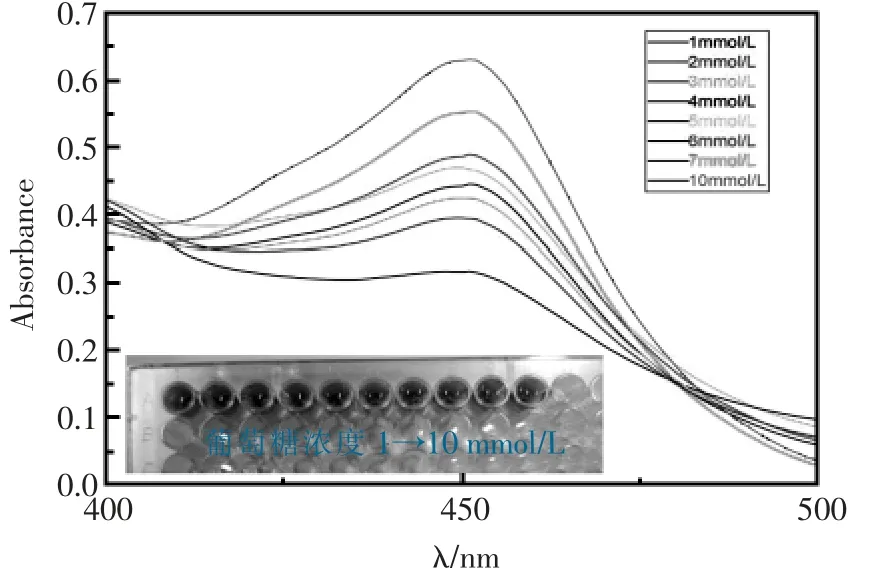
图9 不同浓度葡萄糖的紫外吸收曲线(内置图为显色图)Fig.9 UV absorption curve of different concentrations of glucose(Inset shows chromogenic chart)
3 结论
该文利用合成的功能化的Mo/WSe2/血红素材料具有过氧化物酶性质,能够催化过氧化氢与TMB显色,可应用于葡萄糖的定量测定。该方法简单快捷,易于操作,对葡萄糖的测定提供了一种新方法。
