信号放大策略在疾病标志物电化学生物传感器中的研究
2020-10-27毕倩,袁若,向云
毕 倩,袁 若,向 云
(西南大学化学化工学院,重庆400715)
0 前言
为了让传感器适应社会需求,在环境检测、临床医学、食品安全方面扩大其应用潜力,提供更加准确、高效的分析平台,研究者就传感器的性能进行了探究。灵敏度和选择性是衡量标准传感器性能优异的关键,因为在实际样品分析过程中,面临着待测样品成分复杂、含量极低而使分析物不易被传感器响应到其存在的问题。因此,为实现传感器在分析中展示出高特异性、高灵敏度的优良性能,研究者们提出了一系列的信号放大策略,结合电化学传感快速、稳定、易操作的优点,构建了众多性能优异的电化学生物传感器。该文就针对改善传感器性能而提出的几类信号放大策略做简要阐述[1-5]。
1 基于酶辅助的信号放大策略
1.1 基于核酸酶的信号放大策略
核酸内切酶和核酸外切酶统称为核酸酶,它像一把剪刀,能将DNA或RNA剪切成不同的序列片段,这是由于它催化并使DNA磷酸骨架上的磷酸二酯键发生水解。由于酶与底物之间专一性的催化过程,种类不同的核酸酶对应催化底物的种类和被识别切割的位置不同。因此,将核酸酶与传感器的信号放大技术相结合,可以给传感器带来高选择性。研究者们根据不同的设计目的,将核酸酶作为一种辅助工具,实现目标物的循环放大过程或者驱动DNA的自组装行为,由此得到选择性高、灵敏度高的传感器用于多种疾病标志物的检测。
核酸外切酶能沿特定方向将寡核苷酸链从末端开始降解。T7核酸外切酶(T7 Exonuclease,EXO T7)沿5'→3'方向作用于双链DNA或杂交状态RNA/DNA的平末端或粘性末端(5'凹陷端)的磷酸二脂键,使得沿5'→3'方向上的DNA或RNA被降解成单个核苷酸。Miao等[6]利用EXO T7辅助目标RNA循环放大,结合铜纳米簇(CuNPs)构建电化学传感策略检测miRNA。具体工作如图1,目标RNA经Toehold链置换掉双链a/b的b链并形成RNA/a杂交双链,RNA/a出现可以被EXO T7催化水解的5'平末端。EXO T7降解a后从RNA/a释放出RNA,以此作为一个循环。RNA再次与a/b作用,形成1比n的多次链置换和释放过程,由此达到对痕量目标RNA浓度的放大,并通过这样的循环放大释放出大量b链。释放的b链与电极上固定的双链c/d杂交形成5'粘性末端,EXO T7沿5'→3'降解d链,导致电极上剩下单链固定探针c,破坏掉能与铜纳米簇结合的双链c/d信号源模板,得到显著降低的电流信号,从而实现对miRNA的高灵敏检测。
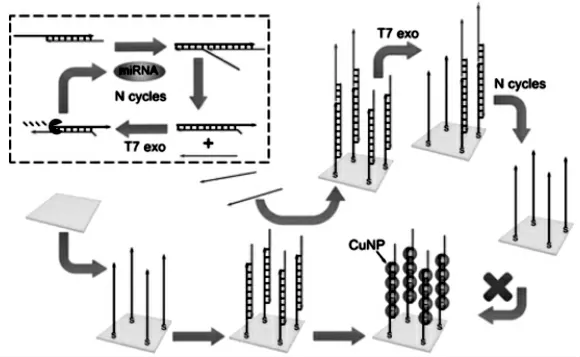
图1 基于Exo T7信号放大的传感器检测miRNA[6]Fig.1 Determination of miRNA based on T7 exonuclease-assisted cascade signal amplification sensor[6]
与核酸外切酶不同,限制性核酸内切酶(又称限制酶)的催化水解位置需要一段特定的识别序列,从识别序列内或其邻近的位置处切割双链DNA,而不是沿着寡核苷酸的端点开始催化降解。Miao等[7]报告了一种基于限制酶裂解DNA的信号放大策略对Ag+进行超灵敏电化学检测。图2所示为这项工作中传感策略的原理:将修饰了探针a的AuNPs与固定在电极上的b探针杂交,使得信号源模板a/AuNPs定位在电极表面上。探针c和b之间具有一个不匹配的胞嘧啶-胞嘧啶(C-C),在目标Ag+的作用下,即可形成CAg+-C形式的复合物,使得探针b和c杂交。Ag+辅助的双链DNA(b/c)具有两个核酸内切酶Nt.CviPII的切割位点。因此,探针b可以被这种切口内切核酸酶(NEase)切割成碎片,从而导致双链体b/c和b/a解体并释放出a/AuNPs,破坏了信号源模板a/AuNPs在电极上的定位。随后,从电极表面释放出Ag+,使得游离探针c再次与另一个完整的探针b杂交作用,经过更多的切割循环后,实现了对目标Ag+循环放大和c的循环利用,导致更多的能负载电活性物质[Ru(NH3)6]3+的a/AuNPs模板离开电极表面,可以观察到显著降低的电化学信号,从而达到检测目的。
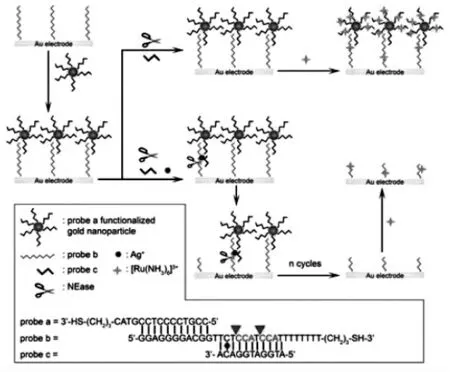
图2 NEase辅助的信号放大策略测定Ag+的图解[7]Fig.2 NEase-assisted signal amplification strategy for the determination of Ag+[7]
1.2 基于连接酶的信号放大
DNA连接酶与核酸酶的催化作用相反,它可连接DNA链3'末端的羟基和另一DNA链5'末端的磷酸基团,使两者生成磷酸二酯键,从而把两段相邻的DNA链连成完整的链。DNA连接酶在传感器信号放大中作为一种常用的工具酶,被利用来构建了许多高灵敏传感器。
Chen等[8]利用连接酶使突变体K-ras靶基因呈指数型复制扩增,构建了一种高灵敏的用于单核苷酸多态性的检测方法。如图3,在这项工作中:在DNA连接酶的作用下,K-ras靶基因作为模板链分别连接DNA探针A和B,探针CP和DP,以此杂交形成新的模板链AB和单链CPDP。在热循环的作用下,K-ras靶基因被释放与模板链AB循环参与到下一个酶促连接反应,从而导致酶连接产物的扩增。来自新一轮连接的产物成为下一轮的靶标,由此得到以指数型方式扩增的酶连接产物,将更多的富含G序列的DP链连接在电极上。在添加辅助序列AP和hemin后,形成大量的G-四链体/hemin模拟酶,并导致ECL信号显著淬灭,实现对单核苷酸多态性灵敏测定。
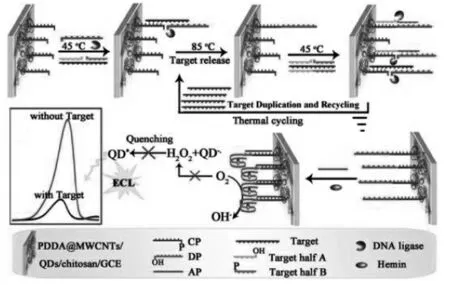
图3 基于DNA连接酶测定基因[8]Fig.3 DNA ligase assisted gene determination[8]
1.3 基于聚合酶的信号放大
DNA聚合酶是DNA复制过程中必不可少的工具酶,在检测痕量靶标基因时被广泛运用于DNA的扩增过程。它能将单个核苷酸(dNTP)沿着模板链加到已有的DNA片段上,形成磷酸二酯键。其具体过程是:在一段特定的引物序列3'-OH末端,DNA聚合酶催化dNTP加入核苷酸链的3'-OH末端形成新的DNA链。由于DNA聚合酶对其引物的专一性及相关模板链的可设计性,它成为一种理想的DNA放大扩增工具,被广泛运用于传感器的信号放大策略中。
Wang等[9]在循环肿瘤DNA(ctDNA)的超灵敏检测过程中,利用双酶辅助的多重扩增策略,实现了对靶标基因的循环放大和电极表面的电信号放大。如图4,这项工作具体的检测原理是:由三螺旋分子开关(THMS)作为生物传感器的分子识别和信号转导探针,核糖核酸酶HII(RNase HII)和末端脱氧核苷酸转移酶(TdT)作为双重酶辅助的多重扩增促进剂。目标ctDNA打开THMS并杂交形成双链RP/ctDNA,触发RNase HII切割双链RP/ctDNA并释放ctDNA,ctDNA循环识别打开THMS,从而产生大量的探针STP。STP与固定在金电极上的捕获探针CP杂交,在TdT的作用下,沿着CP的3'-OH末端延伸并产生稳定的含有富T序列的DNA树状纳米结构,最后使得亚甲基蓝(MB)嵌入DNA树状结构中,产生显著增强的电信号,从而达到检测目的。该传感平台能在血浆等生物流体中检测ctDNA。此外,改变THMS的环序列,该策略可扩展到其他ctDNA的检测中,针对临床癌症的筛查具有潜应用价值。
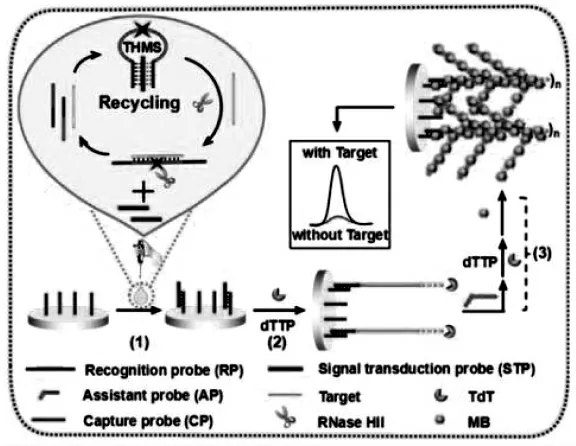
图4 双酶辅助多重扩增的传感器[9]Fig.4 Dual-enzyme-assisted multiplex amplification sensor[9]
近年来,由DNA聚合酶反应衍生而来的滚环放大技术(RCA)在传感策略的信号放大环节中也被广泛应用,这为癌症的便捷转移诊断,预后和治疗提供了有用的信息。如图5,Yang等[10]的这项工作中,在固定电极上通过滚环扩增,在引物和环状DNA模板的作用下,以产生具有许多重复的适体序列多价、有效地捕获人血中的循环肿瘤细胞(CTC)。基于RCA的适体链扩增过程使得传感器捕获靶标CTC的能力增强,大大提高了传感器的灵敏度。此外,该工作还实现了在全血中检测CTC,针对监测人血中CTC的研究提供了可发展平台。
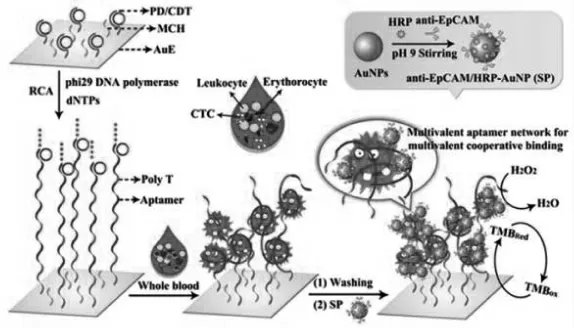
图5 基于RCA信号放大测定CTC[10]Fig.5 Determination of CTC based on RCA signal amplification[10]
1.4 基于DNAzyme的信号放大
DNAzyme是一段特定的具有催化功能的核酸序列的DNA核酸酶,具有金属离子依赖性,借助特定金属离子作为辅因子,可以特异性杂交并切割底物序列。由于其高选择性和高催化功能,被广泛运用于传感的信号放大环节来提高检测的灵敏度。
Lei等[11]利用DNAzyme驱动的DNA Walker构建了高灵敏度测定凝血酶(TB)的电化学生物传感器。 该工作具体如图6,在电极上固定上一种双重功能发夹DNA(HP),其中环区域设计为Mg2+依赖的DNAzyme特异性识别的底物序列,茎区域设计为G-四链体序列片段。当目标物TB存在时,适体靶特异性识别TB并将具有酶促序列的DNA walker(TBA2-DWs)间接引入至金电极,由此引发酶促序列DNAzyme与底物序列杂交。在Mg2+的辅助下,DNA Walker重复杂交并切割底物HP,释放许多G-四链体。最后,hemin进一步结合G-四链体形成G-四链体/hemin络合体并产生增强的电流输出。该方法检测限低至0.58 pmol/L,且检测过程是免标记和无蛋白酶参与的。
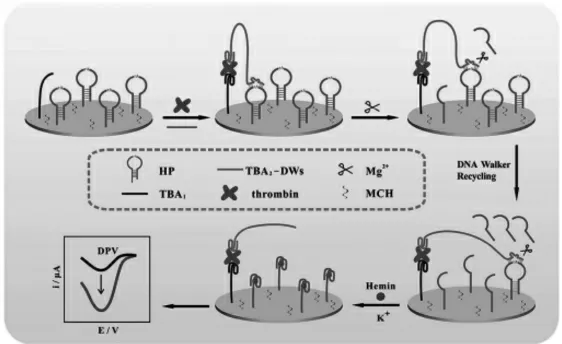
图6 基于DNAzyme的电化学传感器的示意图[11]Fig.6 Scheme of the DNAzyme-Based Electrochemical Sensor[11]
Yang等[12]构建了免标记型的传感器用于凝血酶的检测,传感原理如图7,在凝血酶的作用下,两个不同的凝血酶适体链(S1和S2)的邻近结合置换出Mg2+依赖性的酶促序列S3,S3与电极上的发夹底物DNA杂交并剪切。在K+和氯化血红素(hemin)的协作下,电极上裂解出的底物链通过Hoogsteen氢键形成笼状的G-四链体/hemin络合物。最终导致hemin被捕获在电极上并向电极转移电子,从而产生DPV电信号,实现对凝血酶的检测。
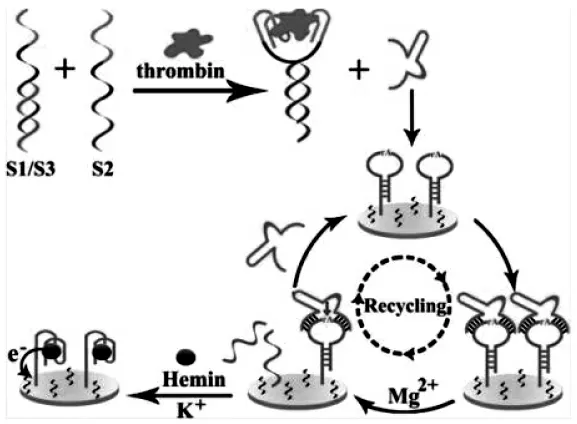
图7 免标记电化学方法测定凝血酶示意图[12]Fig.7 Schematic diagram of label-free electrochemical method for determination of thrombin[12]
2 基于纳米材料的信号放大技术
在传感器研究方面,为了得到更灵敏的、性能优异的电化学生物传感器,研究者们结合纳米材料尺寸效应带来的独特物化性质(如生物相容性好,比表面积大易修饰,导电性能优异),从不同的途径对传感器进行了信号放大[13]。其主要途径有:将纳米材料作为基底修饰在电极上增强其导电性,作为载体用于固载大分子形成信号探针或识别元件[14]。
2.1 纳米材料修饰电极基底的电化学传感平台
研究者们利用纳米粒子体现出来的优异理化性质,将纳米材料与电极传感界面相结合,加快了电子向电极的转移和传导效率,制备出了一系列响应快速、导电性能强的电极基底材料进行信号放大,成功提高了电化学生物传感器的灵敏度。常用到纳米基底材料有:碳纳米材料(如石墨烯、氧化性或还原性石墨烯)、金属纳米材料(AuNPs)或金属复合纳米材料[15]。
石墨烯是一种sp2杂化的二维碳纳米材料,具有较大的比表面积和快速传输电子的能力[16]。利用其氧化物即氧化石墨烯(GO)经电沉积制备成还原石墨烯(rGO)并修饰在电极上提高传感器灵敏度,是一种成熟的信号放大方法。如图8所示,Gan等[17]经电沉积制备rGO作为电极的基底,增强了电活性物质[Ru(bpy)3]2+在传感表面发生氧化还原时的电子转移能力,结合基于末端脱氧核糖核苷酸转移酶(TdT)的信号放大技术,构建了简易且高灵敏的电化学生物传感器,用于监测酸性磷酸酶(ACP)的活性。 此外,该传感策略还成功在稀释的血清样品中检测ACP,具有快速、高选择性,高灵敏度的检测性能。
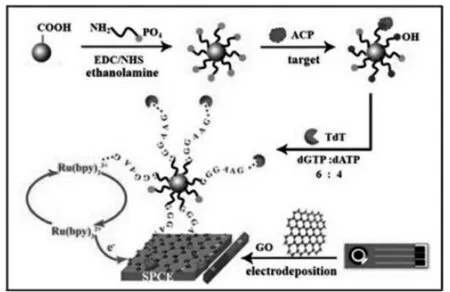
图8 基于TdT和rGO构建电化学方法测定ACP[17]Fig.8 Determination of ACP by an electrochemical method based on TdT and rGO[17]
如Ma等[18]使用二维(2D)金属-有机骨架(MOF)纳米材料2D Cu-TCPP作为电极基底,结合G-四链体/hemin构建了检测双氧水(H2O2)的高灵敏电化学生物传感器。如图9,在这项工作中,研究者以(4-羧基苯基)卟啉(TCPP)为配体,结合Cu2+制备了二维Cu-TCPP MOF材料作为电极基底修饰在电极上。该材料的二维多孔结构化学稳定性好、比表面积大,具有高密度和均匀分散的活性位点,且具有过氧化物模拟酶的催化活性。将其结合G-四链体/hemin辣根过氧化物模拟酶的性质,能够有效地催化靶标H2O2在传感界面发生氧化还原反应,提供了足够暴露的活性位点与H2O2接触。又由于其优异的电化学性质,使电子转移快速,增强了传感器的信号放大能力和灵敏度。
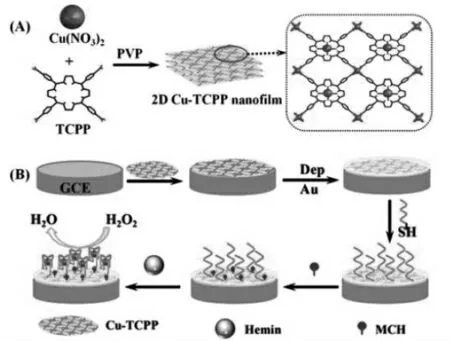
图9 基于二维Cu-TCPP纳米膜的电化学传感器[18]Fig.9 An electrochemical sensor based on twodimensional Cu-TCPP nanomaterials[18]
2.2 纳米材料为载体固载信号探针或信号分子
在构建电化学生物传感平台时,由于纳米材料具有较大的比表面积且和良好的生物相容性,被视为理想的生物大分子(如蛋白质、DNA)的承载介质。利用纳米材料作为载体修饰上识别元件(如适配体、抗体等)的传感器,增加了识别元件捕获靶标的接触概率从而提高了传感器的灵敏度。另一方面,利用纳米材料大的比表面积和暴露出的活性位点固载上大量信号分子,得到信号源更强的复合电活性物质,从而实现传感器的电信号放大。
复合材料的信号放大原理与生物活性材料的亲和力紧密相关,而磁性纳米复合材料可以显著提高传感器的性能。氮掺杂碳微管(NCMTs)作为一种新型的碳材料,由于其大的表面积,高的电导率和低的细胞毒性而受到了广泛的关注,且掺杂在复合材料中的氮原子可以显著增强纳米材料的活性位点。Zheng等[19]通过硅酸铜与氮掺杂磁性碳微管(NCMTs)合成NCMTs@Fe3O4@Cusilicate,设计了一种新型生物传感器,用于测定癌胚抗原CEA肿瘤标志物。如图10,在这项工作中,他们制备了NCMTs@Fe3O4@Cusilicate,其较大的表面积在铜离子的作用下能特异性识别CEA的刀豆蛋白(ConA)并螯合,增强了ConA的吸附能力和负载量,从而提高了与靶标CEA的接触概率,增强传感器的灵敏度。另一方面,结合金纳米团簇(AuNCs)出色的生物相容性、小尺寸、高电导率和比表面积的优点,利用AuNCs来固定适体进一步增强电信号,最终实现了对传感器的信号放大,该传感策略可用于检测血清中的CEA,具有巨大的临床诊断潜力。
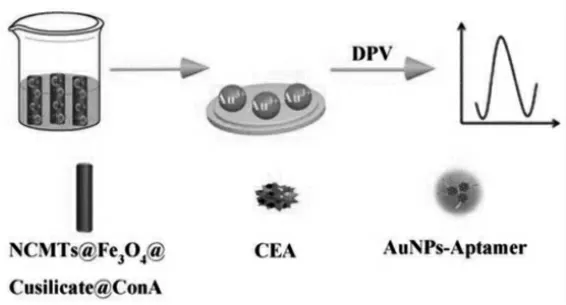
图10 基于NCMTs的豆球蛋白A传感测定[19]Fig.10 Preparation of NCMTs for sensing determination of legumin A[19]
3 基于Toehold介导的自组装信号放大技术
基于酶和复合纳米材料的信号放大技术得到广泛应用,并有效地提高了传感器的灵敏度。但是,酶和纳米材料涉及严苛的使用条件或复杂的制备过程,使得其发展空间受到限制。为了扩展传感器中信号放大技术的方式,Yukre等[20]提出了Toehlod介导的DNA链置换概念。其置换的过程是:一个发夹或双链DNA(A/B)暴露出粘性末端,B链末端提供一条5-8个碱基的单链片段作为支点即Toehold,单链C以该支点为立足点并经碱基互补配对作用与B杂交形成热力学上更稳定的双链B/C,导致A被替换掉从A/B中释放出。基于此概念,研究者们将其拓展衍生出众多有效的信号放大手段,并成功运用于众多传感平台的构建中,其中两个经典的放大原理分别是催化发夹自组装(CHA)和杂交链式反应(HCR)。
3.1 催化发夹自组装(CHA)的信号放大
CHA的信号放大过程是:由一条入侵的寡聚单链经Toehold链置换后引发两个稳定茎-环结构的DNA相互杂交,导致入侵的单链被置换下来。通常将入侵链设计为靶标分子,由此,被置换下来的靶标单链可再次引发新的CHA,经过多次循环后靶标分子形成1:n的放大,从而提高传感器的灵敏度。如Zang等[21]的工作中,利用CHA和FeTMPyP介导的化学发光设计了无需蛋白酶放大的电化学传感策略。如图11,在存在靶标DNA(tDNA)的情况下,tDNA引发CHA形成H1/tDNA中间体,催化H1和H2进一步组装为产物H1/H2双链体并释放tDNA。同时,释放的tDNA可以再一次引发新的一轮CHA,从而促进CHA中H1和H2的循环组装。随后,经CHA反应后的混合溶液与捕获DNA(C-DNA)孵育,所得的dsDNA可与FeTMPyP相互作用形成FeTMPyP@H1CdS量子点(QDs)并修饰电极上,在原位催化鲁米诺的氧化以产生电化学发光,导致显著增强的光电流,从而实现对靶标DNA的高灵敏检测。该传感器经CHA信号放大技术构建,具有优异的选择性和浓度低至fmol/L的检测限,因此在未来的生物分析和分子诊断中具有潜在应用价值。
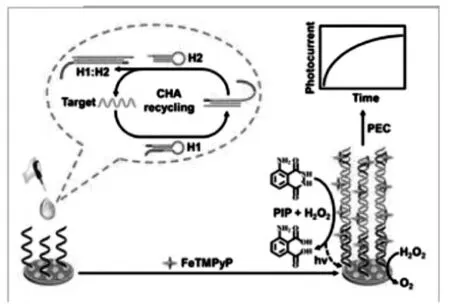
图11 基于CHA放大的电化学传感器[21]Fig.11 Electrochemical sensor based on CHA amplification[21]
如Yu等[22]的这项工作中,在传感界面的DNA中嵌入电活性物质,将双链特异性核酸酶(DSN)辅助的靶标回收与催化发夹装配(CHA)反应相结合,构建了检测microRNA-141(miR-141)的传感平台。其工作原理如图12,从癌细胞中提取miR-141与DNA发夹H1杂交并展开,DSN驱动靶miR-141循环识别并释放出能够打开发夹H2的单链DNA片段Connector。Connector启动随后的CHA反应,将经H2和H3修饰的金纳米粒子(HP-AuNP)在电极上进行自组装形成网状结构。最后使大量带正电荷的RuHex通过静电相互作用与H2/H3双链体的带负电的磷酸骨架相作用,进一步产生显著增加的电化学信号,实现对miR-141的定量检测。该免标记的电化学方法利用DSN辅助靶标回收和CHA反应的扩增效率高,可扩展用于临床应用中miRNA的高灵敏度测定。
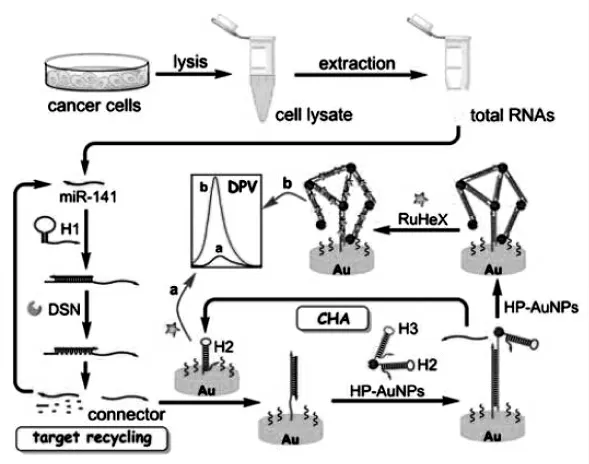
图12 基于DSN辅助靶标回收和CHA的级联放大研究示意图[22]Fig.12 Schematic Illustration of Cascade Amplification of DSN-Assisted Target Recycling and CHA Reaction[22]
3.2 杂交链式反应(HCR)的信号放大
HCR的信号放大过程是:由一条入侵的寡聚单链经Toehold链置换后引发两个稳定茎-环结构的DNA交替杂交,最终杂交延伸形成呈具有开口的双链聚合物。由此形成的双链聚合物,由于DNA双链磷酸骨架的延伸,因此可负载上更多的电活性物质产生放大的电信号,从而提高传感器的灵敏度。如Guo等[23]基于HCR的信号放大技术,构建了检测外泌体中与癌症相关的基因miR-122的超灵敏电化学传感平台。如图13,在这项工作中,将发夹DNA(hpDNA)探针固定在电极表面上,随后通过引发链即靶标miR-122打开hpDNA,并触发DNA1(H1)和DNA2(H2)在电极上的HCR反应,经交替杂交后形成延长的带切口的双链DNA。利用电活性物质RuHex对DNA双链体的强结合力,使得电极表面负载上众多的信号分子,从而达到信号放大的效果和检测靶标miR-122的目的。在最佳条件下,该传感器成功地在不同癌细胞衍生的外泌体中检测到了miR-122,证明了其在癌症诊断中的潜在应用。
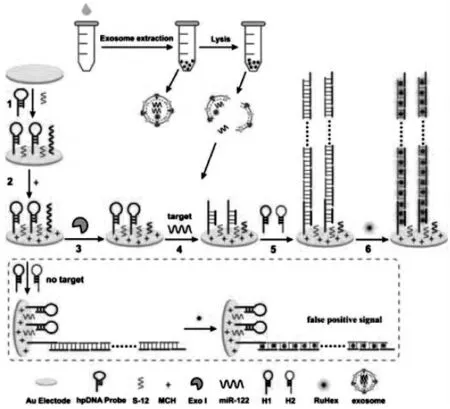
图13 基于HCR电分析法测定miRNA[23]Fig.13 Schematic Illustration of the HCR Electroanalytical Assay for miRNA Detection[23]
4 结论与展望
综上所述,电化学生物传感器是多学科交叉和发展的产物,它是分析化学与生命科学相融合的结果,在分析化学领域检测体现出操作简易、灵敏度高、响应快速、特异性强的优点,尤其在疾病标志物的分析检测中发挥着重要作用。科研人员探索了多种信号放大策略与之结合,增强了电化学生物传感器的灵敏度和准确性,拓展了检测策略的可应用潜力和范围,并已在多个领域的实际应用中取得优秀的研究成果。随着时代飞速发展,多种生物技术以及纳米材料相继兴起,体外检测受到了越来越多的关注,而电化学生物传感器的探究也面对着具有很大的挑战和机遇。相信在21世纪的生物经济时代,多学科的交叉融合及齐肩并进,会为电化学传感开阔新的广阔空间,在分析、生命科学、环境等多个领域推动社会的进步。
