壳寡糖对体外诱导的非酒精性脂肪肝细胞模型的降脂机理研究
2020-10-27赵梦瑶邱勇隽夏泉鸣赵黎明
沈 欣, 赵梦瑶, 邱勇隽, 夏泉鸣, 赵黎明
(华东理工大学 生物工程学院, 上海 200237)
壳寡糖(chitooligosaccharide,COS)主要是由海洋虾、蟹壳中提取出的天然氨基多糖(壳聚糖和几丁质)水解制得,是由D-氨基葡萄糖(或少量N-乙酰-D-氨基葡萄糖)通过β-1,4-糖苷键连接而成的一种低聚糖(及其盐),聚合度 (degree of polymerization,DP) 一般分布在2~10。壳寡糖具有许多健康益处,例如抗菌[1-2]、改善糖尿病[3]、增强免疫力[4]、抗高血压[5]和抗肿瘤[6]等等。研究还发现,壳寡糖及其衍生物可以显著降低体重,调节血脂水平[7],可作为膳食补充剂用于改善肥胖和血脂异常。
目前,非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)发病率较高,与多种代谢综合征密切相关[8-9]。研究显示,NAFLD的特征是肝内甘油三酯含量的过度增加[10],因此参与甘油三酯代谢的一些基因在其病理发展中起着至关重要的作用,其中分化簇36(CD36)是一种重要的跨膜蛋白,参与促进极低密度脂蛋白和长链游离脂肪酸的吸收[11-13]。早期研究表明,CD36是肝X受体α(LXRα)、孕烯醇酮 X受体(PXR)和过氧化物酶体增殖物受体γ(PPARγ)协调参与脂肪酸吸收的共同靶标[14]。此外,二酰基甘油酰基转移酶 2(DGAT2)是通过在内质网膜上将二酰基甘油和乙酰辅酶A转化为甘油三酯的关键限速酶[15]。缺乏DGAT2的小鼠肝脏中甘油三酯含量降低了近90%,在血浆中降低了64%[16],表明DGAT2在甘油三酯合成途径中具有重要的作用。
研究表明,不同分子量(1 000 Da和3 000 Da)的壳寡糖可以减少油酸诱导的NAFLD模型中脂质的积累[17];并且通过对壳寡糖混糖及单一聚合度2~6的壳寡糖进行降脂活性筛选,发现低聚合度的壳寡糖降脂效果优于壳寡糖混糖[18],但是目前壳寡糖改善非酒精性脂肪肝病的潜在保护机制方面的研究还不够完善。因此,本研究拟通过对脂肪酸吸收和甘油三酯合成通路的相关基因和蛋白进行测定,进一步探究壳寡糖的体外降脂活性和潜在的作用机制,希望为将壳寡糖进一步开发成具有降脂护肝效果的膳食补充剂提供理论依据。
1 材料与方法
1.1 材料与试剂
HepG2人肝癌细胞株,购于中科院细胞库;壳寡糖(COS,脱乙酰度≥95%),由华东理工大学发酵工业分离提取技术研发中心自制;DMEM (dulbecco’s modified eagle’s medium)高糖培养基、PBS(phosphate buffer saline) (pH值7.4)、PS (penicillin-streptomycin solution) (双抗)和抗荧光淬灭封片剂,生工生物工程(上海)股份有限公司;BSA(albumin bovine V)牛血清白蛋白 (不含脂肪酸) ,北京索莱宝科技有限公司;油红O(Oil Red O)和MTT(噻唑蓝) ,美国Sigma公司;甘油三酯、总胆固醇、高低密度脂蛋白胆固醇及游离脂肪酸检测试剂盒,南京建成科技有限公司;CD36、PPARγ、PXR和LXRα抗体,美国Protein tech公司;DGAT2抗体,美国Affinity公司。引物序列由生工生物工程有限公司合成:
CD36:Forward:5′-GAGAACTGTTATGGGGCTAT-3′; Reverse:5′-TTCAACTGGAGAGGCAAAGG-3′
DGAT2:Forward:5′-CGAAAGCCACTTCTCATACA-3′; Reverse:5′-TGCCTACTACTGCCCTCAC -3′
PPARγ:Forward:5′-TTGCAGTGGGGATGTCTCAT-3′; Reverse:5′-TTTCCTGTCAAGATCGCCCT -3′
LXRα:Forward:5′-GATCGAGGTGATGCTTCTGGAG-3′;Reverse:5′-CCCTGCTTTGGCAAAGTCTTC-3′
PXR:Forward:5′-GGCCACTGGCTATCACTTCAA-3′;Reverse:5′-TTCATGGCCCTCCTGAAAA-3′
18S RNA:Forward:5′-CGGCTACCACATCCAAGGAAG-3′;Reverse:5′-AGCTGGAATTACCGCGGCT-3′
1.2 仪器与设备
Synergy HT型酶标检测仪,美国BioTeK公司;5427 R型高速低温离心机,Eppendorf中国有限公司;Ti-U型倒置荧光显微镜,日本Nikon公司;CFX96型qPCR仪、170-4481型电泳仪、Tanon4200型成像系统,美国Bio-Rad公司;1379型生物安全柜,美国Thermo公司。
1.3 实验方法
1.3.1细胞培养和处理
HepG2细胞选用含有质量分数为10%的胎牛血清的高糖培养基(DMEM),在37 ℃和体积分数为5%的CO2培养箱中培养,每2~3 d进行传代培养。
将油酸钠溶于含质量分数1%的BSA牛血清白蛋白的高糖培养基中,配制成终浓度为含0.2 mmol/L油酸钠培养基。将细胞铺板在96孔/24孔/6孔板中,培养24 h后进行分组处理:将含1% BSA牛血清白蛋白的高糖培养基作为空白对照组;将含有0.2 mmol/L的油酸钠-BSA的高糖培养基作为模型组;将不同剂量壳寡糖与油酸钠-BSA的高糖培养基同时处理作为共同处理组。
1.3.2细胞存活率测定
通过MTT法测定细胞存活率。将HepG2细胞与10 μL 5 mg/mL的MTT在37 ℃孵育4 h,除去溶液后,每孔加入150 μL的二甲基亚砜,使用酶标仪在490 nm下测量吸光度。细胞存活率计算方法见式(1)。
细胞存活率=
(OD样品-OD调零)/(OD空白-OD调零)×100%。
(1)
式(1)中,OD样品表示样品组吸光度;OD调零表示调零组吸光度;OD空白表示空白组吸光度。
1.3.3油红O染色
将HepG2细胞以105个细胞/孔的密度接种在24孔板中培养24 h后,用磷酸盐缓冲液洗涤3次,并在室温下用质量分数4%多聚甲醛固定30 min。除去多聚甲醛后,用磷酸盐缓冲液洗涤3次,然后每孔加0.5 mL油红O溶液染色,20 min后用PBS洗涤两次,并在荧光显微镜下观察拍照。每孔加200 μL异丙醇萃取油红O染料10 min,并通过酶标仪在510 nm下测量吸光度。
1.3.4细胞脂质水平的测定
将HepG2细胞按1.3.1中条件处理24 h后,收集细胞并用预冷的PBS洗涤两次。添加200 μL 2%Triton X-100到每个孔中,并通过超声破碎细胞。通过BCA(bicinchonininc acid)法蛋白定量试剂盒测定蛋白浓度,使用甘油三酯、总胆固醇、高低密度脂肪酸胆固醇和游离脂肪酸试剂盒分别测定相应浓度。
1.3.5mRNA定量
各组细胞经1.3.1中条件处理24 h后,收集细胞提取总RNA,检验合格后使用逆转录试剂盒将总RNA合成cDNA,使用AceQ®qPCR SYBR®Green Master Mix经实时荧光定量PCR仪对mRNA进行定量。采用2-ΔΔCT方法计算mRNA的相对量,计算公式见式(2)。
ΔCT=ΔCT(试验样品)-ΔCT(基准样品);
ΔCT(试验样品)=CT(试验样品、目的基因)-
CT(试验样品、内参基因);
ΔCT(基准样品)=CT(基准样品、目的基因)-
CT(基准样品、内参基因)。
(2)
式(2)中,CT值是每个反应管内的荧光信号到达设定的域值时所经历的循环数。
1.3.6蛋白质含量测定
各组细胞经1.3.1中条件处理24 h后,收集细胞提取总蛋白,使用BCA法蛋白定量试剂盒测定蛋白浓度。制备好的蛋白样品经电泳分离、转膜,在室温下,将膜放在含有质量分数5%脱脂牛奶的TBST(tris buffered saline Tween)溶液中封闭1 h,然后置于一抗(CD36、DGAT2、LXRα、PXR、PPARγ)中孵育过夜(4 ℃)。用TBST洗膜3次,将膜放入二抗中,在室温下孵育1 h。通过化学发光ECL(enhanced chemiluminescence)方法分析并用Tanon 4200成像系统进行图像数据分析。
1.4 数据处理
每个实验至少重复3次,数据表示为平均值±SD。采用SPSS软件通过单因素方差分析和Duncan多重比较分析实验组之间的统计结果。P<0.05被认为具有统计学意义,并用不同的字母表示。
2 结果与分析
2.1 壳寡糖对HepG2细胞的细胞毒性分析
通过MTT法测定了不同质量浓度壳寡糖(0.1、0.5、1.0、2.0、3.0、4.0、5.0 mg/mL)对HepG2细胞存活率的影响,实验结果见图1。由图1可知,与对照组相比,较高质量浓度(>4.0 mg/mL)壳寡糖处理组中HepG2细胞存活率显著降低(P<0.05)。因此,本研究选择质量浓度小于等于4.0 mg/mL的壳寡糖用于后续实验。

图1 壳寡糖与油酸钠共处理对HepG2细胞存活率的影响Fig.1 Effect of co-incubation of COS and sodium oleate on cytotoxicity in HepG2 cells
2.2 壳寡糖对HepG2细胞模型脂质积累的影响
选用不同质量浓度(0.1、0.5、1.0、4.0 mg/mL)壳寡糖与油酸钠共同处理HepG2细胞24 h,通过油红O染色测定各实验组细胞内总脂质含量,结果见图2。从图2可以看出,与模型组相比,不同质量浓度的壳寡糖显著降低了胞内总脂质积累量,并在一定质量浓度范围呈现剂量依赖。因为0.1 mg/mL与0.5 mg/mL 壳寡糖处理组之间脂积累量未出现显著性差异,所以后续实验选用0.5、1.0、4.0 mg/mL三个作用效果较优的质量浓度。

A:空白组;B:油酸钠组;C:油酸钠与0.1 mg/mL壳寡糖组;D:油酸钠与0.5 mg/mL壳寡糖组;E:油酸钠与1.0 mg/mL壳寡糖组;F:油酸钠与4.0 mg/mL壳寡糖组。不同小写字母表示差异显著(P<0.05)。图2 不同剂量壳寡糖对NAFLD细胞模型内总脂质积累的影响Fig.2 Effects of COS on cellular lipid accumulation in NAFLD cell model
对各组细胞胞内脂质生化指标进行测定,结果见图3。由图3可以发现,油酸钠组细胞胞内甘油三酯、总胆固醇、低密度脂蛋白胆固醇和游离脂肪酸的含量与空白对照组相比显著升高(P<0.05),证明NAFLD细胞模型构建成功。不同质量浓度壳寡糖处理组细胞胞内甘油三酯、低密度脂蛋白胆固醇和游离脂肪酸的含量显著下降,呈现剂量依赖;其中4.0 mg/mL的壳寡糖处理组甘油三酯、低密度脂蛋白胆固醇和游离脂肪酸的含量分别下降了22%、41%和76%,具有统计学意义(P<0.05)。不同质量浓度壳寡糖的处理对胞内总胆固醇和高密度脂蛋白胆固醇的水平无显著性影响,推测壳寡糖可能介导了甘油三酯合成及脂肪酸吸收通路相关基因的表达,从而达到降脂效果。
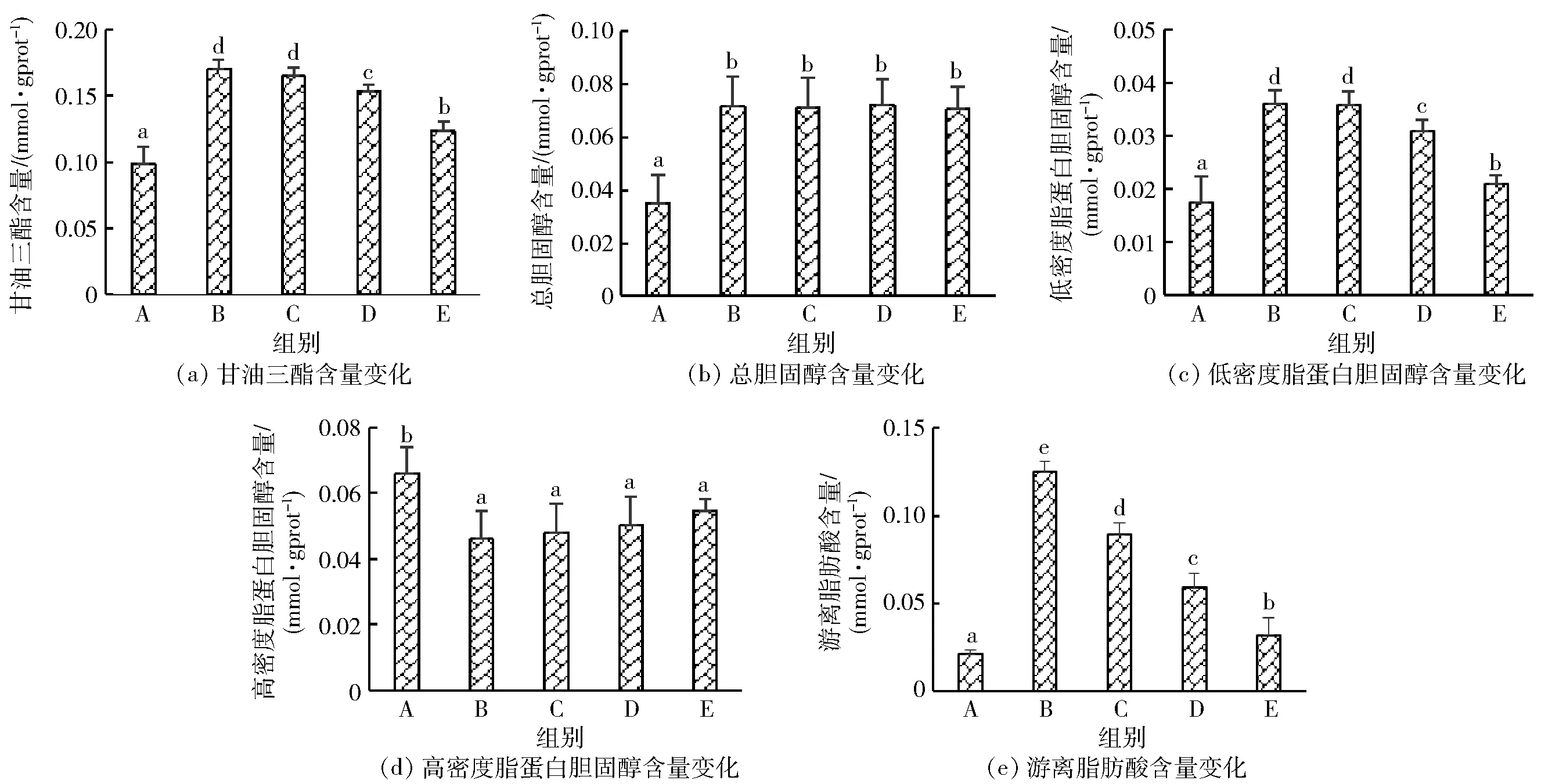
A:空白组;B:油酸钠组;C:油酸钠与0.1 mg/mL壳寡糖组;D:油酸钠与1.0 mg/mL壳寡糖组;E:油酸钠与4.0 mg/mL壳寡糖组。不同小写字母表示差异显著(P<0.05)。图3 不同剂量壳寡糖对NAFLD细胞模型内各脂质生化指标的影响Fig.3 Effects of COS on biochemistry level of lipid profiles in NAFLD cell model
2.3 壳寡糖对脂肪酸吸收和甘油三酯合成途径相关基因表达的影响
进一步探究壳寡糖对改善脂肪变性和脂质积累的可能性机制,通过qPCR法测定了甘油三酯合成和脂肪酸吸收通路的相关基因表达量,选用1.0、4.0 mg/mL的壳寡糖处理NAFLD细胞模型,结果见图4。由图4可知,壳寡糖处理可以显著抑制油酸钠诱导的DGAT2、LXRα、PPARγ、CD36和PXR的mRNA表达水平上升,具有统计学意义(P<0.05)。这些结果表明,壳寡糖可以通过在转录水平上调节甘油三酯合成和脂肪酸吸收通路从而起到改善油酸钠诱导的肝细胞脂变性。

A:空白组;B:油酸钠组;C:油酸钠与1.0 mg/mL壳寡糖组;D:油酸钠与4.0 mg/mL壳寡糖组。不同小写字母表示差异显著(P<0.05)。图4 壳寡糖对NAFLD细胞模型内质脂代谢相关基因的影响Fig.4 Effects of COS on lipid metabolism-related genes in NAFLD cell model
2.4 壳寡糖对脂肪酸吸收和甘油三酯合成途径相关蛋白表达的影响
为了进一步证实壳寡糖对甘油三酯合成和脂肪酸吸收途径的抑制作用,通过Western blot 检测了不同处理组中DGAT2、LXRα、PPARγ、CD36和PXR的蛋白相对表达量,结果见图5。从图5可以看出,油酸钠组中CD36、DGAT2、LXRα、PXR和PPARγ的蛋白相对表达量升高,分别达到了对照组的1.5、4.3、2.4、5.6、1.3倍,而壳寡糖处理则显著抑制了其蛋白相对表达量的增长趋势。该结果与其mRNA表达趋势相似,表明壳寡糖可以在mRNA和蛋白质水平上调节甘油三酯合成和脂肪酸吸收通路。
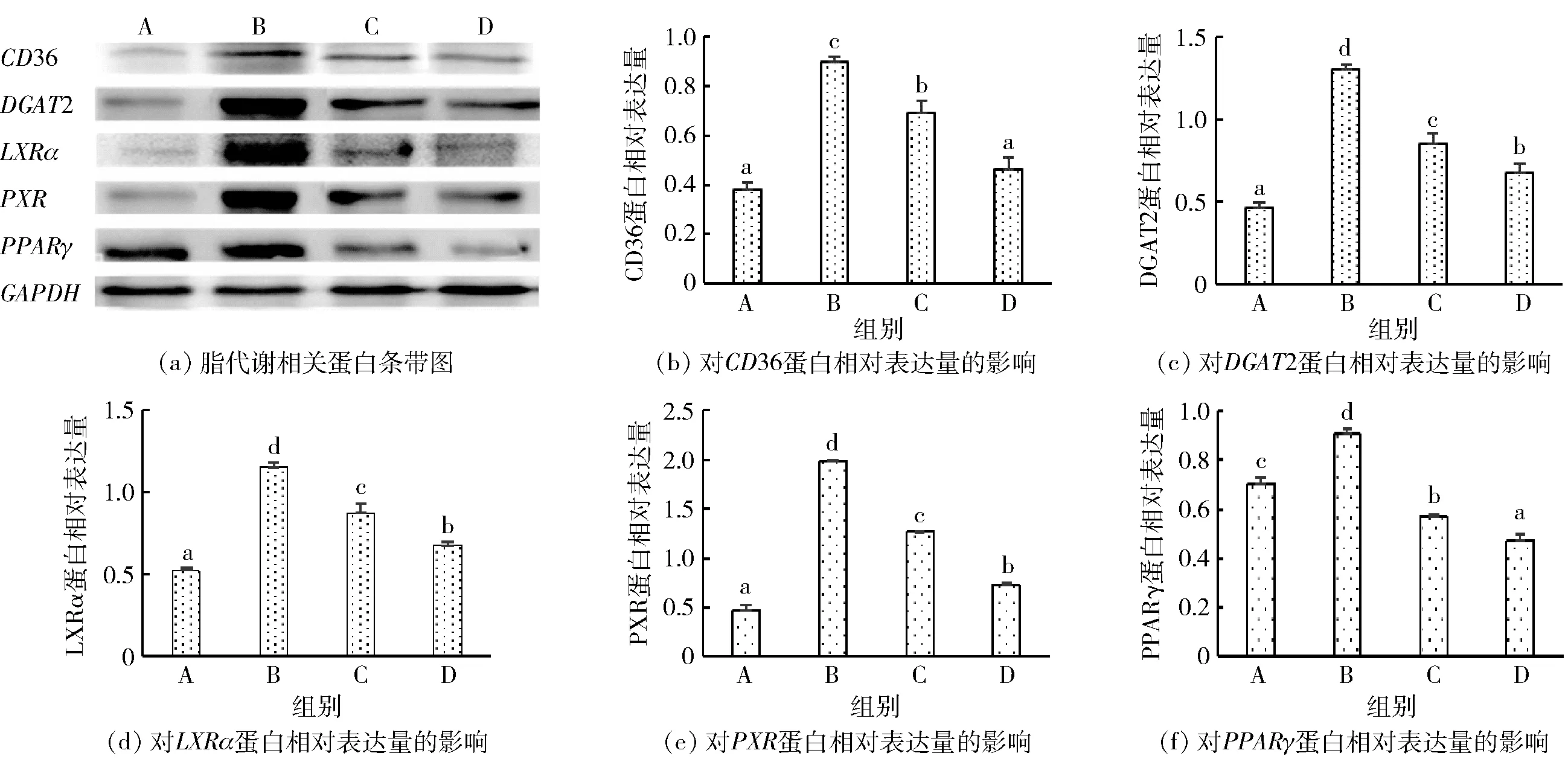
A:空白组;B:油酸钠组;C:油酸钠与1.0 mg/mL壳寡糖组;D:油酸钠与4.0 mg/mL壳寡糖组。不同小写字母表示差异显著(P<0.05)。图5 壳寡糖对NAFLD细胞模型内脂质代谢相关蛋白的影响Fig.5 Effects of COS on proteins expression related to lipid metabolism in NAFLD cell model
3 结 论
壳寡糖因具有多种生物活性而被广泛研究,而非酒精性脂肪肝病目前作为全球常见的慢性疾病[19]并无相关的临床特效药物。利用壳寡糖的降脂活性,将其开发成为具有改善非酒精性脂肪肝病的膳食补充剂具有重要的意义。CD36作为长链脂肪酸的膜受体,参与脂质代谢的多个过程,包括脂质摄入,脂蛋白的产生和运输、储存和分解[20]。早期研究表明,高脂饮食会显著提高肝脏中CD36的蛋白表达水平,并显著增加肝脏中甘油三酯和低密度脂蛋白胆固醇的含量[21-22]。在本研究中,壳寡糖处理可以显著降低胞内游离脂肪酸、甘油三酯和低密度脂蛋白胆固醇的含量,在一定处理质量浓度范围内呈现剂量依赖,该过程伴随着CD36基因和蛋白表达的显著降低。这与早期研究报道小鼠脂肪变性的改善伴随着肝CD36表达的下调[23-24]结果相一致。同时,壳寡糖处理可显著降低LXRα、PXR和PPARγ的mRNA和蛋白表达水平,由此推测壳寡糖可以通过调节CD36介导的脂肪酸吸收通路来逆转肝脂肪变性。另有研究显示,DGAT2表达量的轻微增加可能会显著增加肝脏中甘油三酯的含量[25],而DGAT2抑制剂可以抑制肝脏中DGAT2的表达从而抑制肝脏脂肪变性[26]。在本研究中,壳寡糖处理显著下调DGAT2的基因和蛋白表达,这有助于抑制肝脏中甘油三酯的合成从而改善脂质积累。
研究了壳寡糖对油酸钠诱导的HepG2细胞中脂质积累的影响,壳寡糖表现出有效的降肝脂作用,通过抑制DGAT2、LXRα、PPARγ、CD36和PXR的表达来抑制脂肪酸的吸收和甘油三酯的合成,从而改善肝脂肪变性。希望本研究结果可为将壳寡糖作为降脂护肝功能的膳食补充剂原料提供理论参考。
