壳寡糖-O-曲酸聚合物的理化性质及抗氧化活性研究
2020-10-27刘晓丽夏文水
刘晓丽, 夏文水
(江南大学 食品科学与技术国家重点实验室/食品学院/江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
近年来,许多天然多糖及其衍生物已被证明具有良好的抗氧化活性,并被开发为新型的潜在抗氧化剂[1-3]。壳寡糖(chitooligosaccharide, COS)是由D-氨基葡萄糖(或少量N-乙酰-D-氨基葡萄糖)通过β-1,4-糖苷键连接而成的一种低聚糖,是含量仅次于纤维素的第二大天然生物多糖。壳寡糖具有优良的抗菌性、生物无毒性、可自然降解性以及良好的生物相容性等特点[4-6],在食品、医药和农业等多个领域得到了广泛应用[7-9]。但由于壳寡糖抗氧化能力较传统抗氧化剂如丁基羟基茴香醚(BHA)和丁基羟基甲苯(BHT)相对较低,因此限制了其在食品行业的进一步应用[10]。壳寡糖的分子链中有3个活性位点,分别是C2位的伯胺、C6位的伯羟基和C3位的仲羟基,这是对其进行结构修饰的良好活性位点[11-12]。
近年来,已有越来越多的研究人员致力于具有良好生物相容性、安全无毒的新型壳寡糖衍生物的制备和应用研究。Sun等[13]通过控制化学反应过程中二羟乙酸的用量,分别制备出一种具有良好的水溶性、低毒性和抗氧化性的羧甲基壳寡糖衍生物和3种不同取代度的N-羧甲基壳寡糖衍生物,结果显示,具有较低取代度的衍生物清除自由基的能力最强。Liu等[6]将具有抗菌活性的曲酸基团,通过接枝反应与壳寡糖的活性基团进行反应,得到了一系列具有良好生物相容性和安全无毒的衍生物。在壳寡糖的活性位点上可以通过接枝反应[14]、季铵盐反应[15]、羧甲基反应等[16]合成出多种衍生物。然而,目前报道的一些壳寡糖烷基化反应产物的生物选择性较低,因而存在产物的生物相容性差、细胞毒性和溶血活性高等问题[17-18]。曲酸(kojic acid, KA),化学名称为2-羟甲基-5-羟基-1,4-吡喃酮,是由一些微生物如曲霉属真菌(Aspergillus)、醋杆菌属(Acetobacter)和青霉菌属(Penicillium)等经过好氧发酵产生的一种常见的弱酸性代谢产物[19-20]。由于其特有的类似苯邻二酚的结构,曲酸具有抗菌、抗病毒、抗发炎、抗肿瘤、抗氧化[21]等作用,并且具有安全无毒,pH值适用范围广、热稳定性好、受热不易分解、对人体无刺激和食用安全等优点。日本早在1988年就批准曲酸作为食品和医药添加剂使用[21]。氯代曲酸作为曲酸的衍生物之一,具有良好的抗氧化活性的同时,还是良好的亲核、亲电取代的配体,并已被广泛应用于食品、医疗、化妆品和化学工业等领域[22-23]。
基于本课题组前期的研究,并受壳寡糖和曲酸的结构及其功能特性的启发,本研究设计了一种制备壳寡糖-O-曲酸聚合物(COS-O-KA)的方法[7],拟对其反应条件、产率、取代度、分子量、多分散性指数、水溶性、酸稳定性、体外细胞毒性、zeta电位、抗氧化活性和动物毒性进行系统评价。希望为合理利用壳寡糖这种可再生资源提供理论参考。
1 材料与方法
1.1 材料与试剂
曲酸,分析纯,武汉伟盛生物有限公司;壳寡糖,脱乙酰度90%,相对分子质量8.828 kDa,浙江金壳药业有限公司;壳寡糖-O-曲酸聚合物,自制。3-乙基苯并噻唑啉-6-磺酸(ABTS),购自美国霍尼韦尔国际有限公司。硝基蓝四唑(NBT)和2,2-二苯-1-苦基肼(DPPH)购自德国Sigma-Aldrich公司。人主动脉平滑肌细胞(HASMC CC-2571),购自赛奇生物工程有限公司。核黄素、蛋氨酸、Tris-HCl缓冲溶液、N-甲基哌嗪、苯甲醛、吡啶、铁氰化钾、乙二胺四乙酸(EDTA)、二甲亚砜(DMSO)、亚硫酰氯(SOCl2)、磷酸盐等化学试剂,购于国药有限公司。健康的昆明系雌性小鼠[6~8周,(20.0±2.0) g,40只],购于斯贝福(北京)实验动物科技有限公司,实验动物生产许可证号:SCXK(京)2019-0010。其余试剂均为国产分析纯。
1.2 仪器与设备
DK-8AXX型水浴锅,上海一恒科技有限公司;SPX型智能生化培养箱,南京实验仪器厂;D8Advance型X-射线结晶衍射仪,德国布鲁克AXS有限公司;UV-1000型紫外-可见分光光度计,上海天美科学仪器有限公司;F-7000型荧光光谱仪,日本日立公司;Nexu S470型傅立叶变换红外光谱仪,美国Nicolet Instrument Thermo公司;TGA/SDTA851e型热分析系统,梅特勒-托利多仪器有限公司;AV400型核磁共振波谱仪,德国Brucker公司。
1.3 实验方法
1.3.1COS-O-KA的制备
参照Liu等[24]的方法制备出氯代曲酸;将一定量的壳寡糖溶解于70 mL体积分数为1%的醋酸溶液中,再加入120 mL的甲醇,搅拌均匀,在60 ℃下缓慢加入苯甲醛和甲醇的混合液,调节 pH值为7.0,抽滤,收集沉淀,用无水乙醇索氏提取12 h,真空干燥,研磨后得粉末,即得到壳寡糖希夫碱;将一定量的氯代曲酸和壳寡糖希夫碱分别溶解于50 mL的二甲基甲酰胺中后,加入一定量的吡啶,搅拌反应一段时间,再将过量的丙酮加入混合物中终止反应,索氏提取以除去二甲基甲酰胺后,真空干燥得到壳寡糖席夫碱-O-曲酸衍生物;向制得的一定量的上述衍生物中添加0.25 mol/L的盐酸与乙醇[V(盐酸)/V(乙醇)= 1∶4]混合液,室温搅拌12 h后,用质量分数为10%的Na2CO3调节pH值至中性,用丙酮反复洗涤多次,抽滤、真空干燥;将干燥好的产品装在透析袋中透析12 h,待浓缩到一定体积时,加入足量的丙酮沉淀,抽滤、真空干燥,最终得到经纯化的褐色的壳寡糖-O-曲酸聚合物(COS-O-KA),具体制备路线、反应条件、得率、取代度、分子质量和多分散性指数如图1和表1。
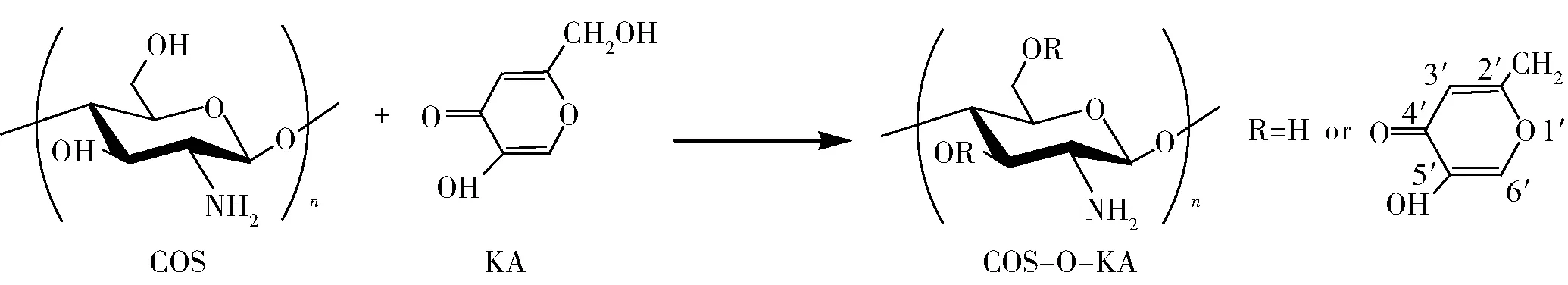
图1 COS-O-KA的制备路线Fig.1 Reaction scheme for preparation of COS-O-KA
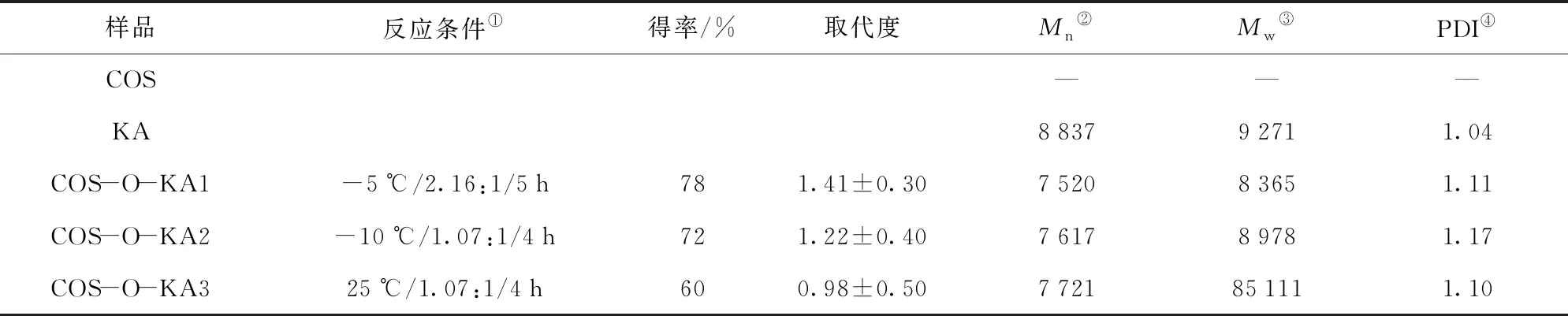
表1 COS-O-KA1-3的反应条件、得率、取代度、分子质量和多分散性指数
1.3.2合成产物的结构表征
将原料壳寡糖和COS-O-KA样品溶解在D2O中,以TMS为内标,用核磁共振波谱仪对合成产物进行1H核磁和13C核磁图谱检测。
1.3.3合成产物的水溶性测定
将5 g样品,即原料壳寡糖、不同取代度的壳寡糖-O-曲酸聚合物(COS-O-KA1、COS-O-KA2和COS-O-KA3)分别溶解于100 mL体积分数为1%的乙酸中。在溶液中逐渐加入1 mol/L NaOH溶液。采用紫外-可见分光光度计测定溶液在600 nm处的透射率[25]。
1.3.4合成产物的体外溶血活性测定
以健康的昆明系雌性小鼠血液为作用对象,每管2 mL,轻轻摇晃采血管以防止血液凝结,在3 000 r/min下离心5 min,得到下层的血红细胞和上层的血浆。配制一系列浓度梯度含有待测样品的PBS溶液。用HEPES(4-羟乙基哌嗪乙磺酸)溶液稀释一定量的血红细胞,离心5 min,移除上清液,重复洗涤两次,补加一定量的HEPES溶液,使血红细胞的最终体积分数为3.3%。取90 μL配制好的血红细胞溶液于无菌96孔板中,再在每孔中加入10 μL系列浓度梯度的待测样品的PBS溶液,阴性对照组为HEPES溶液,阳性对照组为体积分数为1%的Triton X-100溶液,37 ℃ 100 r/min下孵育1 h、离心,采用酶标仪在405 nm处检测。利用式(1)计算溶血率。
H=[(A-A0)/(A100-A0)]×100%。
(1)
式(1)中:A为实验组吸光度值,A0为阴性对照组吸光度值,A100为阳性对照组吸光度值。
1.3.5合成产物的体外生物相容性测定
采用MTT(噻唑蓝)法检测经样品作用后人主动脉平滑肌细胞存活率。将人主动脉平滑肌细胞(HASMC CC-2571)加入96孔板中,加入不同浓度的待测样品培养液,置于37 ℃的培养箱中分别培养24 h至细胞贴壁;弃去原培养基,加入不同浓度的待测样品培养液,置于37 ℃的培养箱中分别培养24 h后,再加入一定量的 MTT 溶液,置于培养箱中继续培养4 h;去除培养液,加入一定量的DMSO,100 r/min振荡5 min后用酶标仪于570 nm处测量吸光度值,并计算细胞存活率[26]。
1.3.6合成产物的DPPH自由基清除能力测定
将待测样品稀释至不同浓度,分别取样0.3 mL于试管中,再分别加入2.7 mL的DPPH甲醇溶液(60 μmol/L),在室温下避光反应30 min,于518 nm 处测定溶液的吸光值[27]。维生素C(VC)溶液作为其抗氧化性的阳性对照实验。DPPH自由基清除率计算方法见式(2)。
I=(A0-As)/A0×100%。
(2)
式(2)中:I为待测样品对DPPH自由基的清除率,%;A0为DPPH溶液加去离子水作为空白对照的吸光度值;As为样品溶液与DPPH溶液进行反应后的吸光度值,并计算IC50值,IC50值越小,表示清除能力越强。
1.3.7合成产物的ABTS+自由基清除能力测定
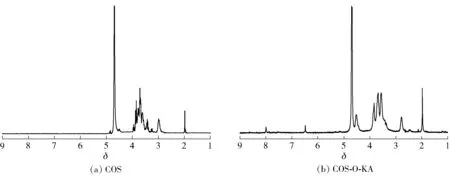
图2 COS和COS-O-KA的1H核磁图谱Fig.2 1H NMR spectra of COS and COS-O-KA
分别配制浓度为7 mmol/L的ABTS溶液和浓度为2.5 mmol/L的过硫酸钾溶液,将二者等体积混合,在室温下避光反应16 h。取不同浓度梯度的待测样品0.3 mL,加入试管中,分别再加入2.7 mL ABTS工作液轻轻振荡,使其混合均匀,室温避光反应30 min,于735 nm处测定溶液的吸光度值。VC溶液作为其抗氧化性的阳性对照实验。计算IC50值,IC50值越小,表示清除能力越强[28],计算方法见式(3)。
I=(A0-As)/A0×100%,
(3)
式(3)中:I为待测样品对ABTS+自由基的清除率,%;A0为ABTS溶液加去离子水作为空白对照的吸光度值;As为样品溶液与ABTS溶液进行反应后的吸光度值。
1.3.8合成产物的动物毒理性实验
参照Li等[29]的方法,通过小鼠尾静脉注射制得的样品溶液,以判断抗氧化剂的急性毒性作用。以健康的昆明系雌性小鼠为作用对象,将小鼠随机分为试验材料组和对照两组,10只为一组。将抗氧化溶液按照不同的剂量组通过尾静脉注射到小鼠体内,生理盐水作为阴性对照, 控制两组小鼠除对照条件以外,其余饲养条件均相同。观察小鼠生物学反应,注射后每2 d称量小鼠体重变化,并观察一般状态、 毒性表现及死亡情况。
1.4 数据处理
采用SPSS 18.0软件对实验数据进行多重比较、显著性分析。
2 结果与分析
2.1 合成产物的结构表征结果
壳寡糖和COS-O-KA的1H核磁图谱见图2。由图2可知,壳寡糖的各个吸收峰的化学位移和归属如下:δ为1.98可归属为壳寡糖中未脱尽的乙酰基上的—CH3的化学位移,表明壳寡糖分子中还有少量未脱尽的乙酰基;δ为2.98可归属为氨基葡萄糖残基上H2的化学位移;在δ为3.24~3.94处的多个重叠的化学位移可归属为氨基葡萄糖、乙酰氨基葡萄糖残基和H3~H6的多个化学位移的重叠。δ为3.52可归属为乙酰氨基葡萄糖残基上的H2的化学位移;δ为4.5和δ为4.92可归属为氨基葡萄糖残基和乙酰氨基葡萄糖残基上H1的化学位移;δ为4.7为溶剂峰。COS-O-KA的1H核磁图谱与壳寡糖的相比,在δ为4.19、6.59、8.07处出现了3个新的化学位移,可分别归属为曲酸5-羟基吡喃酮基骨架上—CH2(H-7′)、H-3′和H-6′各质子的化学位移,而δ为2.98处的氨基葡萄糖残基上H2的化学位移仍然存在,此结果与红外光谱的结果一致,这些新的化学位移证明曲酸中5-羟基吡喃酮与壳寡糖的羟基发生了氧烷基化。通过化学位移的归属,可以证明,氯代曲酸与壳寡糖希夫碱发生了氧烷基化反应,COS-O-KA制备成功。

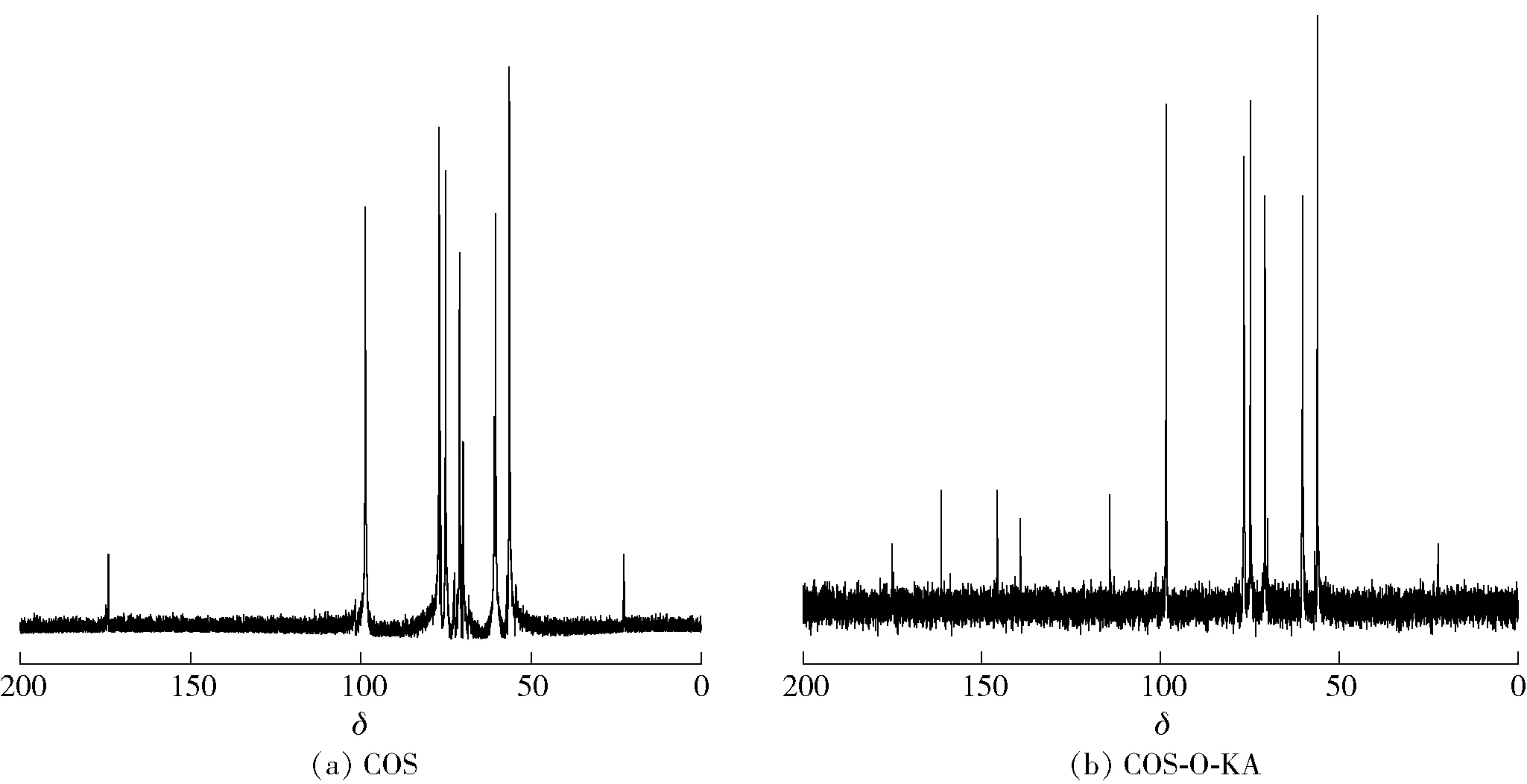
图3 COS和COS-O-KA的13C核磁图谱Fig.3 13C NMR spectra of COS and COS-O-KA
2.2 合成产物的溶解性及生物活性分析
2.2.1pH值对合成产物溶解性的影响
不同pH值对各个样品溶解性的影响如图4。由图4可知,各个待测样品在酸性条件下透光率基本接近,这说明在酸性条件下各个样品均具有良好的溶解性。随着pH值不断提高,在pH值为7以上时,待测样品溶液的透光度逐渐减小,当pH值超过7后,溶液开始变得浑浊,这说明样品在碱性环境中的溶解性下降。与原料壳寡糖相比,当pH值大于7时,COS-O-KA1-3样品溶液的透光率下降缓慢,这说明合成产物较原料壳寡糖有更好的水溶性,这可能是因为经化学结构修饰后,壳寡糖分子链的聚集态发生了改变,分子链之间的缠结程度与结晶度降低,从而削弱了分子链之间的相互作用,进而提高了合成产物的水溶性。
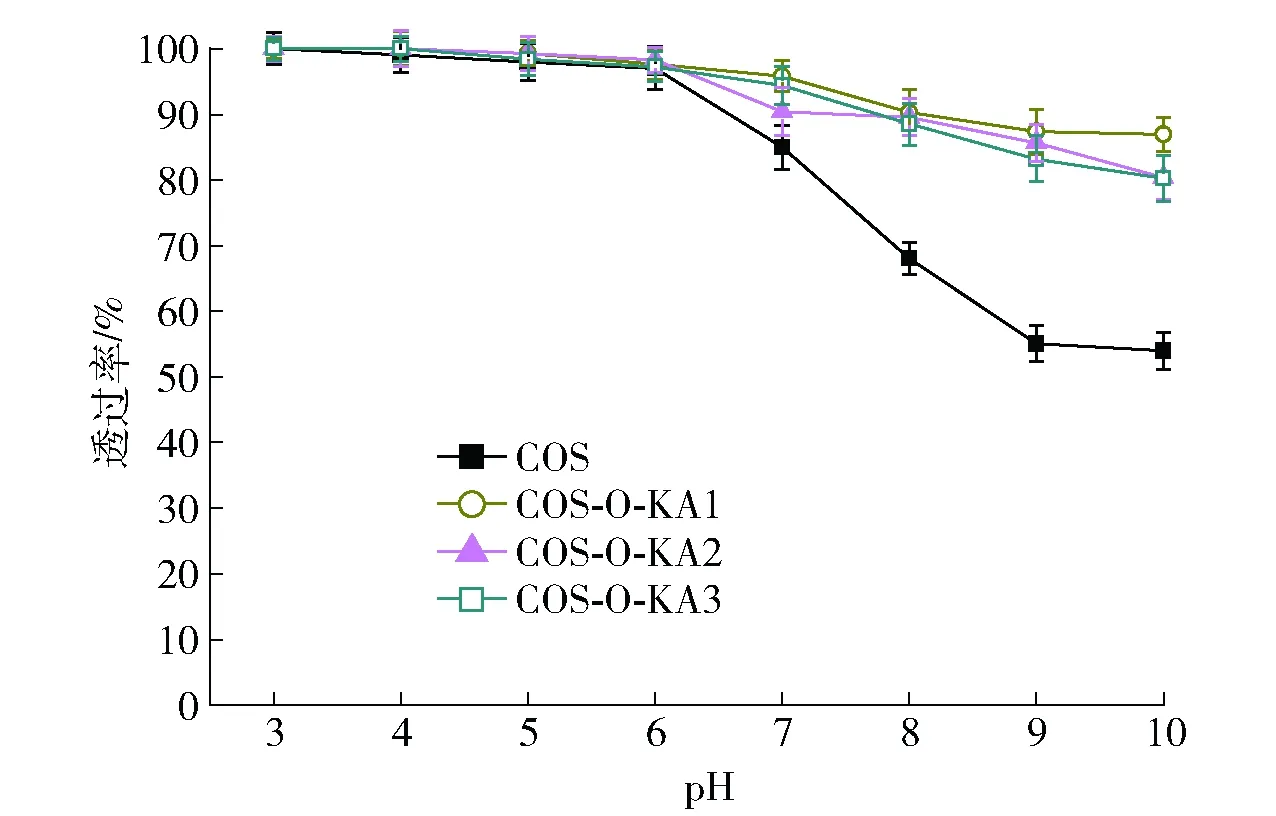
图4 壳寡糖和COS-O-KA的溶解性分析结果Fig.4 Solubility of COS and COS-O-KA
2.2.2体外溶血活性分析
图5为原料壳寡糖、曲酸及合成产物COS-O-KA1-3的体外溶血活性实验结果。由图5可以看出,各个组随着样品质量浓度的升高,其溶血率均逐渐上升。但整体而言,相同浓度下,合成产物COS-O-KA1-3的溶血率均低于壳寡糖和曲酸。例如,在质量浓度为15 mg/mL时,COS-O-KA1-3的溶血率小于20%,而相同质量浓度的壳寡糖和曲酸的溶血活性则大于30%;在质量浓度为25 mg/mL时,COS-O-KA1-3的溶血率小于35%,相同质量浓度的壳寡糖和曲酸的溶血率则大于50%。同时,随着取代度的增加,合成产物的溶血率也逐渐增加。因此,与壳寡糖相比,在其分子链中引入曲酸后,获得的合成产物表现出较好的非溶血活性,该结果表明,COS-O-KA对人红细胞具有较高的选择性[30]。
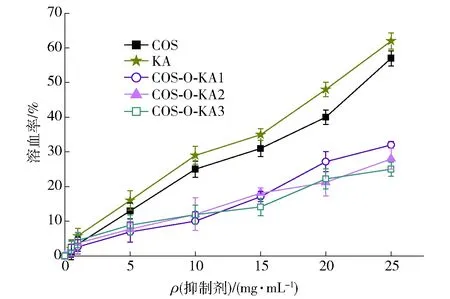
图5 不同质量浓度的壳寡糖、曲酸和COS-O-KA的体外溶血活性分析结果Fig.5 Results of hemolytic activity analysis in vitro of COS, KA, and COS-O-KA at different concentrations
2.2.3体外生物相容性分析
图6为壳寡糖、曲酸和COS-O-KA的体外生物相容性实验结果。从图6(a)、图6(b)可以看出,HASMC细胞经不同浓度梯度的壳寡糖、曲酸和COS-O-KA1-3作用之后,其细胞存活率基本没有下降;而对于经一定质量浓度的壳寡糖、曲酸和COS-O-KA1-3分别作用1、2、4、6 d后,MTT的吸光度随时间增加,这说明在15 mg/mL质量浓度的合成产物作用下,细胞仍可继续增殖,COS-O-KA1-3具有良好的体外生物相容性。
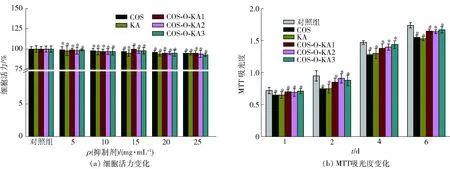
*表示差异显著(P<0.05)。图6 壳寡糖、曲酸和COS-O-KA的体外生物相容性分析结果Fig.6 Results of biocompatibility analysis in vitro of COS, KA, and COS-O-KA
2.3 合成产物的抗氧化活性分析
2.3.1DPPH自由基清除能力分析
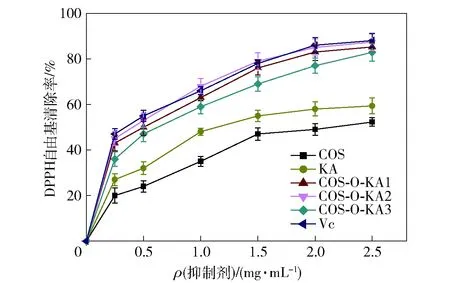
图7 壳寡糖、曲酸和COS-O-KA的DPPH自由基清除能力分析结果Fig.7 Results of DPPH free radical scavenging ability analy-sis of COS, KA, and COS-O-KA
所有检测样品对DPPH自由基的清除能力分析结果如图7。由图7可知,在实验浓度范围内,所有样品对DPPH自由基均具有清除能力。当样品的质量浓度低于2.5 mg/mL时,其清除率随着样品质量浓度的增大而增大;在样品质量浓度为2.5 mg/mL时,壳寡糖、曲酸、COS-O-KA1、COS-O-KA2和COS-O-KA3对DPPH自由基的清除率分别为52.28%、59.33%、85.21%、87.35%和82.83%,经计算,其所对应的IC50值分别为2.17、1.42、0.52、0.33、0.71 mg/mL,其中Vc的IC50值为0.47 mg/mL。根据IC50值可知,COS-O-KA2具有强于VC的DPPH自由基清除能力,其他两种衍生物的清除能力和Vc的接近。COS-O-KA1-3较强的清除DPPH自由基的能力可能与其结构中存在活性胺和5-羟基吡喃酮基团有关,其中聚合物COS-O-KA2具有最强的清除能力。COS-O-KA因含酚羟基、活性羟基和活性氨基,所以其体现出较强的清除DPPH自由基的能力[31]。
2.3.2ABTS+自由基清除能力分析
壳寡糖、曲酸和COS-O-KA1-3对ABTS+自由基的清除能力分析结果如图8。由图8可知,在实验浓度范围内,各个样品对ABTS+自由基都具有一定的清除能力,且其清除率与样品的浓度之间存在量效关系。各样品对ABTS+自由基清除能力具有相似的趋势,即随着浓度的增加而缓慢增加。值得注意的是,合成产物COS-O-KA1-3对ABTS+自由基的清除率缓慢升高,在2.0 mg/mL时达到稳定水平(83.87%、85.76%、82.33%),远高于壳寡糖(39.65%)和曲酸(46.54%)。经计算,IC50值按照壳寡糖、曲酸、COS-O-KA1、COS-O-KA2、COS-O-KA3和Vc所对应的顺序,分别为2.47、1.37、0.51、0.45、0.66、0.47 mg/mL,因此,根据 IC50值可知,与DDPH自由基清除能力相比,同样COS-O-KA2具最低的IC50值,说明其具有较强的ABTS+自由基清除能力。这可能与COS-O-KA聚合物中的酚羟基、活性羟基和活性氨基的作用有关。
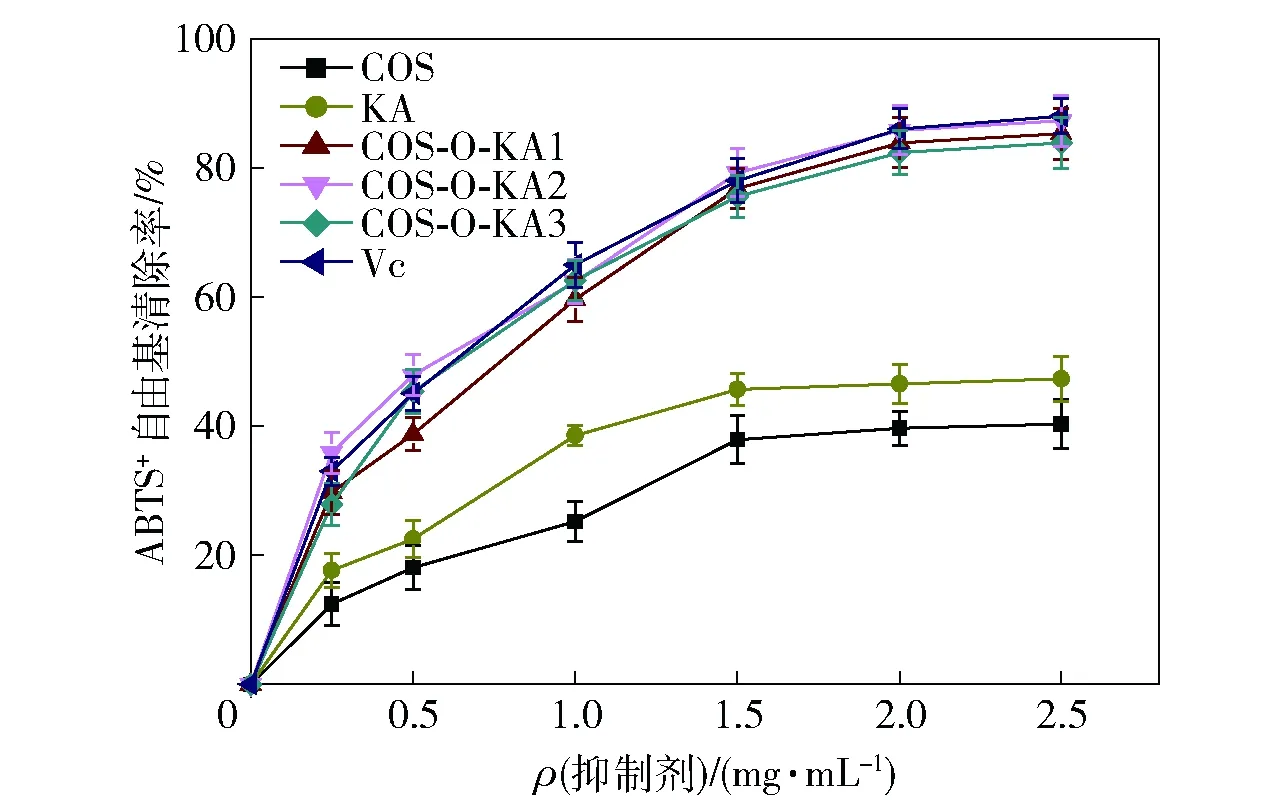
图8 壳寡糖、曲酸和COS-O-KA的ABTS+自由基清除能力分析结果Fig.8 Results of ABTS+ free radical scavenging ability analysis of COS, KA, and COS-O-KA
2.4 动物毒理性分析
对小鼠尾静脉注射COS-O-KA1-3进行动物研究,其中一组为对照组,三组为给药组(COS-O-KA1-3质量分数为6、18、25 mg/kg)。每组小鼠体重变化情况见表2。由表2可见,给药7 d后,即使是注射最高剂量25 mg/kg的合成产物,小鼠也没有出现任何临床症状。与对照组一样,每组小鼠的体重都是逐渐增加的,肉眼观察没有发现任何疾病和死亡情况。因此,动物毒理性实验可以初步证明COS-O-KA1-3的安全性。
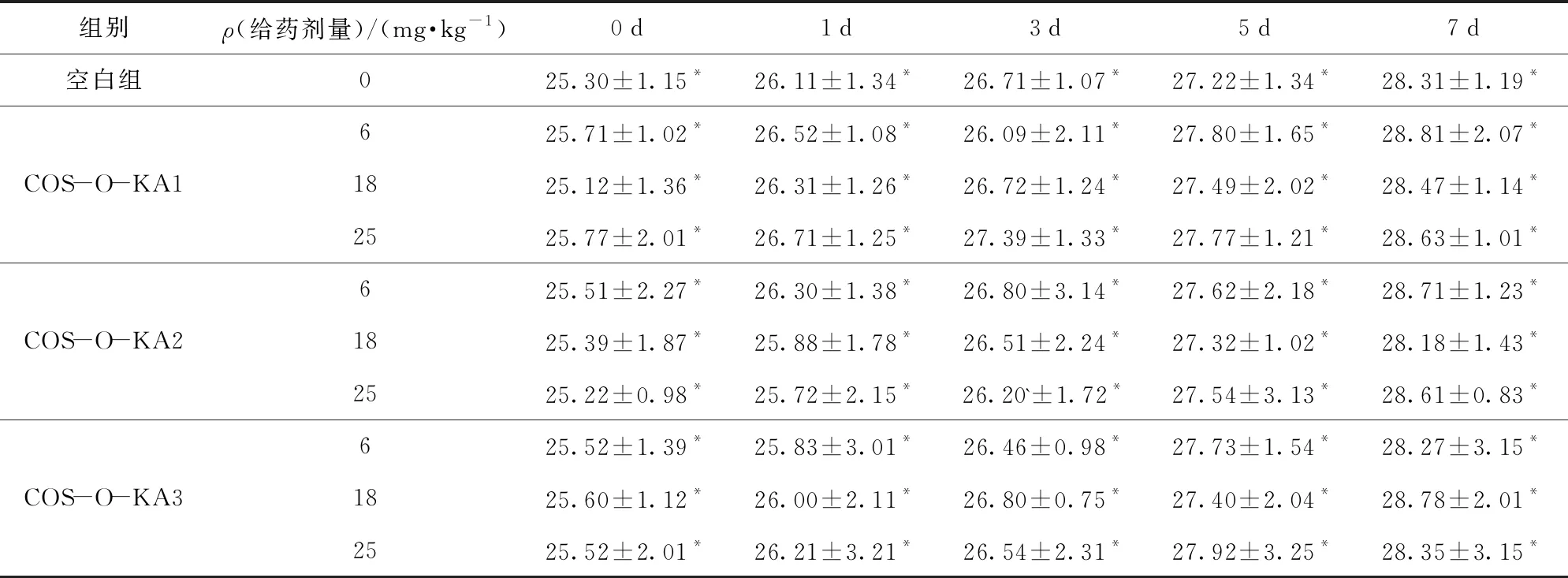
表2 每组小鼠体重变化
3 结 论
以具有良好生物活性的壳寡糖和曲酸为合成起始物,将曲酸基团引入到壳寡糖的分子链中,通过接枝反应,制备获得一种新的壳寡糖-O-曲酸聚合物(COS-O-KA)。在对COS-O-KA结构进行表征的基础上,对其分子质量、多分散性指数、水溶性、体外溶血活性、体外生物相容性、DPPH自由基清除能力、ABTS+自由基清除能力和动物毒理性等方面进行了研究。研究结果表明,将曲酸基团引入到壳寡糖分子链中后,制备得到了壳寡糖-O-曲酸聚合物。1H核磁和13C核磁图谱检测结果表明,成功合成出了3个不同取代度的壳寡糖接枝曲酸聚合物(COS-O-KA1、COS-O-KA2、COS-O-KA3)。COS-O-KA表现出比原料壳寡糖和曲酸更好的水溶性、体外溶血活性、体外生物相容性、DPPH自由基清除能力和ABTS+自由基清除能力,同时动物毒理性也初步表明其安全无毒。COS-O-KA有望被作为一种有前途的抗氧化材料。
