荧光素酶表达的脑胶质瘤小鼠模型的建立
2020-10-27李雨莹罗凯伦邹宗幸刘滨磊
李雨莹,罗凯伦,邹宗幸,刘滨磊,汪 洋
(湖北工业大学生物工程与食品学院,湖北 武汉 430068)
脑胶质瘤是对神经功能影响最大、最直接的神经外科疾病。脑胶质瘤具有较高的侵袭性,即便采取手术及放化疗等治疗措施,预后依然较差,大部分脑胶质瘤患者在接受综合治疗后仍容易复发[1]。建立一个稳定的胶质瘤动物模型可以更好地帮助研究针对脑胶质瘤的治疗方法。常见的脑胶质瘤模型通常需要处死荷瘤小鼠,这样一来就不能实时且准确地反映肿瘤在裸鼠体内的生长状况[2-3]。活体动物体内光学成像技术主要包含生物发光或激发荧光两种技术,前者如荧光素酶,后者如绿色荧光蛋白等[4]。荧光成像既可以标记动物、细胞和微生物,也可以是抗体或纳米材料等较广泛的对象。生物发光不需要激发光源背景,且具有较高的特异性和灵敏性,是研究肿瘤生长及发展稳定且有效的技术手段[5-7]。人脑胶质瘤的研究中,U87MG是最常用的细胞系之一[8],将带有荧光素酶(luciferase)的质粒PBDP-Firely Luciferase利用Lipofactamine 3000转染进入U87MG细胞,得到稳定表达荧光素酶的细胞系。将表达荧光素酶的U87MG细胞原位注射进入裸鼠的颅内,建立表达荧光素酶的裸鼠模型,并通过动物活体成像技术观察脑胶质瘤在裸鼠体内的生长和发展[9],并对该细胞株的成瘤性进行评估。
1 实验材料
PBDP-Firely Luciferase质粒由本实验室前期的实验研究中构建完成;pSPBT辅助质粒由System Biosciences公司获得;U87MG细胞从中国科学院细胞库购得;U87MG及改造后的细胞株U87MG-FLUC均用DME/F-12 (HyClone, USA)培养;胎牛血清购自四季青品牌(浙江天杭生物科技股份有限公司);转染试剂盒Lipofactamine 3000购自ThermoFisher Scientific公司;转染介质培养基用MEM(HyClone, USA),荧光素酶底物购自碧云天生物技术公司;无内毒素大提试剂盒购自天根生物科技有限公司;嘌呤霉素购自Promega。
2 实验方法
2.1 筛选U87MG的最佳嘌呤霉素浓度
将培养于10%胎牛血清的DMEM培养基中的U87MG细胞消化得细胞悬液,按照5×104个/孔的细胞量接种于24孔板中,放置于5% CO2、37℃培养箱中培养24 h。嘌呤霉素按照0、5、10、15、20、25、30 μg/mL设置浓度梯度,连续观察U87MG细胞的生长及存活状态。细胞在5~7 d内全部死亡的孔所对应的嘌呤霉素浓度,将最低致死浓度选为筛选单克隆U87MG细胞的最佳浓度。
2.2 转染U87MG细胞
将处于对数生长期的U87MG细胞,以5×104个/孔的细胞量接种于24孔板中培养24 h,当细胞汇合度达到90%左右时转染质粒。按照Lipofactamine 3000说明书进行转染实验,将PBDP-Firely Luciferase质粒和pSPBT质粒按照5∶1的质量比加入到无血清的MEM培养基中记为A管,向A管中加入P3000试剂。将Lipofactamine 3000与MEM混合记为B管,A管与B管轻微混匀室温静置10 min后,加入到培养的U87MG细胞中,并继续培养48~72 h,观察GFP荧光蛋白表达的情况,并用嘌呤霉素进行筛选。
2.3 筛选单克隆细胞
用嘌呤霉素筛选后的细胞,GFP表达达到70%以上时消化细胞获得细胞悬液,再将细胞悬液梯度稀释至500个/mL接种于96孔板中,使每孔1~2 个细胞。培养24 h以上观察细胞,记录仅有单个细胞的孔。
2.4 流式细胞术检测单克隆细胞株的纯度
荧光显微镜下选取表达GFP荧光蛋白的单克隆细胞,扩培至6孔板中,待细胞汇合度达到90%时,消化细胞并用PBS清洗重悬细胞,用BD C6 流式细胞仪检测U87MG-FLUC中GFP的表达率,并用FlowJo VX分析流式结果。
2.5 各单克隆细胞株荧光值检测
消化筛选出来的单克隆阳性细胞株,用PBS重悬细胞并按照梯度稀释为4×105、2×105、1×105、5×104、2.5×104、1.25×104、6250、3125个细胞接种到96孔板中,设置仅有PBS的孔作为空白对照,加入等体积工作浓度的D-Luciferin,使用多功能酶标仪分析生物发光强度。
2.6 细胞生长曲线绘制
取筛选的U87MG-FLUC细胞和为改造的U87MG细胞,按照1×104/孔接种至96孔板中,接种后的24, 48, 72及96 h 消化细胞并计数。
2.7 BALB/c裸鼠颅内植瘤模型的建立
BALB/c裸鼠,6周龄雌性2只。收集U87MG-FLUC单克隆细胞,用PBS清洗重悬为2×107/mL。2只裸鼠颅内接种50 μL的U87MG-FLUC细胞悬液。注射细胞悬液后的7 d,用动物活体成像系统(PerkinElmer, MA, USA)拍摄生物发光。
3 实验结果
3.1 质粒转染U87MG细胞并用嘌呤霉素筛选
选用PB转座子载体质粒PBDP-Firely Luciferase和辅助质粒pSPBT。其中PBDP-Firely Luciferase质粒上带有绿色荧光蛋白GFP标签,作为质粒转染细胞的检测标记物。
经过嘌呤霉素筛选之后,确定了添加嘌呤霉素的最佳添加浓度为15 μg/mL。将PiggyBac(PB)转座子载体质粒系统PBDP-Firely Luciferase质粒和辅助质粒pSPBT转染进入U87MG细胞中,24 h后可见明显的绿色荧光,表明转染成功。向转染后的细胞中加入15 μg/mL的嘌呤霉素,每24 h观察U87MG细胞,5 d后质粒未转染成功的细胞死亡,存活的均为U87MG-FLUC细胞。
3.2 挑取U87MG-FLUC单克隆细胞株
将转染成功的U87MG-FLUC细胞,稀释加入96孔板中培养。24 h后挑出仅有单个细胞的孔继续培养扩增,当细胞汇合度达到80%以上后选取细胞形态未发生变化的U87MG-FLUC单克隆细胞株两株,观察其表达绿色荧光蛋白的情况(图1)。
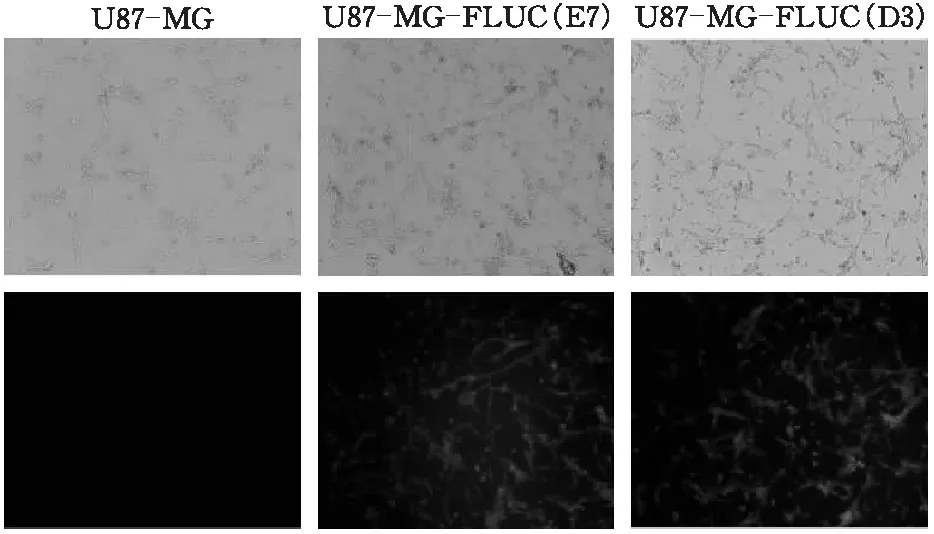
图1 U87MG-FLUC单克隆细胞
3.3 流式细胞仪检测U87MG-FLUC单克隆细胞
通过流式细胞仪检测U87MG-FLUC细胞株的绿色荧光蛋白GFP的表达,对照组为未转染质粒的U87MG培养细胞(图2),E7细胞株的GFP表达率达到98.7%,D3细胞株的GFP表达率达到100%,选取D3株做进一步的研究。
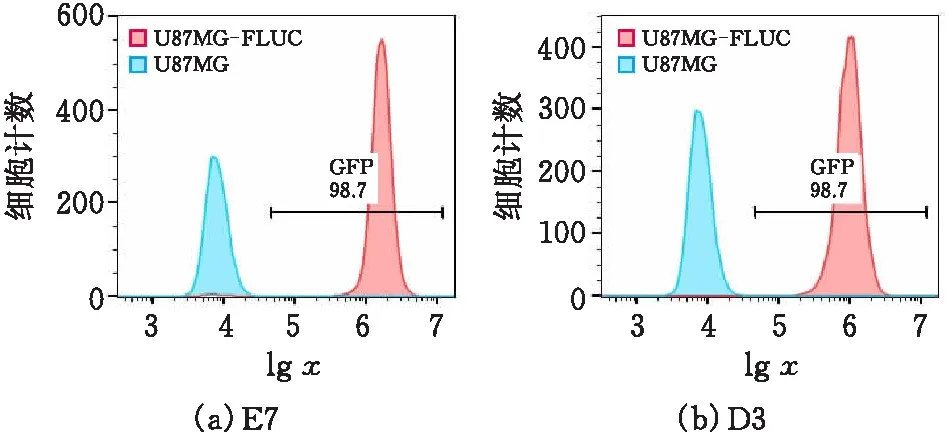
图2 流式细胞仪检测单克隆细胞
3.4 U87MG-FLUC细胞系的生长特性及荧光素酶的表达
对不同培养时间的U87MG-FLUC单克隆细胞进行细胞计数。观察到U87MG-FLUC单克隆细胞与未改造的U87MG细胞有相似生长曲线(图3)。选取第6,9, 12代次的U87MG-FLUC细胞加入荧光素酶底物检测,随着细胞培养代次的增加,荧光素酶活性保持稳定(图4)。进一步,取第12代进行梯度稀释,荧光素酶活性与细胞个数成线性相关(R2=0.9706)(图5)。
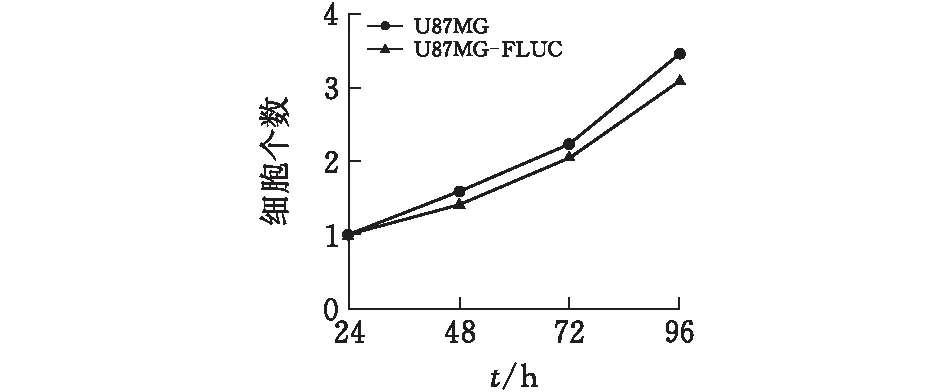
图3 U87MG和U87MG-FLUC生长曲线
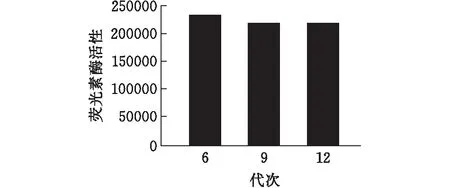
图4 不同代次细胞的荧光强度

图5 细胞个数与荧光强度相关
3.5 裸鼠颅内植瘤模型的建立
收集U87MG-FLUC细胞,对裸鼠颅内接种。7 d后使用小鼠活体成像系统检测到裸鼠颅内有明显的荧光信号。
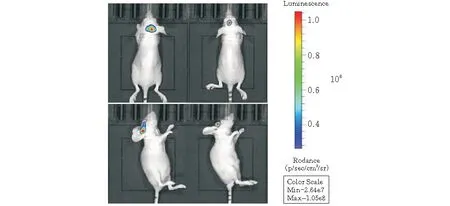
图6 动物活体成像拍摄
4 结束语
通过转染质粒,构建了稳定表达荧光素酶的人脑胶质瘤细胞系。细胞内表达荧光素酶可以催化体外导入的荧光素酶底物D-荧光素,所产生的550~580 nm的荧光,具有较强的组织穿透能力,可有效穿透深层组织[5]。对于无法使用游标卡尺直接对病灶进行测量的脑胶质瘤的模型而言,产生荧光素酶的肿瘤细胞系更能清晰反映肿瘤的发生和发展过程,为观察肿瘤病灶的形成提供直观且可以量化的数据[7,10]。
本实验将PBDP-Firely Luciferase和pSPBT转入到U87MG中,通过嘌呤霉素筛选出稳定表达荧光素酶的细胞株,并通过流式细胞仪选取高纯度的U87MG-FLUC细胞。得到的细胞株能稳定表达荧光素酶,且其表达量及强度不会随着细胞传代而衰减。进一步建立的裸鼠颅内植瘤模型,则通过对实验裸鼠正位和侧位的拍摄确定了瘤体在颅内目标位置形成,有较强的生物荧光信号。本实验可以延长裸鼠颅内成瘤的观察时间及裸鼠荷瘤的生存期。
目前研究中活体动物体内光学成像技术多应用近红外iRFP和GFP蛋白来成像,但是对于脑胶质瘤这种成瘤位置较深、能植入细胞悬液体积较少的瘤体模型来说,荧光素酶成像更加灵敏,是更为合适的选择。
