表达近红外荧光蛋白的结肠癌细胞系的建立
2020-10-27段海潇杨俊寒王润杨张紫怡邹宗幸刘滨磊
段海潇,杨俊寒,王 琳,王润杨, 张紫怡,邹宗幸, 胡 翰,汪 洋, 刘滨磊
(湖北工业大学生物工程与食品学院,湖北 武汉 430068)
结直肠癌是人类长期以来难以攻克的恶性肿瘤,对人类的生命安全构成极大的威胁[1]。结肠癌研究需建立实时观测的动物模型,而荧光蛋白作为标记分子的技术为生物医学基础研究提供了重要手段。与传统的标记分子相比,近红外光域的荧光蛋白(如iRFP713、iRFP670、iRFP682、iRFP702、iRFP720)特异性更强,示踪背景更弱,且无需底物或辅助因子参与。其中iRFP720荧光蛋白使用成本低,激发光谱连续且范围广,荧光较强,稳定性良好,用于荧光成像时在活体动物中穿透能力强,具有检测灵敏度高和操作简便等优点[2],可以快速检测到稳定表达iRFP720的靶细胞。
本研究旨在构建稳定表达iRFP720的CT26细胞,建立BALB/c[3]小鼠的CT26-iRFP720皮下肿瘤模型,并在动物活体成像设备中进行观测[4]。
1 实验材料
iRFP720基因由金斯瑞生物合成,插入到质粒PiggyBac Dual Promoter(pPBDP),构建pPBDP-iRFP720作为供体质粒,Super PiggyBac Transposase(pSPBT)作为辅助质粒,上述材料由System Biosciences公司获得。CT26细胞购于北京协和医院细胞资源中心,CT26细胞和构建成功的CT26-iRFP720细胞所用的培养基是DME/F-12(HyClone, USA),MEM(HyClone, USA)用于稀释质粒,胎牛血清购自浙江天杭生物科技股份有限公司。Lipofectamine 3000试剂盒(含Lipofectamine 3000和P3000)从Thermo Fisher Scientific公司购买;Western Blot IP细胞裂解液、PMSF、BCA蛋白定量试剂盒和SDS-PAGE凝胶配制试剂盒购自碧云天生物;硝酸纤维素滤膜购于Millipore;脱脂乳购于BD;PD-L1鼠单克隆抗体和辣根过氧化物酶标记的羊抗鼠抗体购自武汉三鹰生物公司;ECL化学发光显色液购自Bio-sharp。
2 实验方法
2.1 嘌呤霉素筛选CT26细胞并确定致死浓度
CT26细胞消化后计数,将细胞密度调整至2×105/mL,每孔500 μL接种于24孔板,于37℃,5%的CO2培养箱中培养24 h,次日将不同浓度的嘌呤霉素加入到CT26细胞中,连续6 d对细胞状态进行观察记录,其间含嘌呤霉素的培养基每2 d更换一次,用移液枪小心吸除死亡的细胞,再加入含嘌呤霉素的细胞培养基,第4天通过观察细胞全部死亡对应的嘌呤霉素浓度确定最低致死浓度[5]。
2.2 细胞转染试验
首先准备需要转染的细胞CT26,以密度为2×105/mL加入24孔板, 每孔500 μL,放入37℃,5%的CO2培养箱中培养24 h。将质粒pPBDP-iRFP720和质粒pSPBT以质量比为5∶1混合后,用含 MEM培养基稀释 P3000的 A管再去稀释质粒,将 Lipofectamine3000用 MEM培养基稀释后放入到B管,A管和B管的终体积为25 μL。两管均匀混合后,室温静置10 min,再将复合物加入到细胞中[6],于37℃,5%的CO2条件下培养72 h后观察GFP的表达情况。如果GFP的表达率大于30%,即可继续进行下游实验,用嘌呤霉素筛选。
2.3 CT26-iRFP细胞单克隆挑取
嘌呤霉素筛选完成后,将剩余的细胞消化并计数,以10倍梯度稀释并调整细胞密度为5×102/ mL,接种于96孔板,每孔100 μL[7],培养24 h待细胞贴壁后观察细胞,记录下仅有单个细胞的孔。
2.4 流式细胞仪检测CT26-iRFP细胞纯度
将CT26细胞作为对照细胞,筛选出的细胞培养至6孔板中,消化后用100 μL的PBS重悬后上样,用流式细胞仪检测CT26-iRFP720中GFP的表达率[8]。
2.5 Western Blot检测CT26-iRFP720细胞上PD-L1表达
将CT26细胞和CT26-iRFP720细胞接种于T25细胞培养瓶中,用含10% FBS的DMEM培养24 h,加入IP裂解液[9]置冰上裂解细胞15 min,于12000 r/min 4℃离心20 min,吸取上清,按照BCA说明书定量分析蛋白浓度。配8%的SDS-PAGE分离胶与浓缩胶,静置30 min,待胶凝固后即可使用。将40 μL的5×蛋白上样缓冲液加入到160 μL蛋白上清中,加热100 ℃,10 min,再置于冰盒内,冷却后在上样槽内加入待检蛋白,先用80 V电泳至Marker有明显分层,接着调整电压至120 V电泳[10],待溴酚蓝移行至分离胶底部时,停止电泳,将PAGE胶进行切割后放置于NC膜上,用滤纸夹住后进行转膜,其间将配好的TBST[11]作为含5%脱脂奶粉的封闭液溶剂,转膜结束后于25 ℃封闭1 h,用TBST洗膜3次,用含5% BSA的TBST以1∶1000稀释一抗对膜孵育,4 ℃,过夜,24 h后用含5%脱脂奶粉的TBST以1∶10000比例配制二抗后与膜孵育1 h,其间摇床震荡,TBST洗膜3次,最后加入ECL显色液,在化学发光成像系统中拍摄显色结果。
2.6 活体成像系统检测iRFP720表达
将1×106个CT26-iRFP720细胞注射入BALB/c小鼠皮下[12],每只小鼠注射100 μL细胞,建立肿瘤模型,在第24天用动物活体成像系统拍摄。
3 实验结果
3.1 CT26-iRFP720细胞系构建
如图1所示,iRFP720 cDNA序列全长951 bp,将该目的基因插入到PiggyBac(PB)载体质粒的,通过 CMV启动子启动转录,Puro和GFP基因通过短肽T2A序列链接,连接后的序列由EF1α启动子启动,获得pPBDP-iRFP720质粒。
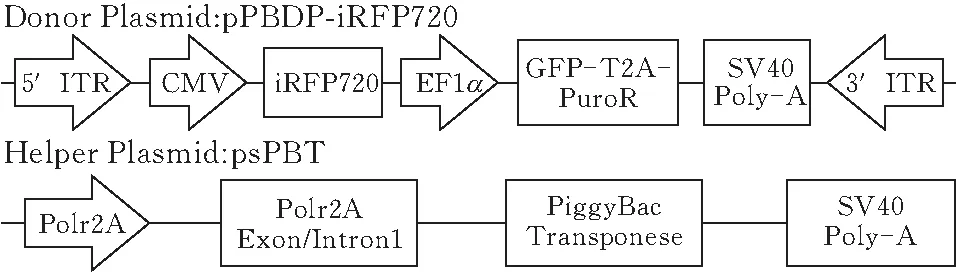
图1 转座子系统质粒
3.2 质粒转染CT26细胞
转座子载体质粒pPBDP-iRFP720和辅助质粒pSPBT转染CT26细胞,可见发绿色荧光的CT26-iRFP720,说明转染成功。将30 μg/mL的嘌呤霉素加入转染后的CT26细胞,4 d,未转染的CT26细胞死亡(图2),存活的发绿色荧光的细胞为CT26-iRFP细胞。
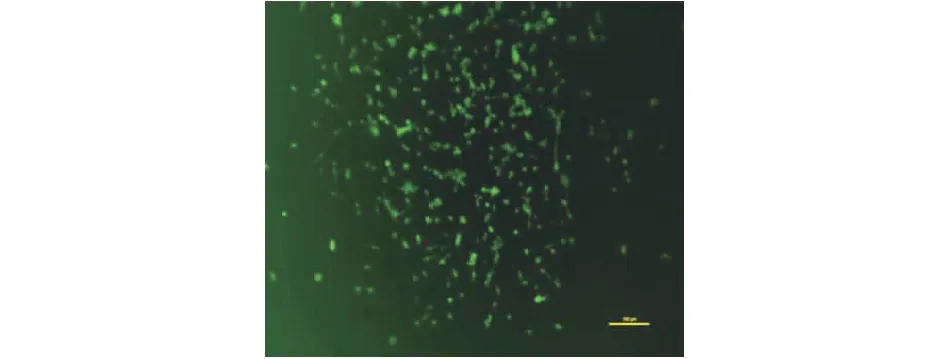
图2 PBDP-iRFP720转染CT26
3.3 CT26-iRFP720单克隆细胞挑取
收集CT26-iRFP720细胞,稀释至5×102/mL并接种于96孔板,每孔100 μL,培养48 h可见单克隆细胞。图3a为在培养48 h后用倒置显微镜分别在白光下和绿光下拍摄的CT26-iRFP720单克隆细胞。

图3 不同光线下拍摄的 CT26-iRFP720单克隆挑取图
3.4 流式细胞仪检测CT26-iRFP720单克隆细胞
CT26细胞作为对照组和 CT26-iRFP720细胞作为实验组,经流式细胞仪检测两组细胞 GFP的表达(图4),显示 CT26-iRFP720中 GFP表达率达到98.1%。
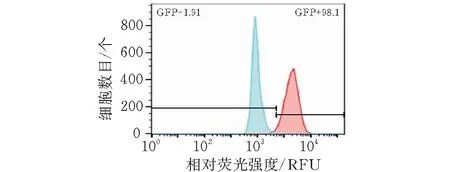
图4 流式细胞仪检测CT26-iRFP720单克隆细胞纯度
3.5 Western Blot检测CT26-iRFP720细胞 PD-L1的表达
收集CT26和CT26-iRFP720细胞,分别提取蛋白后进行Western Blot检测。图5显示CT26和CT26-iRFP720两组细胞中的目的蛋白PD-L1均有较高表达,改造后的稳转细胞系CT26-iRFP720的PD-L1表达量与CT26无明显差异。
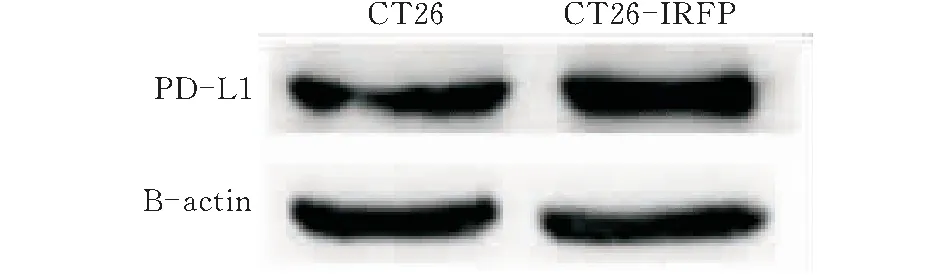
图5 Western Blot检测CT26-iRFP720细胞PD-L1表达
3.6 BALB/c模型建立
为了证明 CT26-iRFP细胞系能够在小鼠体内表达 iRFP720,在小鼠右侧背部植入 CT26-iRFP720细胞(图6)。在第24天时,用活体成像系统观察到植瘤部位有明显的肿瘤生长,且 iRFP720表达显著。

图6 动物活体成像拍摄CT26-iRFP720图
4 结论
本研究应用脂质体转染法将质粒pPBDP-iRFP720-GFP和pSPBT转入CT26细胞中,用嘌呤霉素作为筛选试剂,通过显微镜观察荧光及流式细胞仪检测,获得GFP高纯度表达的CT26-iRFP720单克隆细胞株,经Wstern Blot检测,CT26和CT26-iRFP720中PD-L1的表达表达无明显差异。
在动物实验中,将构建成功的CT26-iRFP720细胞于BALB/c小鼠背部右侧皮下植瘤,活体成像检测到较强的iRFP720信号,说明已构建成功的CT26-iRFP720细胞株在动物体内成功表达,因此,CT26-iRFP720细胞株既可以用于体外试验,也可以开展动物体内研究。
