盐处理对两种甘草幼苗生长及其多糖含量的影响
2020-10-26马海丽马红张桂英鲜雯杨国武杨虎冯玉兰郭晓农柴薇薇
马海丽 马红 张桂英 鲜雯 杨国武 杨虎 冯玉兰 郭晓农 柴薇薇

摘要:本研究分析了不同盐浓度处理对乌拉尔甘草(Glycyrrihiza uralensis)和黄甘草(Glycyrrhizae eurycarpa)幼苗生长状况及甘草多糖含量积累的影响。研究发现50 mmol·L-1 NaCl处理下,两种甘草的生长状态均优于处理组,乌拉尔甘草和黄甘草在35d时的株高分别比对照组提高了38%和27%,根长分别增加了68%和48%。而高浓度盐处理(200和400 mmol·L-1 NaCl)抑制了甘草的生长。此外,50 mmol·L-1 NaCl处理显著提高了两种甘草中的甘草多糖含量,处理 35 d后,乌拉尔叶片中多糖含量比对照组增加了7%,根中增加了11%,而黄干草叶和根中多糖含量比对照组分别增加了5%和7%。盐处理下乌拉尔甘草幼苗的株高、鲜重及多糖含量均显著高于黄甘草幼苗。结果表明,适量浓度的盐处理可以促进甘草的生长及甘草多糖的积累,乌拉尔甘草相较于黄甘草在盐处理下生长更好,且能积累更多的甘草多糖。
关键词:盐处理, 乌拉尔甘草, 黄甘草, 多糖
中图分类号:S567.7+1
甘草(Glycyrrhiza) 别名甜草、美草等,属豆科多年生草本植物,其具有抗溃疡、抗炎、抗菌、解毒等多种药理作用,被广泛应用于食品、烟草、化妆品等领域[1-2]。甘草主要分布于我国西北部的内蒙、新疆、甘肃等地区,喜光照、耐热、耐干旱、耐寒及耐盐碱,是干旱半干旱地区重要的植物资源之一[3],也是我国常见的传统药用植物之一[4]。
目前发现甘草的主要有效成分包括甘草酸、黄酮类、多糖类等[5]。据有关报道,甘草多糖是一种新发现的生物活性多糖,是从甘草中提取出的一类α-D-吡喃多糖[6],其作为甘草重要的活性成分之一,已被发现具有抗炎、抗肿瘤、抗病毒、抗氧化和抑菌、免疫调节等生理活性[7-9]。甘草主要分布于我国三北干旱盐碱化地区,具有较强的耐盐性,了解甘草对盐的适应机制,并探索其有效成分在盐碱环境下的积累特征,是对甘草开发利用的基础。已有研究表明适度的盐处理有利于甘草酸及黄酮的积累[10,11],但有关甘草多糖在盐处理条件下的积累特征还未见报道。因此本研究将以乌拉尔甘草和黄甘草为材料,对盐处理下两种甘草幼苗生长以及多糖积累特性的变化进行初步研究,为甘草在盐碱化地区进一步的开发利用提供理论依据。
1 材料与方法
1.1 实验材料
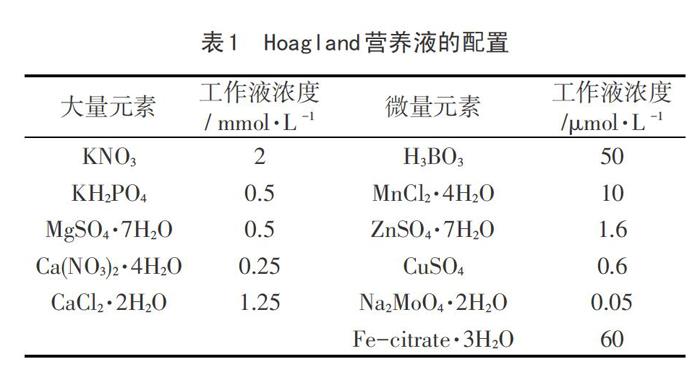
乌拉尔甘草(Glycyrrihiza uralensis)和黄甘草(Glycyrrhizae eurycarpa)种子购自于甘肃武威,用4% KMnO4溶液消毒30分钟,漂洗干净后于25℃恒温培养箱中培养两到三天待发芽后移植于穴盆中。当出苗35d时,选取长势一致的幼苗进行盐处理。Hoagland营养液(表1)为对照(control) ,在Hoagland营养液中分别添加50 、200和400 mmol·L -1 NaCl进行盐处理,每两天更换营养液。在处理7 d、14 d、21 d、28 d和35 d时取样,进行两种甘草幼苗生长指标及多糖含量的测定。
1.2 实验方法
1.2.1 生长指标测量
使用直尺和电子天平测定株高、主根长以及鲜重
1.2.2多糖的含量测定
(1)多糖含量的測定使用浓硫酸-苯酚法[12]。
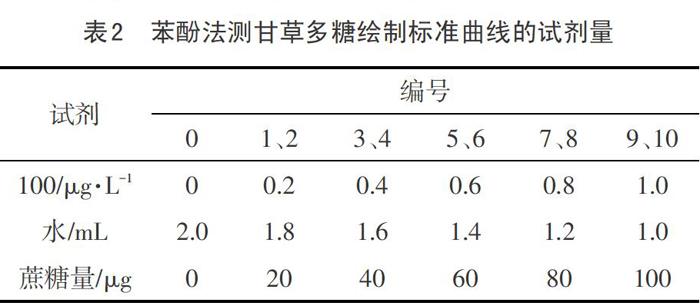
标准曲线的制作:取11支20 ml刻度试管,从0到10分别编号,按表1加入溶液和水。
按顺序向试管内分别加入1 mL 9%苯酚溶液,5 mL的浓硫酸,摇匀。放置30 min后,在485 nm波长处测定吸光度,将所得数据进行一元线性回归,得蔗糖浓度(X) -吸光度(A)方程: X= (A+ 0.0318) /0.0067,相关系数R? = 0.9966,根据上述方程查出甘草多糖的含量[13-15]。
(2)甘草多糖的提取:称取三份0.1 g左右的干样品。放入3支试管中,加入10 mL蒸馏水,塑料薄膜封口,在沸水中提取。提取液过滤在25 mL容量瓶中,定容到刻度。
(3)测定:量取0.5 mL样品液于试管中,加蒸馏水1.5 mL。步骤与制作标准曲线相同,由标准曲线查出多糖含量。
(4)结果计算:按下式计算测试样品的多糖含量。
甘草多糖含量= 从标准曲线查得糖含量
×提取液体积×稀释倍数
×100%
测定用样品液的体积
样品重量×106
1.3 数据分析
原始数据采用Excel 2010软件,SPSS17.0统计软件进行处理,LSD法比较平均值(P<0.05)。
2 结果
2.1 盐处理对甘草生长的影响
2.1.1盐处理对幼苗地上部生长的影响
从表3可以看出,随着盐浓度的增加,两种甘草的株高先增高后降低,在50 mmol·L-1 NaCl处理下,生长均受到促进,株高始终高于对照组,在7d时乌拉尔甘草和黄甘草分别增加了30%和39%,在21d时分别增加了22%和29%,35 d时分别增加了38%和27%。而在200、400 mmol·L-1 NaCl处理下它们的生长均受到抑制,株高显著低于对照组,经盐长期处理在28d后,200 mmol·L-1时乌拉尔甘草和黄甘草分别降低了28%和29%,并且400 mmol·L-1时分别降低了31%和37%,处理35 d后分别降低了29%和39%。此外,随着盐浓度的增加,两种甘草的叶鲜重也出现了先增长后下降的趋势(表4),50 mmol·L-1 NaCl处理35 d,乌拉尔甘草和黄甘草的叶鲜重分别比对照增加了12%和19%。在相同处理条件下,乌拉尔甘草的叶鲜重显著高于黄甘草。由此可知,适量浓度的盐(50 mmol·L-1 NaCl)促进了甘草植株叶的生长,而高浓度的盐则抑制了甘草幼苗叶的生长,并且乌拉尔甘草比黄甘草更加适合在盐渍环境中生长。
本实验在室温盆栽条件下通过不同浓度的NaCl处理,对两种甘草生长及多糖含量积累的影响进行了初步探讨,研究表明适量盐有助于甘草的生长及多糖的积累,并且乌拉尔甘草生长状态更好,能积累更多的多糖,因此更适合在盐碱地种植,这一结论可以为在盐碱化地区对甘草进一步开发利用提供一定的理论依据。
参考文献
[1]张继, 丁兰等. 甘草的利用研究进展[J]. 草原与草坪, 2000, 89(2): 12–17.
[2]杨国会, 马尧, 李如升等. NaCl对甘草叶片脯氨酸含量以及质膜相对透性的影响[J]. 农业与技术, 2000, 20(5): 43.
[3]梁新华, 刘凤敏等. NaCl和Na2CO3胁迫对甘草幼苗渗透调节物质含量的影响[J]. 农业科学研究, 2006, 27(2): 96.
[4]王巧娥, 任虹, 曹学丽等. 甘草研究开发与利用现状[J]. 中国农学通报, 2011, 27(4): 290–295.
[5]徐建, 康慧芬, 楊惠琳等.甘草中甘草酸的含量测定方法研究[J].山东化工, 2018, 47(21): 81–83.
[6]张泽生, 史珅, 杨超慧等. 甘草多糖免疫调节作用的研究[J]. 现代生物医学进展, 2008, 8(10): 1835–1837.
[7]王忱, 谢广茹, 史玉荣等. 甘草多糖的体内抑瘤作用及其机制的研究[J]. 临床肿瘤学杂志, 2003, 8(2): 8587.
[8]邢国秀, 李楠, 王童等. 甘草中黄酮类化合物的研究进展[J]. 中国中药杂志, 2003, 28(7): 593–597.
[9]贾国惠, 贾世山等. 甘草中黄酮的药理作用研究进展[J]. 中国药学杂志, 1998, 9: 513–516.
[10] 陈真. 盐胁迫对甘草中的甘草酸含量的影响[J]. 生物技术世界, 2014, 12: 30–31.
[11] 马红, 方龙宝等. 盐处理对两种甘草幼苗的抗氧化系统及总黄酮含量的影响[J]. 甘肃纵横科技, 2019, 7(3): 28-32.
[12]高丽娟, 田晓燕. 甘草残渣中多糖的分光光度法测定[J]. 宁夏大学学报: 自然科学版, 2002, 23(2): 182–183.
[13]董亚琴. 红毛五加多糖的提取及含量测定[J]. 华西药学杂志, 1994, 9(2): 73–74.
[14]王强. 枸杞子中多糖的含量测定[J]. 中草药, 1991, 22(2): 67–68.
[15]周静, 李艳, 薛梅等. 酸浆果多糖的提取及含量测定[J]. 数理医药学杂志, 2000, 13(3): 242.
[16] 蔡建一, 马清,周向睿等. Na+在霸王适应渗透胁迫中的生理作用[J]. 草业学报, 2001, 20(1): 89-95.
[17] 孟雨冉. 铁皮石斛多糖积累与蔗糖代谢的影响因素研究[D]. 浙江农林大学, 2018.
[18] 孙芳草. 多糖的分析及其对羊草盐碱耐受性的影响[D]. 东北师范大学, 2010.
[19] 万世杰, 梁玉玲. NaCl胁迫对胀果甘草子叶愈伤组织总黄酮合成的影响[J]. 农业学报. 2013, 2: 151–152.
[20]杨秀红, 李建民, 董学会等. 盐胁迫对甘草幼苗生长及其生理指标的影响[J]. 华北农学报, 2006, 21(4):39–42.
[21]唐晓敏, 王文全, 杨全等. NaCl处理对甘草生长、生理指标及药效成分含量的影响[J]. 吉林农业大学学报, 2008,30(2): 172–175.
[22]李三相, 周向睿, 王锁民等. Na+在植物中的有益作用[J]. 中国沙漠, 2008, 28(3): 485–490.
[23]石灵玉, 马淼. 乌拉尔甘草叶片的泌盐特性及生理适应性[J]. 江苏农业科学, 2018, 46(14): 140–143.
[24]陈小娜, 邱黛玉, 蔺海明. 甘肃河西五种甘草属植物的植物学特性及药用价值研究[J]. 草业学报, 2016, 25(4): 246-253.
[25]王丽华, 李改玲, 李晶等. 外源糖对盐胁迫下小黑麦幼苗糖代谢的影响[J]. 麦类作物学报, 2017, 4: 1009-1041.
[26] 田晓艳. 盐胁迫对NHC牧草对Na+,K+pro可溶性糖和可溶性蛋白的影响[J]. 草业学报, 2008, 25(10): 34-39.
[27] 金赞敏, 王长海等. 盐胁迫对芦荟几项生理生化指标的影响[J]. 食品与发酵工业, 2004, 10: 1-4.
[28]路苗. 盐胁迫对发菜胞外多糖结构及生物活性的影响[D]. 陕西科技大学, 2016.
[29]王贵春. 盐胁迫对发菜胞外多糖化学结构及抗氧化活性的影响[D]. 陕西科技大学, 2015.
