川芎嗪对血管性痴呆(VD)大鼠和缺氧缺糖(OGD)PC12细胞的保护作用及机制
2020-10-26李小楠舒刚明
李小楠 舒刚明
ProtectiveEffectandMechanismofLigustrazineonVascularDementia(VD)RatsandOxygenGlucoseDeficiency(OGD)PC12Cells.LiXiaonan,ShuGangming.SecondMedicalDepartment,FourthMedicalCenter,GeneralHospitalofChinesePLA,Beijing100081,China
AbstractObjectiveTo study the protective effect and mechanism of Ligustrazine on vascular dementia (VD) rats and OGD-PC12 cells.MethodsThirty two male Wistar rats were randomly divided into four groups: solvent group, control group, 20mg/kg Ligustrazine group and 60mg/kg Ligustrazine group. After permanent bilateral common carotid occlusion (BCCAO), rats were given Ligustrazine for 6 weeks. At the end of the experiment, BDNF, MCP-1 and Hcy were detected by ELISA. In vitro, OGD-PC12 cells were treated with Ligustrazine for 0.5, 1, 3, 6, 12 or 24 hours. The expression of BDNF, MCP-1 and Hcy were detected by ELISA; Apoptosis was detected by AO/EB staining. The expression of cl-caspase-3, Bax and bcl-2 were detected by Western blot.ResultsCompared with the sham operation group or solvent group, the expression of MCP-1 and Hcy in other groups was significantly increased in vivo and in vitro, while the BDNF level in Ligustrazine group was lower than that in sham operation group or solvent group. The results of AO/EB staining showed that OGD-PC12 cells had serious cell damage, apoptosis played a major role in OGD, while Ligustrazine (1×10-6and 1×10-5mol/L) group had inhibitory effect on cell damage. Western blot showed that the Bax/Bcl-2 ratio and cl-caspase-3 expression in the control group increased compared with the solvent group, while Ligustrazine could reduce Bax/Bcl-2 ratio and down regulate cl-caspase-3 expression.ConclusionBy regulating Bax/Bcl-2 and down regulating cl-caspase-3 expression, ligustrazine can inhibit VD, which indicates that Ligustrazine may be a promising neuroprotective agent for VD treatment.
KeywordsLigustrazine; Vascular dementia; Bilateral common carotid artery occlusions; Brain-derived neurotrophic factor; Monocyte chemoattractant protein 1; Homocysteine
脑慢性低灌注(chronic cerebral hypoperfusion, CCH)是一种由脑血管梗死或血管狭窄所造成的疾病,由于中枢神经系统葡萄糖和氧气供应不足,导致中枢和周围半影的神经元损伤,并伴有较轻的缺血损伤[1]。血管性痴呆(vasculer dementia, VD)是仅次于阿尔茨海默病(AD)的第二大痴呆类型,其特征会使患者认知能力下降,而CCH是一个关键危险因素[2]。鉴于它们之间的密切关系,人们越来越关注CCH-VD的潜在机制,以提供有效的治疗方法。
川芎嗪是从中草药川芎中提取的重要活性成分之一,在中国历史上广泛应用于脑卒中患者[3]。文献报道,川芎嗪其衍生物通过调节炎症、氧化应激和NO系统对脑卒中后再灌注和脑出血具有保护作用[4]。然而,川芎嗪对其他神经退行性血管相关疾病,如CCH诱导的血管性痴呆(VD)的神经保护作用尚不清楚。研究表明,侧颈总动脉永久性结扎(BCCAO)通常用来制备慢性脑低灌注动物模型,且OGD-PC12细胞模型也在CCH研究中得到了广泛的应用。本研究通过建立BCCAO大鼠模型以及OGD-PC12细胞模型观察川芎嗪的作用效果,通过ELISA、AO/EB染色、Western blot法检测对其可能机制进行研究。
材料与方法
1.材料:BDNF、MCP-1和Hcy酶联免疫吸附剂检测(ELISA)试剂盒购自武汉博斯特生物工程公司;Cl-caspase-3、Bcl-2、Bax、β-actin单克隆抗体购自美国Santa Cruz公司;吖啶橙(AO)/溴化乙锭(EB)双染细胞凋亡检测试剂盒购自贵阳凯信生物工程有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自北京中杉生物技术公司;蛋白抽提试剂盒、二喹啉甲酸(BCA)蛋白定量试剂盒购自康为世纪生物科技有限公司。
2.动物及模型建立: 32只雄性Wistar大鼠(8周龄,体质量200~220g)由湖南斯莱克景达实验动物有限公司提供(实验动物许可证号:SCXK湘:2016-0011),并在实验室环境中适应1周。所有动物都可以自由获得食物和水,实验方案经动物实验伦理学委员会批准ACU-36(20190425)。川芎嗪组大鼠在永久性结扎双侧颈总动脉(BCCAO)存活后第2天接受治疗,给予VD大鼠川芎嗪20或60mg/(kg·d),灌胃6周。对照组和假手术组大鼠给予相同体积的0.9% NaCl注射液。假手术组为进行手术但未结扎的大鼠,对照组为进行BCCAO手术的大鼠。6周后,大鼠用乙醚麻醉,立即取海马组织冷冻在液氮中。
3.细胞培养:PC12细胞置于含6%胎牛血清、6%马血清、100U/L青霉素和100U/L链霉素的高糖Dulbecco改良DMEM的培养基中,在37℃、5%CO2培养箱中培养,第5~8代细胞用于实验。根据文献[5]方法建立OGD-PC12细胞模型,细胞与1mmol/L Na2S2O4孵育10min,然后用磷酸盐缓冲液(PBS)洗涤两次,低葡萄糖DMEM中培养细胞,用于后续研究。实验分为溶剂组、对照组、川芎嗪(1×10-7、1×10-6和1×10-5mol/L)组。溶剂组细胞未进行OGD及川芎嗪处理,而对照组细胞在OGD环境中培养,但是不用川芎嗪处理。川芎嗪组在OGD环境中加不同浓度川芎嗪处理后培养。
4.ELISA法检测BDNF、MCP-1和Hcy含量:大鼠海马组织解冻、称重、匀浆、离心(4000r/min)以获得上清,并立即分装并于-80℃中保存。根据试剂盒说明书检测上清液中脑生物学标志物BDNF、MCP-1和Hcy,在酶标仪490mm处测各孔吸光度。对于体外细胞实验,除溶剂组和对照组外,将PC12细胞置于1×10-7、1×10-6和1×10-5mol/L川芎嗪中进行OGD培养,于37℃、5%CO2中孵育0.5、1、3、6、12或24h。收集培养上清,按照ELISA试剂盒说明书操作检测BDNF、MCP-1、Hcy。
5.吖啶橙-乙醚溴化(AO/EB)染色观察[6]:体外培养的OGD-PC12细胞经1×10-7、1×10-6和1×10-5mol/L川芎嗪(溶于低葡萄糖DMEM)处理后,37℃、5% CO2中孵育0.5、3或6h。吸取培养上清液,用PBS洗涤细胞两次。AO(100μg/ml)和EB(100μg/ml)以1∶1的比例预混合,然后将AO/EB溶液与PBS以1∶25的比例混合。将溶液加入培养板中,避光孵育1min,弃上清液,用PBS洗涤细胞两次。采用荧光显微镜观察川芎嗪对Na2S2O4诱导的OGD-PC12细胞凋亡的影响,用Image J软件对图片进行细胞计数。
6.Western blot法检测川芎嗪对OGD-PC12细胞Bax、Bcl-2和Cl-caspase-3表达影响[7]:细胞分组处理同材料与方法5,按照蛋白提取试剂盒说明书提取细胞蛋白,用BCA试剂盒测定蛋白水平。将蛋白质样品以4∶1的比例与加载缓冲液混合,在95℃下煮沸5min,并以1000r/min离心2min。蛋白质(每孔30μg)在十二烷基硫酸钠-聚丙烯酰胺凝胶上(SDS-PAGE)分离,转移到PDVF膜上,用5%脱脂牛奶封闭2h,Bax、Bcl-2、Cl-caspase-3一抗(每种抗体稀释1∶1000)4℃孵育过夜,TBST 洗膜后加入辣根过氧化物酶标记的二抗37℃孵育2h,ECL显色,用Image J软件对靶蛋白条带水平进行检测。目的基因的相对表达=目的基因灰度值/内参β-actin灰度值,实验重复3次。

结 果
1.各组大鼠海马组织中BDNF、MCP-1和Hcy含量:与假手术组比较,对照组大鼠脑组织BDNF水平降低(P<0.01),而川芎嗪组(60mg/kg)BDNF水平高于对照组(P<0.05);与假手术组比较,对照组大鼠脑MCP-1、Hcy水平上升(P<0.01),而川芎嗪组(60mg/kg)大鼠脑MCP-1、Hcy水平较对照组下降(P<0.05),详见图1。

图1 川芎嗪对VD大鼠BDNF、MCP-1和Hcy表达的影响1.假手术组; 2.对照组; 3.川芎嗪20mg/kg组; 4.川芎嗪60mg/kg组;与假手术组比较,*P<0.01;与对照组比较,#P<0.05
2.川芎嗪对OGD-PC12细胞中BDNF、MCP-1和Hcy表达影响:对照组细胞中BDNF水平低于溶剂组(P<0.01),并在1~12h内迅速下降,12h后又上升,但经川芎嗪(1×10-5mol/L)处理后BDNF水平低于对照组(P<0.01)。对照组细胞MCP-1水平从1~3h显著升高,至实验结束时逐渐降至基础水平。在1、3、6和12h对照组细胞的MCP-1水平高于溶剂组(P<0.01),川芎嗪(1×10-6和1×10-5mol/L)组MCP-1水平较对照组降低(P<0.01)。从0.5h开始,对照组Hcy水平高于溶剂组(P<0.01),持续升高至1h,然后逐渐下降至24h。在0.5、1和3h时发现川芎嗪(1×10-6和1×10-5mol/L)组Hcy水平低于对照组,但低浓度川芎嗪(1×10-7mol/L)组BDNF、MCP-1水平与对照组比较,差异无统计学意义(P>0.05),详见图2。
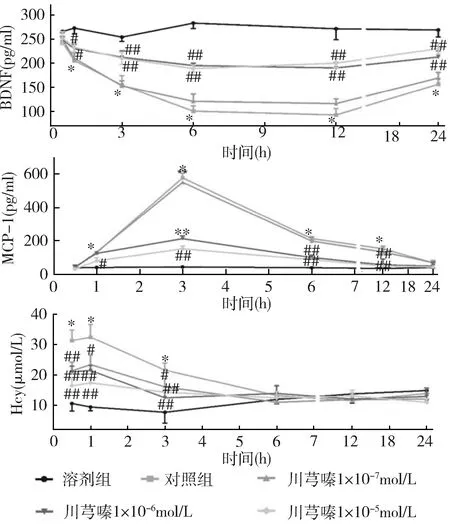
图2 OGD-PC12细胞中BDNF、MCP-1和Hcy表达与溶剂组比较,*P<0.01;与对照组比较,#P<0.05,##P<0.05
3.AO/EB染色观察川芎嗪对OGD-PC12细胞凋亡影响:与溶剂组比较,0.5h后对照组出现严重的细胞肿胀,细胞发生凋亡甚至坏死。0.5~6h时,川芎嗪(1×10-6和1×10-5mol/L)组对细胞损伤有明显的抑制作用,凋亡和坏死较对照组减轻,而川芎嗪(1×10-7mol/L)组凋亡和坏死与对照组比较,差异无统计学意义(P>0.05),详见图3。
4.川芎嗪对OGD-PC12细胞凋亡相关蛋白影响:对照组Bax/Bcl-2和Cl-caspase-3表达高于溶剂组(P<0.05),经不同浓度川芎嗪处理后Cl-caspase-3表达低于对照组(P<0.01),且呈浓度依赖性。与对照组比较,川芎嗪(1×10-5mol/L)组Bax/Bcl-2下降(P<0.05),详见图4。
讨 论
脑慢性低灌注(chronic cerebral hypoperfusion, CCH)可以导致脑缺血缺氧,与老年相关疾病如阿尔兹海默病(Alzheimer′s disease, AD)及血管性痴呆(vascular-dementia,VD)等多种疾病相关[8, 9]。目前对血管性痴呆的机制研究仍然存在许多困难,主要集中在单一途径上,且不够详细[10, 11]。

图3 川芎嗪对OGD-PC12细胞凋亡的影响(AO/EB染色,×400)蓝色箭头.凋亡细胞;红色箭头.坏死细胞与溶剂组比较,*P<0.01;与对照组比较,#P<0.05,##P<0.01
川芎嗪是从一种著名的中药,已广泛应用于脑低灌注相关疾病,如脑卒中和阿尔茨海默病患者[12]。本研究建立BCCAO大鼠和OGD-PC12细胞模型,观察血管性痴呆(VD)大鼠潜在的神经病理改变及川芎嗪的保护作用。由于其慢性临界低灌注环境,笔者进行了体内外实验,选取了多个具有代表性的促凋亡和抗凋亡生物学标志物,检测BCCAO大鼠海马和OGD-PC12细胞中BDNF、MCP-1和Hcy等表达,从不同途径对川芎嗪对VD神经元损伤的保护机制进行了较为清晰的研究。
脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是神经元生长、存活的必需因子,脑缺血后检测BDNF水平可以作为抗凋亡因子和脑源性神经营养功能指标[13]。单核细胞趋化蛋白1(monocyte chemoattractant protein-1, MCP-1)水平进行测定,以评估促凋亡和炎症状态,而同型半胱氨酸(homocysteine, Hcy)是脑内促凋亡和氧化应激的标志物[14~17]。体内和体外ELISA检测结果表明,对照组MCP-1和Hcy水平明显高于假手术组和溶剂组,但经川芎嗪治疗后BDNF在神经元损伤中的减少,与其他生物学标志物比较,BDNF的趋势相反,这说明发生脑灌注不足时会抑制神经元生长因子表达以及激活炎症、氧化应激反应,并且可能在以后的VD发病过程中继续存在。而川芎嗪能通过降低MCP-1和Hcy水平,同时升高BDNF水平,抑制损伤级联反应,抑制促凋亡表达。
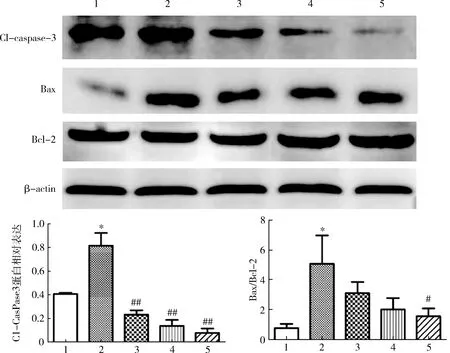
图4 川芎嗪对OGD-PC12细胞Bax、Bcl-2和Cl-caspase-3表达影响1.溶剂组;2.对照组;3.川芎嗪 1×10-7mol/L组;4.川芎嗪 1×10-6mol/L组;4.川芎嗪 1×10-5mol/L组;与溶剂组比较,*P<0.01;与对照组比较,#P<0.05,##P<0.05
为进一步探讨川芎嗪对CCH向VD发展的预防作用,AO/EB染色观察发现,与溶剂组比较,0.5h后对照组出现严重的细胞肿胀,细胞发生凋亡甚至坏死,而当0.5~6h时,川芎嗪(1×10-6和1×10-5mol/L)组对细胞损伤有明显的抑制作用,凋亡和坏死较对照组减轻,且呈浓度依赖性。这说明在低氧和低葡萄糖环境下,神经元功能受损,部分结构崩溃并解体,同时在死亡过程中发生凋亡和坏死。但在这些实验中,川芎嗪随着浓度的增加显著降低了PC12细胞凋亡和死亡细胞数,具有明显保护作用。
相关研究显示,细胞凋亡在许多神经系统疾病中起着重要作用,如阿尔茨海默病和帕金森病[18~20]。细胞凋亡受多种基因调节,Bcl-2家族中发现与凋亡关系密切的基因是Bcl-2和Bax,一般认为Bcl-2抑制凋亡、Bax主要诱导凋亡,二者互相调节,Bcl-2和Bax的比例决定细胞凋亡的趋势;caspase-3是凋亡过程中最关键的凋亡执行蛋白酶,细胞凋亡产生信号传递至caspase-3,并使其开始活化,以蛋白底物裂解、细胞解体为结局。Western blot法检测结果显示,OGD-PC12细胞中Cl-caspase-3表达及Bax/Bcl-2比值均高于溶剂组,说明CCH-VD过程中上调线粒体相关的Bax/Bcl-2和Cl-caspase-3信号通路会发生严重的凋亡,而川芎嗪治疗后Cl-caspase-3和Bax/Bcl-2蛋白表达明显下降,且川芎嗪还对凋亡蛋白表达具有剂量依赖性抑制作用。值得注意的是,对于川芎嗪(1×10-6和1×10-5mol/L)组,上述结果可能还与VD病程中BDNF、MCP-1、Hcy的平衡及综合作用有关。一方面,BDNF具有抗炎和抗氧化作用,对MCP-1和Hcy表达产生影响,但BDNF在神经元凋亡中表达受到抑制;另一方面,MCP-1和Hcy的上调促进了神经元凋亡,间接导致BDNF表达下调。
综上所述,川芎嗪通过降低Bax/Bcl-2比值和Cl-caspase-3的表达抑制线粒体凋亡途径,这些发现为VD疾病的治疗提供了一个新的视角,同时也表明川芎嗪是一种很有前途的神经保护剂,对其他神经退行性血管疾病可能具有保护作用。
