Smoothened沉默胚胎成纤维细胞NIH/3T3的mRNA表达谱分析
2020-10-26刘董剑梁亚冰崔宏伟
刘董剑 梁亚冰 崔宏伟 张 岩 杨 凌
ExpressionProfileAnalysisofmRNAsintheEmbryoFibroblastCellLineNIH/3T3withSmoothenedKnockedDown.LiuDongjian,LiangYabing,CuiHongwei,etal.InnerMongoliaMedicalUniversity,InnerMongolia010110,China
AbstractObjectiveTo investigate the changes of mRNAs expression profile in mouse embryonic fibroblasts cell line NIH/3T3 after silencing the Hedgehog pathway by knocking down the Smoothened (Smo).MethodsTotal RNA from control and Smo knocked down NIH/3T3 cells was sequenced. The differentially expressed mRNA was compared with controls, and BLAST2GO and Kyoto Encyclopedia of Genes and Genomes (KEGG) were used to analyze and predict the functions of these differentially expressed mRNAs. The accuracy of sequencing was verified by real-time quantitative PCR using selected differentially expressed mRNAs.ResultsA total of 2289 mRNAs were found differentially expressed by sequencing in Smo knocked down NIH/3T3 cells, of which 1646 mRNAs were down-regulated and 643 mRNAs up-regulated. The results of real-time quantitative PCR were consistent with those of sequencing. Bioinformatics analysis revealed that differentially expressed mRNAs may be involved in cellular process, single-organism process and biological regulation. Differentially expressed mRNAs were enriched in axon guidance (ko04360), pathways in cancer (ko05200), and microRNAs in cancer(ko05206). The expression and prognostic prediction of receptors of CXCL12, IL-33, TGF-β2 and FGF10 in esophageal and normal esophageal tissues were analyzed using the GEPIA database.ConclusionInhibition of Hedgehog pathway by Smo knocked down in NIH/3T3 cells may be inhibit the growth of tumor cells through CXCL12, IL-33, TGF-β2 and FGF10.
KeywordsMouse embryo fibroblast cell; Hedgehog pathway; Smoothened; Expression profile analysis of mRNAs
越来越多的研究表明,肿瘤微环境(TME)在肿瘤起始、发展和转移中起到重要的作用。目前已知肿瘤微环境中包括成纤维细胞、免疫细胞、内皮细胞、神经细胞、脂肪细胞和细胞外基质。其中成纤维细胞又称为肿瘤相关成纤维细胞(CAFs),表达α平滑肌肌动蛋白(SMA)。CAFs表达多种因子,包括生长因子、趋化因子和细胞因子来调节肿瘤细胞和肿瘤微环境中的其他成分。在食管鳞状细胞癌中,CAFs参与了肿瘤的发生、血管生成、肿瘤增殖和转移、肿瘤的免疫抑制。笔者的研究表明,小鼠胚胎成纤维细胞NIH/3T3可以促进食管癌细胞的增殖,使用慢病毒沉默NIH/3T3细胞中的Smoothened(Smo)基因可以阻碍NIH/3T3细胞对食管癌细胞增殖的促进作用。笔者将Smo沉默(Smo-KD)的NIH/3T3细胞和对照细胞(Smo-NC)进行二代测序,对mRNA表达谱进行比较分析,为进一步阐明其中的分子机制奠定基础。
材料与方法
1.细胞培养和增殖:食管癌细胞KYSE140培养在RPMI1640培养液中,添加10%的胎牛血清(FBS),NIH/3T3 Smo-NC和Smo-KD细胞培养在DMEM培养液中,添加10%的FBS,非必需氨基酸和丙酮酸钠。将KYSE140细胞分到96孔板中,分别加入NIH/3T3 Smo-NC和Smo-KD细胞上清液和对照培养基,放入IncuCyte®S3 活细胞分析系统(美国Essen BioScience公司)中观察KYSE140细胞的增殖情况。
2.RNA提取和测序:按照说明书,使用TRIzol(美国Invitrogen公司)提取NIH/3T3 Smo-NC和Smo-KD细胞的总RNA。将RNA保存在干冰中邮寄至华大基因公司,进行建库和测序。测序使用Illumina Hiseq平台,每个样品平均产出6.13GB的数据。使用DEseq2算法进行差异基因的分析,将fold change(差异倍数)≥2.00且P<0.05的mRNA定义为有差异表达的mRNA。差异表达的mRNA通过BLAST2GO 和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析预测其相关功能。
3.实时定量PCR:按照说明书,使用IScriptTMcDNA Synthesis Kit试剂盒(美国Bio-Rad公司),将总RNA进行反转录成cDNA,再使用iTaqTMUniversal SYBR®Green Supermix试剂盒(美国Bio-Rad公司)对测序得到的差异mRNA进行实时定量PCR,并以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,对测序的结果进行验证。表1列出所用的引物序列。
4.GEPIA数据库中CXCL12、IL-33、TGF-β2和FGF10及其受体在食管癌中的表达和预后预测分析:GEPIA 数据库(http://gepia.cancer-pku.cn/index.html)可基于肿瘤基因组计划(The Cancer Genome Atlas,TCGA)表达数据分析纳入癌症的转录组大数据[1]。利用GEPIA 数据库分析CXCL12、IL-33、TGF-β2和FGF10及其受体CXCR4、IL-1RL1、TGFBR2和FGFR2在食管癌和正常食管组织中的表达情况和预后的预测分析。
5. 统计学方法:采用SPSS 13.0统计学软件对数据进行统计分析,对细胞培养结果和实时定量PCR1. NIH/3T3 Smo-NC和Smo-KD细胞上清液对食管癌细胞增殖的影响:与对照培养基比较,NIH/3T3 Smo-NC和Smo-KD细胞上清液均对食管癌KYSE140细胞的增殖有促进作用,而Smo-KD细胞上清液的作用弱于Smo-NC细胞上清液的作用(图1)。

表1 引物名称和序列
结 果

图1 NIH/3T3 Smo-NC和Smo-KD细胞上清液对食管癌KYSE140细胞的增殖作用与对照培养基比较,*P=0.000;与Smo-KD细胞上清液比较,#P<0.01
2.Smo沉默调节的差异表达基因谱:提取NIH/3T3 Smo-NC和Smo-KD细胞的总RNA,一同测序,发现有2289个mRNA差异表达,其中1646个mRNA在Smo后表达下调,而643个mRNA表达上调。在表达下调的结果中笔者发现Hedgehog通路的靶基因Ptch1、Gli1、Mmp9和PDGFRα都有下调,随后的qRT-PCR结果与测序结果基本一致,证实了mRNA测序结果的可信性(图2)。

图2 qRT-PCR检测沉默Smo基因后NIH/3T3细胞中差异表达基因的结果与NIH/3T3 Smo-KD细胞比较,*P<0.05,**P<0.01,***P=0.000
3.差异表达mRNA的GO功能分析:Gene Ontology (GO)是基因功能国际标准分类体系,包含3个主要的分支,即生物学过程、分子功能和细胞组分。笔者根据差异表达mRNA在这3个方面富集的数目,对Smo沉默,降低Hedgehog通路活性后可能影响的生物学功能进行了分析(图3)。其中,差异表达mRNA富集最多的生物学过程包括细胞过程、单有机体过程、生物学调节、代谢过程和生物学过程的调节等。这些差异表达的基因存在细胞内和细胞外,参与结合、催化活性、分子转导活性、信号转导活性和分子功能调节等。

图3 差异表达mRNA的功能分析包括富集基因最多的生物学进程(前10位),富集基因最多的细胞成分(前10位)和富集基因最多的分子功能(前10位)
4.差异表达mRNA的通路功能分析:通过KEGG的通路富集分析,笔者找到了差异表达mRNA富集的KEGG通路(表2)。Smo沉默导致Hedgehog通路活性下降影响了轴突导向(ko04360)、癌症通路(ko05200)、癌症中的microRNA(ko05206)、致心律失常性右心室心肌病(ko05412)、细胞外基质受体相互作用(ko04512)等。
5.GEPIA 数据库预测分析:测序和验证结果中显示沉默NIH/3T3细胞中的Hh通路关键分子Smo后,趋化因子CXCL12、IL-33和生长因子TGF-β2、FGF10的表达也下降了。利用GEPIA 数据库分析CXCL12、IL-33、TGF-β2和FGF10及其受体CXCR4、IL-1RL1、TGFBR2和FGFR2在食管癌和正常食管组织中的表达情况,和预后的预测分析。首先对比、分析了286例正常食管组织与182例食管癌组织中CXCL12、IL-33、TGF-β2和FGF10及其受体CXCR4、IL-1RL1、TGFBR2和FGFR2的表达水平。食管癌组织中CXCL12、IL-33和FGF10的基因表达水平低于正常的组织(CXCL12和IL-33:P<0.05),而食管癌中TGF-β2的表达高于正常组织 (P<0.05)。CXCR4和TGFBR2的基因表达水平高于正常食管组织,IL1RL1和FGFR2水平在癌组织和正常组织中比较,差异无统计学意义。对预后的分析显示,CXCL12、IL-33、TGF-β2和FGF10及其受体CXCR4、IL-1RL1、TGFBR2和FGFR2的表达差异对患者的预后趋势无明显的影响(图4)。

表2 富集差异表达mRNA的KEGG通路
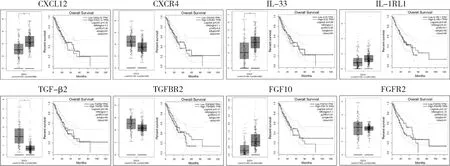
图4 利用GEPIA 数据库中食管癌的信息分析食管癌组织和正常组织中CXCL12、IL-33、TGF-β2和FGF10及其受体CXCR4、IL-1RL1、TGFBR2和FGFR2基因的表达情况和预后的预测
讨 论
由于目前没有商品化的人食管癌成纤维细胞,所以本实验使用的成纤维细胞为小鼠胚胎成纤维细胞NIH/3T3,其表达CAFs的标记蛋白SMA。笔者在NIH/3T3细胞中得到的结果后续会使用原代培养的食管癌CAFs和食管癌组织进行验证。将NIH/3T3与肿瘤细胞共同培养后,肿瘤细胞的增殖加快。NIH/3T3细胞应答Hh配体,研究发现多种肿瘤细胞都分泌Hh配体,所以本研究沉默NIH/3T3细胞中的Hh通路关键分子Smo,并进行了转录组的测序,希望能从中发现NIH/3T3细胞促进肿瘤细胞增殖的关键分子。测序和验证的结果显示,在NIH/3T3细胞中敲减了Smo基因后,Hh靶基因Ptch1、Gli1和Mmp9的表达均有下降。笔者还发现了一些趋化因子CXCL12、IL-33和生长因子TGF-β2、FGF10的表达也下降了。
研究发现,抑制CAFs中CXCL12/CXCR4/CCR7免疫抑制信号轴的表达,可以增加胰腺癌中CCR7效应记忆T细胞浸润,增加肿瘤特异性IFN-γ的表达和提高存活率[2]。在乳腺癌中的研究也证实CXCL12/CXCR4可以促进免疫抑制,而抑制了CXCR4信号后降低了肿瘤基质的纤维化程度,增加了细胞毒性T淋巴细胞的渗透[3]。除了在肿瘤免疫中的作用,在胃癌和结肠癌中的研究发现,CXCL12/CXCR4轴还可以促进肿瘤细胞的增殖和转移[4,5]。研究发现,在肿瘤中IL-33也有着两方面的作用。肿瘤基质和血清中的IL-33通过调节性T细胞和骨髓样来源的抑制细胞促进了免疫抑制;同时,IL-33还可以促进结直肠癌、口腔鳞状细胞癌和头颈部鳞状细胞癌中肿瘤细胞的转移[6~9]。
研究发现,TGF-β2在内皮细胞转化为CAFs的过程中起到重要的作用,通过ELK1和心肌相关转录因子(MRTF)促进内皮细胞向间质细胞的转化[10,11]。其中,FGF可以与TGF-β2协同作用,促进活性成纤维细胞的形成[10]。还有研究报道在结直肠癌中,缺氧诱导因子(HIF-1α)和CAFs分泌的TGF-β2一起,激活肿瘤干细胞中Hedgehog通路转录因子Gli2的表达,从而保持肿瘤干细胞的干性、增强化疗抗性[12]。口腔鳞状细胞癌中,CAFs分泌TGF-β1和TGF-β2,诱导上皮细胞的上皮-间质转化,并下调细胞黏附分子[11]。前列腺癌的CAFs中表达高水平的FGF10和TGF-β2,可以增加肿瘤细胞的增殖和侵袭[13]。
综上所述,本研究中测序和验证发现沉默Smo的NIH/3T3中差异表达分子的作用可以分为3种类型:①与CAFs自身的形成和活化有关;②参与肿瘤微环境的免疫抑制作用;③参与肿瘤细胞的增殖、侵袭和放化疗的抵抗。说明在成纤维细胞中抑制Hedgehog通路可能会抑制CAFs自身的活性,减轻肿瘤微环境中的免疫抑制,抑制肿瘤细胞的增殖、侵袭,提高对放化疗的敏感度。根据文献报道和本研究结果,笔者推测成纤维细胞NIH/3T3分泌的细胞因子CXCL12、IL-33、TGF-β2和FGF10可能影响肿瘤细胞的增殖,在今后的研究中,笔者会继续深入研究具体的分子机制,并希望可以找到临床肿瘤治疗的应用于CAFs的新靶标。
