白藜芦醇对LPS刺激下RAW264.7细胞向破骨细胞分化的影响
2020-10-26刘子歌宋国瑞刘心蕊陈德胜
刘子歌 张 晨 宋国瑞 李 燕 刘心蕊 陈德胜
EffectofResveratrolonDifferentiationofRAW264.7CellsintoOsteoclastsunderLPS.LiuZige,ZhangChen,SongGuorui,etal.SchoolofClinicalMedicine,NingxiaMedicalUniversity;BasicMedicalSchool,NingxiaMedicalUniversity;KeyLaboratoryofFertilityPreservationandMaintenanceofMinistryofEducation,KeyLaboratoryofReproductionandGeneticsinNingxia;DepartmentofOrthopaedics,GeneralHospitalofNingxiaMedicalUniversity,Ningxia750004,China
AbstractObjectiveTo explore the effect pathway and mechanism of resveratrol on osteoclast formation in vitro stimulated by LPS.MethodsMouse RAW264.7 macrophages were cultured in 3 groups, blank group (Sham group); LPS group: blank group + LPS (1μg/ml); Res group: LPS group+resveratrol (10μmol/L). TRAP staining method was used to detect the number of mature osteoclasts in each group. ELISA method was used to detect the expression of TNF-α and IL-1β in the supernatant of each group.Q-PCR method was used to detect the expression of TNF-α and IL-1β mRNA in each group. Western blot method was used to detect the levels of phosphorylated proteins in nuclear transcription factor κBp65 (NF-κBp65) and IκBα in each group.ResultsTRAP staining: The number of osteoclasts positive for TRAP staining in the Res group was significantly reduced compared with the LPS group. ELISA detection: the expression levels of inflammatory factors in the LPS group were significantly higher than those in the Sham group (P<0.05),the expression of inflammatory factors in the Res group was significantly lower than that in the LPS group (P<0.05).Q-PCR detection: the expression levels of TNF-α and IL-1β mRNA in the LPS group were significantly higher than those in the Sham group (P<0.05), and the gene expression of TNF-α and IL-1β in the Res group was significantly inhibited (P<0.05).Western blot detection: the phosphorylation levels of IκBα and p65 in the Res group were significantly reduced compared to the LPS group (P<0.05).ConclusionResveratrol can down-regulate the expression of TNF-α and IL-1β in mouse RAW 264.7 macrophages stimulated by LPS through the NF-κB signalling pathway, and then affect the formation of osteoclasts. It is expected to be a key target for the treatment of inflammatory osteolysis caused by aseptic loosening.
KeywordsResveratrol; Nuclear factor kappa B signalling pathway; Osteoclasts; Aseptic loosening
人工关节置换术(total joint arthroplasty, TJA)被广泛用于治疗严重创伤、骨关节炎和类风湿关节炎等晚期关节疾病[1]。然而,据报道,由假体周围骨溶解(peri-implant osteolysis, PIO)引起的无菌性松动是假体失败的主要原因,导致超过1/3的患者在行TJA后的20年内还需接受翻修手术[2]。尽管翻修手术对于无菌性松动有治疗作用,但是也不能忽视其费用较高、生存期较短和临床效果较差等缺点。有研究证明,植入的假体在后续使用过程收到多种因素的综合作用会不断释放超高分子聚乙烯、钛、钴和铬等多种纳米级磨损颗粒[3]。这些磨损颗粒会进一步刺激单核-吞噬细胞和成纤维细胞的聚集和吞噬,并释放白细胞介素(interleukin, IL)-1β、IL-6和肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)、前列腺素E2(prostaglandin E2, PGE2)等多种炎性细胞因子,他们可以促进炎性反应并诱导破骨细胞的形成和成熟。研究发现,在磨损颗粒刺激下的骨溶解小鼠模型中有内毒素积聚的现象,其中内毒素主要成分是脂多糖(lipopolysaccharide, LPS),因此骨溶解及骨吸收等可能与LPS密切相关[4]。
白藜芦醇是一种天然植物产生的有多种益处的多酚,其中最受关注的是预防癌症和神经保护。有研究报道,它还有一定的骨保护作用,在去卵巢的大鼠中,白藜芦醇显著改善了由雌激素缺乏引起的骨丢失[5]。在老龄小鼠中,长期喂食含白藜芦醇的食物显著延迟了老年性骨质疏松症的发生[6]。多项研究表明,白藜芦醇这种天然物质可能在治疗或预防骨质疏松症方面起作用。然而,白藜芦醇能否有效抑制PIO目前尚不清楚。因为破骨细胞在PIO中起着关键作用,假设白藜芦醇可以通过抑制破骨细胞的形成来防止骨丢失,从而减缓PIO。因此,本研究的目的是研究在体外试验中白藜芦醇对破骨细胞形成的影响,以及其在破骨细胞形成过程中可能的作用途径和作用机制。
材料与方法
1.实验材料:DMEM高糖培养基、胎牛血清(美国Gibco公司);小鼠巨噬细胞株RAW264.7(中国科学院上海细胞库);LPS(美国Sigma-Aldrich公司);白藜芦醇(C14H12O3, 美国MCE公司);TNF-α、IL-1β ELISA试剂盒(武汉伊莱瑞特生物技术公司);抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase, TRAP)染色试剂盒(美国Sigma-Aldrich公司);Prime Script RT reagent Kit Perfect Real Time RNA反转录试剂盒、Ultra SYBR One Step RNA PCR Kit荧光定量PCR试剂盒(日本TaKaRa生物公司);β-actin抗体、p-NF-κBp65、p-IκBα(美国Cell Signalling公司)。
2.细胞培养及分组:按照Islam等[7]的方法建立体外炎性骨吸收细胞模型。将RAW264.7细胞种于含有10%胎牛血清的DMEM培养基,在5%CO2、37℃细胞培养箱培养。细胞共分为3组,即空白组 (Sham组)、LPS组[空白组+LPS(1μg/ml)]和Res组[对照组+白藜芦醇(10μmol/L)]。本实验所使用细胞均在10代以内。
3.实验方法:(1)TRAP染色:将RAW264.7细胞以1×104个/孔接种于6 孔板,待细胞贴壁后按上述实验方法分组处理,总共培养5天,每天换液。第5天后4%多聚甲醛固定细胞。按说明书配置TRAP染液,37℃生物培养箱中避光孵育1h,用碱性液冲洗干净,晾干,光镜下观察并计数。(2)ELISA法检测上清炎性因子表达:按照上述分组方法处理,收集第5天细胞培养的上清;800r/min离心5min,用以去除细胞,用ELISA试剂盒,检测细胞培养上清液中TNF-α、IL-1β蛋白含量。(3)RNA提取及Q-PCR检测:将RAW264.7细胞以1×104个细胞的密度接种在6孔板中,贴壁24h。然后,加入按照实验分组的完全培养基。隔天换液。培养5天后,按照TRIzol试剂说明书规范提取总RNA。引物序列由上海生工设计和合成,详见表1。反转录试剂盒将总RNA反转录成cDNA,随后放入反转录仪中进行反转录反应。(4)Western blot法检测:各组细胞培养5天后,用细胞蛋白试剂盒提取各组细胞的蛋白,BCA蛋白定量试剂定量,配置12%分离胶溶液,50微克/孔加入蛋白匀浆,用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,硝酸纤维素膜膜(NC)转膜,5%BSA封闭1h后,一抗按1∶1500用TBST稀释4℃封闭过夜。二抗按1∶10000用TBST稀释室温孵育2h。加入显色液上机曝光。
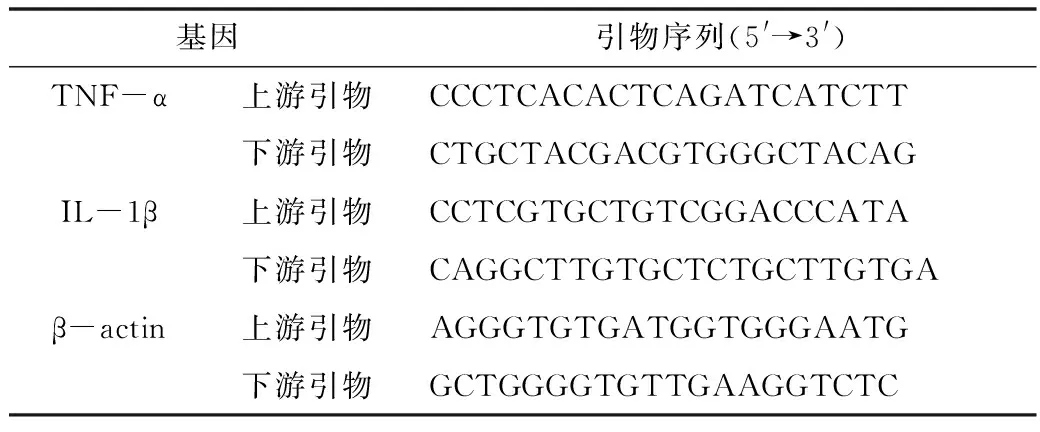
表1 目标基因引物序列

结 果
1.白藜芦醇能够抑制LPS诱导体外破骨细胞的形成: TRAP是破骨细胞特异性的标志酶,TRAP染色是鉴定破骨细胞分化成熟的金标准,多核且 TRAP呈现阳性(酒红色)的细胞便可鉴定为是破骨细胞。在对照组中可以观察到较多体积较大、酒红色、内含多个细胞核的破骨细胞。而Res组中应用白藜芦醇干预后,染色呈阳性的破骨细胞数目明显减少(图1)。
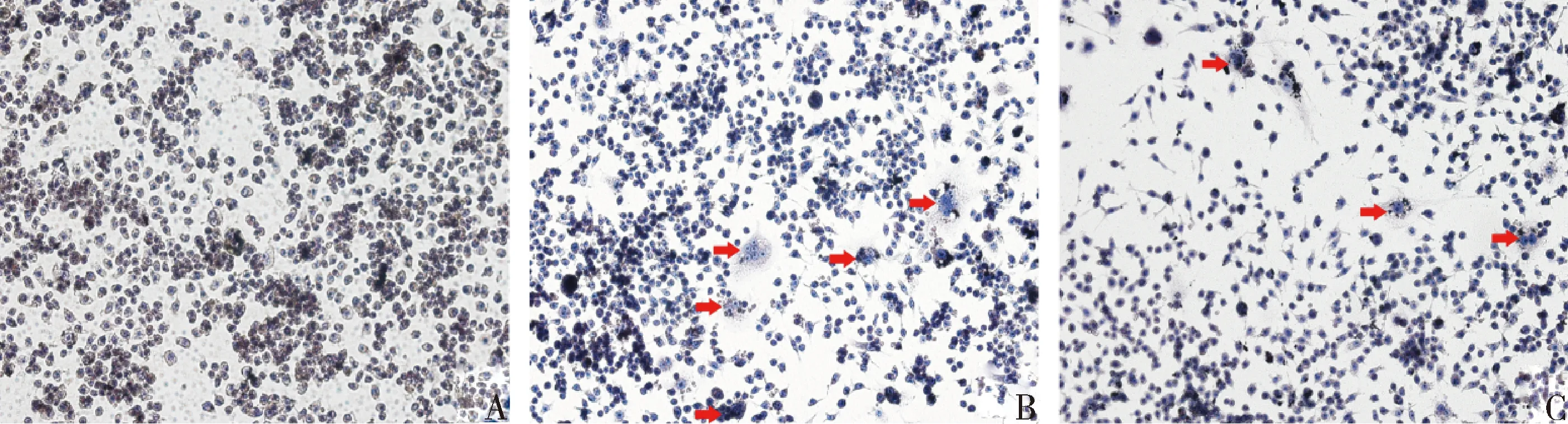
图1 TRAP染色下观察各组细胞培养5天后破骨细胞的数量(TRAP,×200)A.Sham组;B.LPS组;C.Res组。红色箭头标识表示染色呈阳性的破骨细胞
2.白藜芦醇能够降低LPS刺激下小鼠RAW264.7巨噬细胞中炎性细胞因子TNF-α和IL-1β的表达水平:用 ELISA试剂盒分别检测3组细胞上清的炎性因子表达,评价白藜芦醇的抗炎作用。白藜芦醇对这两种炎性细胞因子有显著的抑制效果,Sham组、LPS组和Res组的TNF-α含量分别为24.78±2.06、555.32±17.23和 216.41±12.02pg/ml,IL-1β含量分别为40.55±1.84、223.05±5.94和71.40±3.42pg/ml。LPS组中各炎性细胞因子较Sham组显著升高(P<0.05),Res组较LPS组显著降低 (P<0.05,图2中A、B)。
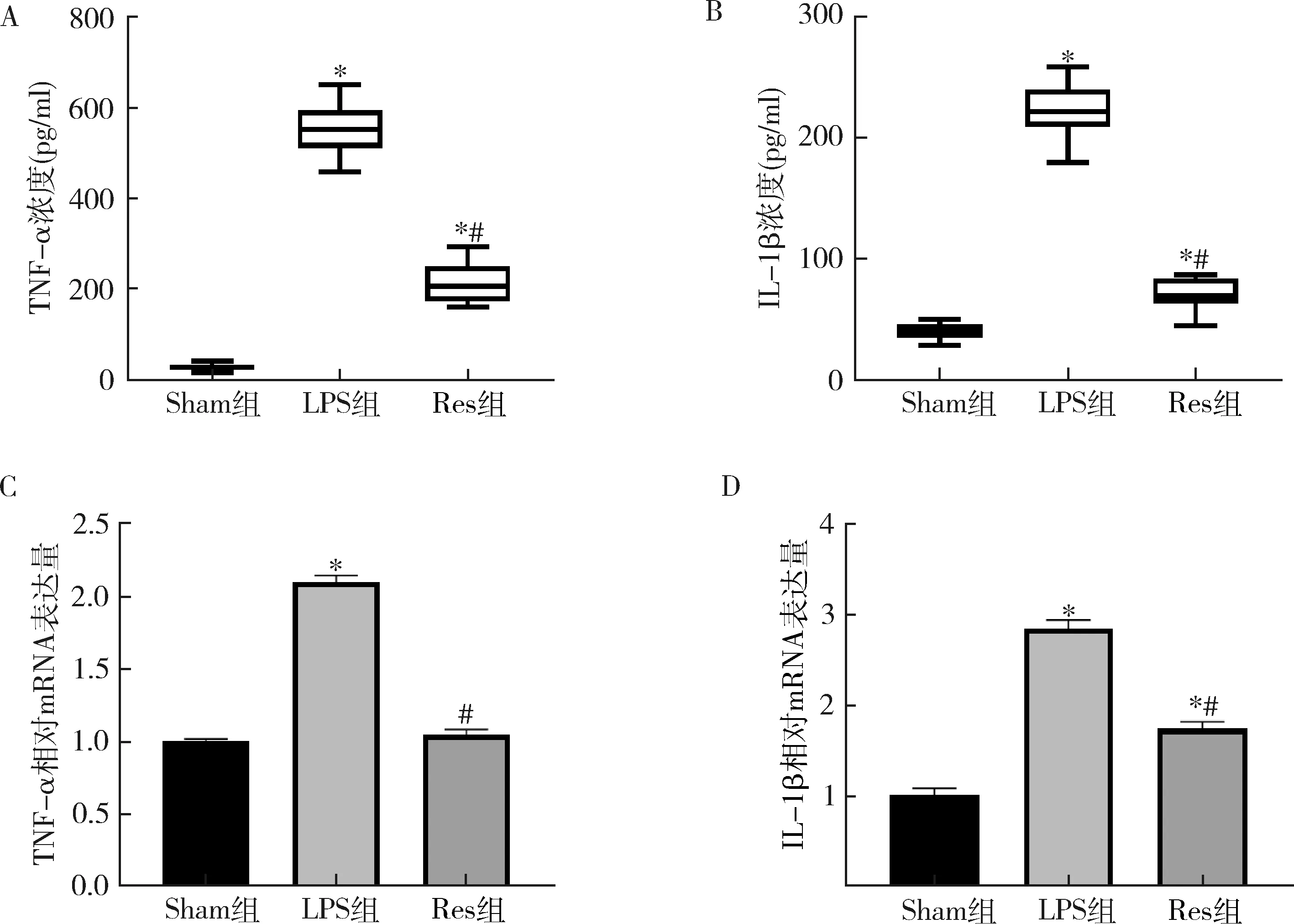
图2 白藜芦醇对TNF-α与IL-1β的影响与Sham组比较,*P<0.05;与LPS组比较,#P<0.05
3.白藜芦醇下调TNF-α和IL-1β mRNA 的表达:Q-PCR实验结果显示,LPS组TNF-α和IL-1β mRNA的表达水平较Sham组明显升高(P<0.05);而相比LPS组的刺激, 在加入白藜芦醇后,Res组中TNF-α、IL-1β的基因表达明显被抑制(P<0.05,图2中C、D)。
4.白藜芦醇调控IκBα和p65蛋白的磷酸化影响NF-κB通路:Western blot法检测结果显示,Res组磷酸化的IκBα和p65的水平相对于LPS组有显著的降低(P<0.05,图3)。
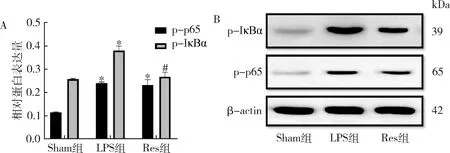
图3 Western blot法分析各组RAW264.7中IκBα和NF-κB p65蛋白磷酸化情况与Sham组比较,*P<0.05;与LPS组比较,#P<0.05
讨 论
人工全关节置换术是治疗终末期关节疾病的有效方法[8]。然而,继发于PIO的无菌性松动是人工关节置换术失败的主要原因[9]。虽然确切的机制尚不清楚,但许多研究已经报道了破骨细胞在PIO的发展中起着重要的作用[10]。因此,破骨细胞被认为是治疗溶骨性疾病的主要靶点。骨代谢内环境由破骨细胞介导的骨吸收和成骨细胞介导的骨形成调控,在健康个体中,二者维持功能平衡,但当破骨细胞增多、功能亢进时就可能导致骨破坏疾病的发生。事实上,许多已知的靶向针对破骨细胞功能的药物,如双膦酸盐,雷尼酸锶和红霉素,已经被证明可以抑制由磨损颗粒诱导的骨吸收作用[11~14]。然而,这些药物的不良反应(发烧、胃溃疡、颌骨骨坏死和不典型骨折),以及它们受限的生物利用度的限制,限制了它们在PIO长期治疗上的使用。因此,许多研究者将重点放在了对不良反应较小的天然化合物上。
白藜芦醇最早在1924年被发现,其具有抗氧化、抗炎症、抗衰老、肝保护和改善血脂异常的能力。有研究指出白藜芦醇可以通过抑制软骨细胞凋亡而起到预防骨关节炎的作用[15]。LPS是革兰阴性杆菌外膜的主要组成成分,在骨组织中,它能够通过促进 Connexin43蛋白与基因的表达,从而促进破骨细胞增多,从而增强骨吸收功能[16]。本研究采用LPS刺激下小鼠RAW264.7巨噬细胞模拟的炎性骨溶解模型,在细胞水平研究白藜芦醇在破骨细胞形成过程中可能的作用途径和作用机制。
破骨细胞从1873年被发现以来,关于其起源就一直存有广泛的争议。但是现在已经证明破骨细胞是一种终末细胞,与体内的成骨细胞同源,都是由巨噬细胞分化和自我融合而形成的[17]。本实验中所采用的小鼠RAW264.7细胞与小鼠骨髓巨噬细胞(bone marrow macrophage, BMM)普遍用于破骨细胞相关的体外实验研究。而体外诱导RAW264.7细胞产生破骨细胞是一种比较成熟的体外培养破骨细胞的方法。相比BMM原代细胞的提取,RAW264.7具有细胞个体差异小、体外易于扩增、无需分离纯化等方法提纯和鉴定,更有利于对破骨细胞相关研究的开展。
炎性骨病中骨生长重建机制尚不明确,而通过研究LPS介导下的炎性骨病中破骨细胞的分化和活性调控机制,对于明确其规律具有重大意义,同时也能为感染性骨疾病的治疗提供新方向。LPS所诱导的炎性骨溶解反应主要是通过刺激巨噬细胞、成纤维细胞、成骨细胞及T淋巴细胞等分泌大量的TNF-α、IL-1β、和IL-6等炎性细胞因子引起。本研究的TRAP结果也显示,Res组中破骨细胞数目与大小与LPS组比较显著下降。研究表明,骨溶解与破骨细胞过度活动和骨吸收密切相关[18]。因此,探讨破骨细胞与假体松动的关系具有重要的研究价值。炎性细胞因子TNF-α、IL-1β和IL-6等已被证实可以诱导破骨细胞前体细胞生成,进而加速人工关节假体周围骨溶解,最终导致无菌性松动[19]。因此,调控炎性相关骨溶解效应在骨科研究中具有重要作用。白藜芦醇可显著降低在LPS刺激下的小鼠RAW264.7巨噬细胞中TNF-α和IL-1β 的表达,ELISA对细胞培养上清的检测结果也证实了这一点。提示白藜芦醇对LPS刺激下骨吸收的保护作用部分归因于其抑制促炎性细胞因子的产生。
经典的NF-κB是一种异源二聚体,主要存在于细胞质中。它在炎症过程中被激活,上调细胞因子的产生,以维持炎症的级联反应[20]。在TNF-α、LPS的刺激下,IκBα被磷酸化和降解,NF-κB二聚体释放并移位到细胞核,通过与这些基因的启动子结合来促进其靶基因的转录;NF-κB还可以被核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand, RANKL)通过与破骨细胞前体膜上的核因子-κB受体活化因子(receptor activator of NF-κB, RANK)受体结合,从而促进破骨细胞的成熟、促进骨吸收。Franzoso等[21]早在1997年就研究证实,NF-κB p50/p52基因敲除小鼠不能产生成熟的破骨细胞。因此,阻断NF-κB信号被认为是抑制破骨活性和减缓磨损颗粒诱导的骨溶解的有效方法。本研究通过Western blot法证实,白藜芦醇通过减少IκBα和p65的磷酸化来抑制NF-κB的激活。
综上所述,本研究证实白藜芦醇有效地减轻了LPS诱导的小鼠RAW 264.7巨噬细胞炎症骨吸收模型,这可能是通过调控NF-κB信号转导通路来实现的。这些结果进一步支持了白藜芦醇的骨保护作用,并为白藜芦醇公认的抗炎和骨保护作用提供了新的机制见解。
