家族性高胆固醇血症患者基因风险评分与心血管疾病的相关性
2020-10-26张娟娟付智鹏
李 娜 张娟娟 付智鹏 谢 伟
家族性高胆固醇血症(familial hypercholesterolemia,FH)是一种常见的常染色体显性遗传疾病,流行病调查显示其发生率为4‰[1]。FH常见的发生变异的基因包括:低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)、载脂蛋白B(apolipoprotein B,ApoB)及枯草溶菌素转化酶(proprotein convertase subtilisin/kexin type 9,PCSK9)等基因[2,3]。这些突变可导致低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平上升及心血管疾病(cardiovascular disease,CVD)发生的风险增加,但在临床确诊的FH患者中20%~80%明确为单致病基因引起,另有20%左右的患者被认为是多基因突变引发[4~6]。研究显示,单基因突变的FH患者CVD的发生风险是无突变患者的3.5倍,但与FH相关的多基因突变与CVD的关系尚缺乏研究报道[7]。
材料与方法
1.一般资料:选取2016年1月~2019年6月在新疆生产建设兵团医院诊断及就诊的FH患者,纳入标准:①FH诊断符合中华医学会心血管病学分会《家族性高胆固醇血症筛查与诊治中国专家共识》,且为初次诊断及治疗[8];②成年汉族;③既往病史明确。排除标准:①合并心源性休克、恶性肿瘤、严重心律失常、心力衰竭;②心脑血管先天发育异常;③已使用降脂或其他影响血脂的药物。共纳入199例患者,根据是否合并心血管疾病分为观察组(n=43)与对照组(n=156)。心血管疾病的定义为:不稳定型心绞痛,心肌梗死,脑卒中或需要行经皮穿刺冠状动脉介入、冠状动脉旁路移植术。
2.一般资料及血脂水平测定:所有患者入组后抽取清晨空腹静脉血3ml,送至笔者医院检验科使用全自动生化分析仪(日本奥林巴斯2700型)检测血脂水平,包括:甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C);并搜集患者一般资料,包括伴随疾病、吸烟史及家族CVD史。
3.基因检测:使用DNA收集试管(Oragene DNA,加拿大Genotek公司)于入组时收集患者唾液样本,使用总DNA提取试剂盒(PrepIT L2P,加拿大Genotek公司)从中提取,使用DNA浓度检测盒(Quant-iT PicoGreen assay,美国Life Technologies公司)进行浓度检测,每份样本结果>10ng用于基因检测。使用二代测序对样本基因变异分类及进行多基因风险评分计算,检测范围包括在ClinVar被标注为FH致病或可能致病的基因[9]:LDLR、ApoB、PCSK9,得出每名患者遗传效应风险评分,具体检测由广州华大基因生物公司完成。
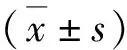
结 果
1.患者一般资料:观察组的年龄和家族性心血管病史率显著高于对照组,详见表1。

表1 患者一般资料
2.血脂水平对比:观察组的TG(t=2.171,P=0.031)、TC(t=6.325,P=0.000)及LDL-C(t=6.890,P=0.000)水平显著高于对照组,HDL-C(t=5.137,P=0.031)水平显著低于对照组,详见表2。

表2 血脂水平对比
3.基因风险评分结果:基因风险评分分布在1.25~2.25分,1.25分1例,1.30分1例,1.35分2例,1.40分3例,1.45分2例,1.50分3例,1.55分4例,1.60分4例,1.65分5例,1.70分7例,1.75分7例,1.80分9例,1.85分12例,1.90分13例,1.95分18例,2.00分18例,2.05分25例,2.10分18例,2.15分19例,2.20分11例,2.25分10例,2.30分7例,2.35分5例,2.40分3例,2.45分2例,2.50分1例,以中位分数1.90分可将患者分为高基因风险(>1.9)共112例,及低基因风险(≤1.9)共87例,且观察组在高基因风险比例显著高于对照组(81.40% vs 49.36%;χ2=14.060,P=0.000)。
4.基因风险评分与LDL-C的相关性:Spearman相关性分析显示基因风险评分与LDL-C水平呈显著正相关(r=0.358,P=0.000),详见图1。

图1 基因风险评分与LDL-C的相关性
5.心血管疾病发生的多因素Logistic回归分析:年龄(OR=1.369,P=0.001)、家族性心血管病史(OR=3.043,P=0.044)、LDL-C(OR=1.734,P=0.000)、高基因风险评分(OR=6.507,P=0.003)是心血管疾病发生的独立危险因素,HDL-C(OR=0.008,P=0.000)是心血管疾病的独立保护因素,详见表3。
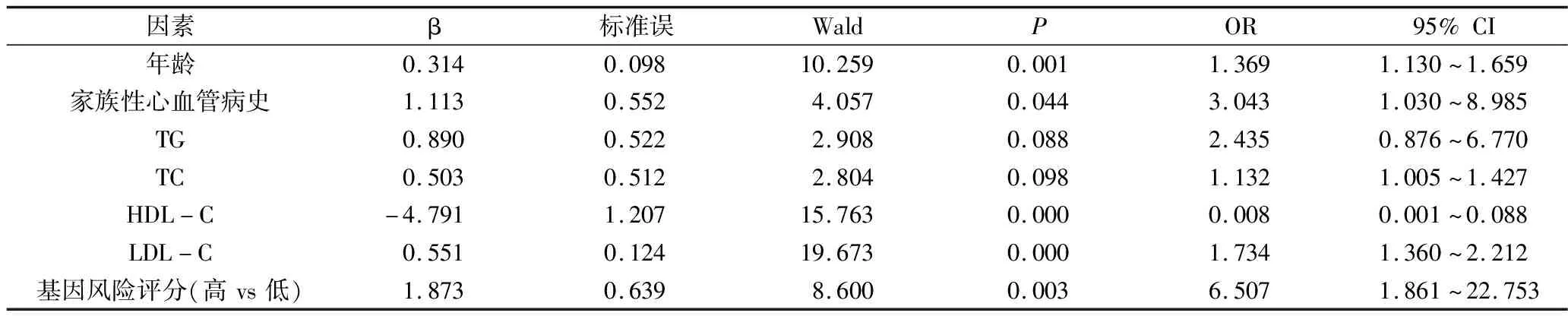
表3 预后不良发生的多因素Logistic回归分析
讨 论
FH特征表现以LDL-C水平增加、多部位肌腱黄色瘤和早发动脉粥样硬化为主[9]。既往研究显示,在临床确诊的FH患者中约有50%可检测出基因突变,而具有基因突变的FH患者发生CVD的风险较无基因突变的FH高[10]。同时在对LDL-C水平进行校正后,基因突变所带来的CVD风险仍然显著,提示FH患者致病基因型是除LDL-C水平外FH患者发生CVD的重要因素[11]。
本研究结果显示,伴有CVD的FH患者在多项检查结果中与未发生CVD的FH患者存在显著差异,包括较高的家族性心血管病史率,高水平的TG、TC及LDL-C,低水平的HDL-C。当前已知CVD的发生是多种因素共同作用的结果,其中血脂异常具有重要作用[12]。异常的血脂可参与血管内皮粥样硬化的形成,增加坏死细胞的聚集及脂类沉积,低水平HDL-C还可降低抵抗血管粥样硬化能力。同时Khera等[4]研究证实在高水平LDL-C患者中,FH相关致病基因的突变可显著增加其发生冠状动脉疾病的发生风险[13]。
近年来研究显示,CVD的发生具有较强的遗传学基础,属于受多种基因影响的复杂遗传疾病,遗传影响程度可高达50%,其中单核苷酸多态性(single mucleotide polymorphism,SNP)是最常见的遗传变异类型,但单个SNP往往只能体现极小部分的遗传贡献度[14,15]。而将多个SNP综合探讨则可发现更高的遗传易感效应,遗传效应风险评分就是用于评估遗传综合效应的可量化方法之一,原理是统计被检测对象在所检测基因范围内携带的具有风险等位基因的总量[16]。本研究通过分析纳入患者3种常见基因突变情况,并计算基因风险评分,结果显示基因风险评分分布在1.25~2.25分,中位分值为1.90分,且发生CVD的FH患者在高基因风险评分的人数比例显著高于未发生CVD的患者,表明FH患者高水平基因风险评分与CVD的发生具有一定联系。同时相关性分析显示基因风险评分与LDL-C水平呈显著正相关,提示随着基因突变的增多,FH患者体内LDL-C水平也显著上升,目前致FH的基因中,低密度脂蛋白受体基因SNP突变是主要病理基础,LDLR广泛分布于内脏及大血管的血管内皮及白细胞表面,可特异性结合APOB的脂蛋白进入细胞内代谢,有效清除血中LDL-C,因此该基因出现的突变均可致病,目前发现的LDLR突变高达1741种,均可使LDLR功能下降,这可能是LDL-C水平升高的原因之一[17,18]。
多因素Logistic回归分析显示,高基因风险评分与家族性心血管病史、TC、TG均为CVD发生的独立危险因素,表明多FH致病基因变异是FH患者发生CVD的重要因素,提示基因风险评分检测在FH患者中具有较好的应用前景,可由于评估CVD的发生风险。但同时本研究也存在一定不足,本研究所检测基因未包含所有致FH的基因,除SNP外还存在其他形式的致病基因以及小样本单中心研究的局限性。
综上所述,FH患者基因风险评分与LDL-C水平呈显著正相关,高基因风险评分是CVD发生的独立危险因素。
