Reg3β干扰载体的构建及在H9C2心肌细胞中的鉴定
2020-10-26蔡玉立李俊峰陈小琳文重远
易 波 蔡玉立 李俊峰 包 艳 陈小琳 文重远
心血管疾病是严重危害我国人民群众生命健康的慢性非传染性疾病之一,但目前仍缺乏有效的干预手段[1]。再生基因蛋白3β(regenerating islet-derived protein 3 beta,Reg3β)是新近发现具有抗炎和抗凋亡作用的分泌性蛋白,结构上属于C型凝集素家族,其基因序列具有保守性[2~5]。在自身免疫性心肌炎、缺血性心脏病和心肌肥厚等动物模型中,Reg3β仅在心肌细胞中表达增多,而心脏组织非心肌细胞中均无表达[3,6,7]。研究发现,Reg3β不仅与心力衰竭患者的心功能分级和急性冠状动脉综合征(ACS)患者心肌炎性反应强度相关,还能预测心血管死亡风险,更能修复大鼠心脏功能、改善心肌梗死预后[3,6,8]。提示Reg3β不仅是心血管疾病的临床评估和预后的生物学标志物,还具有潜在的心肌保护功能,具有广阔的临床应用前景。
因此,本研究拟构建Reg3β干扰载体,并在H9C2大鼠心肌细胞中优化转染条件,鉴定抑制效果,为深入探索Reg3β在心血管疾病的作用提供有利的工具。
材料与方法
1.实验材料:大鼠心肌细胞H9C2来源于武汉大学人民医院中心实验室。Reg3β-shRNA由上海吉玛公司合成,pG1.2空白载体由武汉巴菲尔生物技术服务有限公司提供,该载体含有增强绿色荧光蛋白(EGFP)。感受态细胞大肠杆菌DH5α及无内毒素质粒提取试剂盒来源于北京康为世纪生物科技有限公司。反转录cDNA试剂盒购自北京天根生化科技有限公司。DNA引物由上海吉玛公司合成;质粒测序由深圳华大基因研究院完成。Lipofectamine2000、Lipofectamine3000转染试剂和Opti-MEM培养基均来源于美国Invitrogen公司。羊抗大鼠Reg3β抗体购自美国R&D公司(货号AF1996),抗鼠β-actin抗体、抗羊二抗、抗小鼠二抗均购自北京四正柏生物科技有限公司。
2.Reg3β干扰表达载体的设计与筛选:检索GeneBank以获取大鼠Reg3β mRNA基因全序列(RefSeq ID:NM_053289.1;Gene ID:24618),从起始密码子AUG快开始寻找“AA”二连序列,以其3′端的19个碱基序列为潜在的siRNA靶点。据此选出3条合适的目标序列及其抑制靶点和1条空白对照序列由上海吉玛公司合成基因片段。随后将合成的siRNA以脂质转染法转染至H9C2心肌细胞中,以实时荧光定量PCR检测Reg3β mRNA表达量,以此计算3条干扰片段的抑制率[抑制率(%)=(1-各组Reg3β变化倍数)×100%],从而筛选合适的基因片段用于构建shRNA(表1)。
3.shRNA表达载体的构建:根据pG1.2表达质粒的要求,在干扰片段5′端加入一个SacⅠ的酶切位点(GAGCTC),3′端加入LOOP环序列(TTCAAGACG),接着加入其反向互补序列,最后加上终止密码子序列TTTTTTG、SacⅠ酶切位点和BsaⅠ酶切位点。按照同样方法得到其反义链序列。随后将前述正义链和反义链于94℃退火成双链DNA,同时利用BsaⅠ酶切pG1.2质粒得到线性化载体,将两者在T4连接酶作用下进行连接反应。
4.shRNA表达载体的验证:将10μl前述连接产物转化至感受态大肠杆菌DH5α,并均匀涂布与含有卡那霉素的筛选培养板上,挑取数个单克隆菌落接种于5ml含卡那霉素抗性的LB培养液中扩增,提取质粒后使用SacⅠ酶切鉴定,并将酶切鉴定正确的质粒进行测序验证。
5.H9C2大鼠心肌细胞培养:参考美国典型培养物保藏中心(American Type Culture Collection,ATCC)建议,大鼠H9C2心肌细胞置于含4.5g/L葡萄糖和10%胎牛血清(浙江天杭生物科技股份有限公司)的DMEM培养基(美国HyClone公司)中,在37℃和5% CO2培养箱中培养,于细胞密度在80%~90%时进行传代。取对数生长期且生长状态良好的H9C2细胞,以每孔3×105个细胞数接种于6孔板内,培养过夜后进行后续实验。
6.shRNA表达载体的转染条件优化:转染前2h将细胞培养液换成无血清DMEM培养基。用opti-MEM培养基分别稀释质粒和Lipofectamine2000或Lipofectamine3000,混匀后室温静置5min。Lipofectamine2000和Lipofectamine3000转染试剂均以质粒∶转染试剂=1μg∶2μl和1μg∶3μl的比例配置配制质粒-脂质体复合物250μl,静置20min后加入H9C2细胞内轻轻混匀。6h后吸出复合物,换入正常培养基进行培养,48h后于倒置显微镜下观察EGFP自发荧光强度以明确转染效率。
7.H9C2细胞内干扰效果鉴定:转染共分成3组,即空白组、pG1.2-Reg3β shRNA组和shRNA对照组,每组3个复孔。6孔板中接种H9C2细胞后,按shRNA最优转染条件,依次加入无血清培养基250μl、pG1.2-Reg3β shRNA混合物250μl、pG1.2空白载体混合物250μl。继续培养48h后提取细胞进行Reg3β mRNA和蛋白检测。
8.q-PCR检测Reg3β mRNA表达量:以Trizol法(美国Ambion公司)提取细胞总RNA并检测其浓度后反转录成cDNA,以SYBR Green Master Mix进行PCR扩增得到各种Ct值,反应条件为50℃ 2min,95℃预变性10min,95℃变性30s,60℃退火30s,共40 个循环。大鼠β-actin引物序列为上游引物:5′-CACGATGGAGGGGCCGGACTCATC-3′;下游引物:5′-TAAAGACCTCTATGCCAACACAGT-3′,大鼠Reg3β引物序列为上游引物:5′-GCTCCTACTGCTATGCCCTGTT-3′;下游引物:5′-TTACTCCACTCCCATCCACCTC-3′。以β-actin为内参,以2-ΔΔCt法计算各组Reg3β mRNA表达量相对于对照组表达量的变化倍数即为Reg3β mRNA相对表达量。
9.Western blot法检测Reg3β蛋白表达量:以RIPA裂解液常规提取细胞总蛋白,加入5×SDS上样缓冲液后于100℃变性蛋白。上样后经15%分离胶和浓缩胶进行SDS-PAGE电泳,并将蛋白转移至0.22μm PVDF膜,加入5%脱脂奶粉室温封闭1h,依次加入Reg3β和β-actin一抗(稀释比均为1∶1000)及相应二抗进行孵育,以超敏ECL法进行显色。
10.统计学方法:采用SPSS 20.0统计学软件对数据进行统计分析:多组间比较采用单因素方差分析(One-wayANOVA),组间比较采用LSD检验,以P<0.05为差异有统计学意义。
结 果
1.靶向Reg3β mRNA的干扰片段筛选:如表1所示,设计的3条shRNA分别针对Reg3β mRNA第159~178位碱基、第195~214位碱基和第284~303位碱基,其抑制率分别位67.93%、28.14%和36.19%。因此,选择抑制率最高的第一条干扰序列(即Reg3β shRNA-1)为基础构建shRNA。
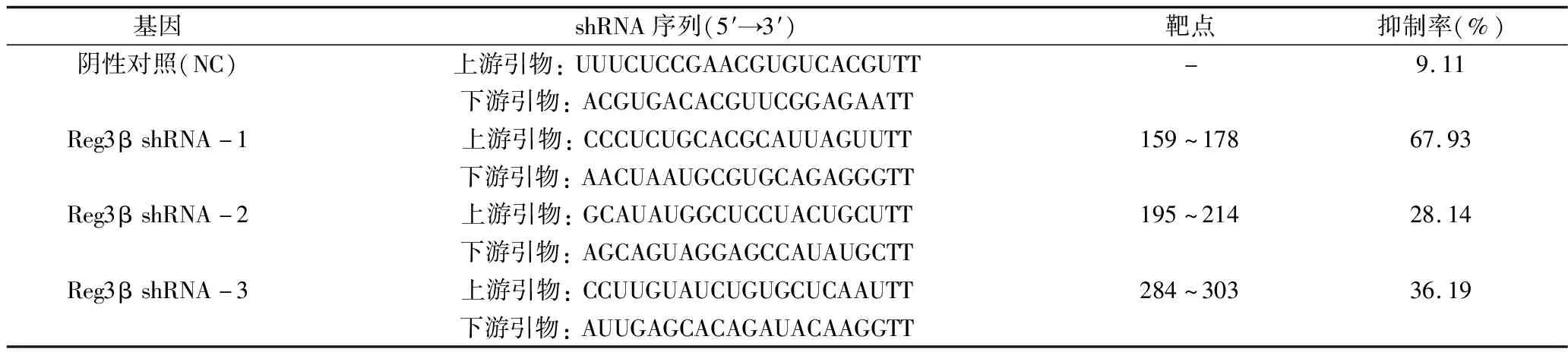
表1 Reg3β shRNA基因片段序列、靶点及抑制率
2.Reg3β-shRNA表达载体的酶切和测序鉴定:因pG1.2质粒里面只有一个SacⅠ的酶切位点,因此在构建Reg3β-shRNA时于干扰片段前加入另一个SacⅠ的酶切位点,当质粒被SacⅠ酶切出一条约600bp DNA条带时,说明退火片段连接到pG1.2载体里。酶切结果显示Reg3β-shRNA经SacⅠ酶切后与预期结果一样出现600bp的条带(图1)。测序结构证实构建的Reg3β-shRNA与实验设计序列一致,且干扰片段前有SacⅠ酶切位点(GAGCTC),详见图2。

图1 pG1.2-Reg3β shRNA酶切验证

图2 pG1.2-Reg3β shRNA测序验证
3.H9C2心肌细胞转染条件优化:将两种转染试剂和Reg3β shRNA以不同比例混匀,48h后用倒置荧光显微镜观察,结果发现Lipofectamine3000(1μg∶3μl)的转染效率最高可达50%,而Lipofectamine2000的转染效率均不足10%(图3)。
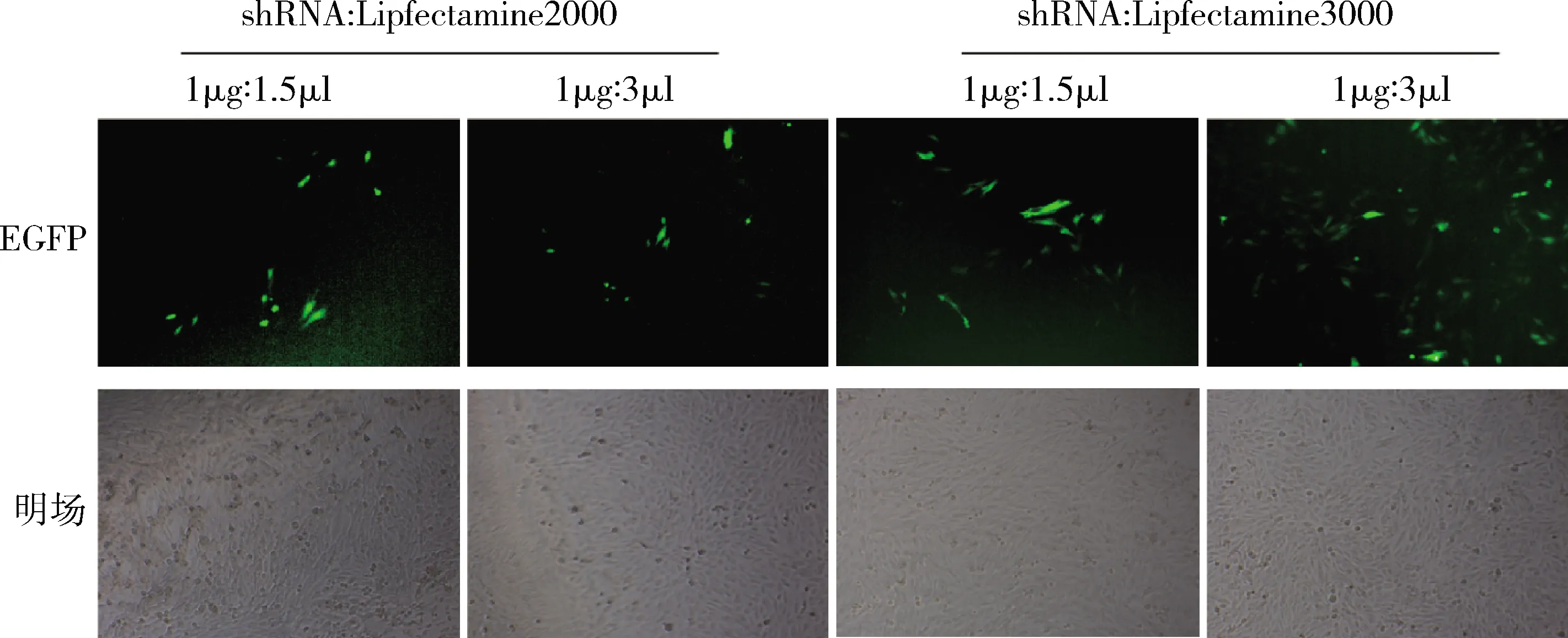
图3 不同条件下pG1.2-Reg3β shRNA转染H9C2的荧光显微镜图(×40)
4.H9C2细胞内Reg3β 干扰效果评估:将Reg3β shRNA按最优条件转染至H9C2细胞,48h后以q-PCR和Western blot法鉴定干扰效果(图4)。与空白组比较,Reg3β shRNA可使mRNA相对表达量下降60%以上(P<0.01),Reg3β蛋白表达量下降50%左右(P<0.05),而shRNA对照组不抑制Reg3β表达(P>0.05)。

图4 q-PCR和Westem blot法评估pG1.2-Reg3β shRNA抑制效果
讨 论
随着人们饮食结构及生活方式的改变,糖尿病、肥胖、高脂血症、高血压等心血管疾病高危因素流行趋势明显,在今后较长的时间内,心血管疾病患病人数将会急剧增加[1, 9]。因此,及时针对心血管疾病开展发病机制、诊断、干预治疗的相关研究,有助于提高患者生命质量,有着重要的临床价值和社会意义。
Reg3β是具有进化保守性分泌蛋白。大鼠Reg3β位于4q33(NC_005103.4),含6个外显子,共编码188个氨基酸;小鼠Reg3β位于6C3(NC_000072.6),含6个外显子编码175个氨基酸。在人体中该蛋白又称为Reg3A(再生基因蛋白3A,Regenerating Islet-Derived Protein 3-Alpha),位于2p12(NC_000002.12),含6个外显子,编码175个氨基酸。人Reg3β与大鼠Reg3β具有72.99%的基因序列一致性,与小鼠Reg3β的基因序列一致性为75.1%,氨基酸序列一致性为70%,与小鼠Reg3α、Reg3γ、Reg3δ等其他家族成员的氨基酸序列一致性低至50%[10]。研究表明,针对重组人Reg3β蛋白设计的抗体能与小鼠Reg3β具有交叉反应,证实Reg3β在不同物种中可能具有类似的分子结构基础[4,10]。因此,研究大鼠Reg3β的功能有助于深入理解该蛋白在人体中的潜在作用。
Reg3β虽然在体内许多组织和细胞均有表达,但在心血管疾病中仅特异性表达于心肌细胞,具有潜在的心肌保护作用。生理状态下,Reg3β仅表达于小肠、胰岛α细胞、分泌生长激素的细胞、子宫等组织。在某些疾病时许多组织会高表达Reg3β蛋白,例如急性胰腺炎时的胰腺组织、糖尿病大鼠胰岛组织、再生的胰岛β细胞、肿瘤组织、受损的神经组织等[4]。在自身免疫性心肌炎、缺血性心脏病和心肌肥厚等动物模型中,Reg3β仅在心肌细胞中表达增多,而心脏组织非心肌细胞中均无表达[3,6,7]。研究发现,Reg3β能诱导巨噬细胞向心肌受损部位浸润以清除中性粒细胞残骸,进而修复心脏功能,提高小鼠梗死后存活率[3]。虽然既往研究证实Reg3β既能减少TNF-α、IL-1β和细胞黏附分子的表达,又能抑制β细胞和胰腺癌的凋亡,但其是否通过抗炎和抗凋亡作用而保护心肌细胞仍有待深入研究[2,4,5,11]。
目前研究Reg3β功能及机制的常用方法是外源性Reg3β蛋白干预、Reg3β全身敲减小鼠、Reg3β过表达小鼠、以及下游gp130/JAK2/STAT3信号通路抑制剂等[3~5,12]。RNA干扰技术可介导细胞内序列特异的靶基因表达沉默,产生相应的功能表型缺失的现象,为探索Reg3β功能及机制提供了新的维度。因此,本实验采用pG1.2干扰表达载体,带有EGFP绿色荧光标记和CCDB基因,其中EGFP用于细胞内观察shRNA表达情况,CCDB基因可用于筛选线性化的载体。本研究利用设计的3条Reg3β siRNA,筛选出抑制效率最高达到67.93%的抑制序列,进而成功构建了pG1.2-Reg3β shRNA沉默载体,既能瞬时转染细胞以短暂的降低Reg3β的表达,也希望包装成病毒表达载体感染细胞以获得稳定表达株。
大鼠H9C2细胞是研究心肌细胞功能的常用细胞株之一,既能用于研究心力衰竭相关基因如基质金属蛋白酶-2的作用,还能用于心肌细胞凋亡和细胞毒性研究[13]。此外,在H9C2细胞中,高浓度葡萄糖能诱导凋亡和炎性反应,并能够观察到降糖药物二甲双胍和肠促胰素样肽(GLP-1)受体激动剂的心肌保护作用[14, 15]。但早期研究发现,在阳离子脂质转染体模型下,H9C2细胞转染效率远低于HEK293细胞,影响了该细胞的科研应用[13]。因此,为获得高效无毒的H9C2细胞转染方法,笔者优化摸索两种常用阳离子脂质体Lipofectamine2000和Lipofectamine3000的转染条件,结果发现pG1.2-Reg3β shRNA沉默载体:Lipofectamine3000比例为1μg∶3μl时,其转染效率可达到50%,明显高于其他转染模式。倪银芸等[13]研究发现,Lipofectamine3000细胞毒性小,转染EGFP-LC2质粒的效率也显著高于Lipofectamine2000、FuGen HD和DNA-In CRISPR等3种转染方法,推荐用于H9C2细胞的转染。
在此基础上,本研究以最优转染条件将成功构建的pG1.2-Reg3β shRNA沉默载体转入H9C2细胞,PCR和Western blot法检测结果显示,Reg3β表达的抑制率可达到50%以上。但本研究也存在一定的局限性,如pG1.2-Reg3β shRNA抑制效果仅为50%以上,酶切验证时未能将同时将空白载体和pG1.2-Reg3β shRNA放在一起进行验证,细胞转染条件需要进一步优化,亦未能在病理条件下(如高血糖)观察该载体的抑制效果。无论如何,本实验成功构建的pG1.2-Reg3β shRNA有望为后续深入探讨Reg3β在心血管疾病中的作用奠定了基础。
