免疫检查点抑制剂相关内分泌不良反应的研究进展
2020-10-24综述审校
综述 审校
免疫检查点(immune checkpoint)在人体的免疫系统平衡中至关重要,能够抑制过度的免疫反应,避免伤害宿主细胞,而很多肿瘤也借此机制逃避机体的免疫监控。免疫检查点抑制剂(immune check⁃point inhibitors,ICIs)可激活免疫系统,使得肿瘤细胞被免疫系统识别并破坏,从而显著改善晚期恶性肿瘤患者的预后[1]。自从2011年美国食品和药物管理局(FDA)批准第一个ICIs以来,共有7种ICIs上市,分别针对细胞程序性死亡受体-1(programmed cell death receptor-1,PD-1)、程序性死亡配体-1(pro⁃grammed death-ligand 1,PD-L1)以及细胞毒性T淋巴细胞相关蛋白-4(cytotoxic T-lymphocyte antigen-4,CTLA-4)(表1)[2]。一方面ICIs的成功应用给广大恶性肿瘤患者带来了诸多的益处,而另一方面如何诊治免疫相关不良反应(immune-related adverse effects,irAEs)也成为临床医生面临的难题,其临床表现多样,对近年来相关研究缺乏总结归纳。因此,本文就ICIs作用机制及irAEs中的内分泌相关不良反应进行概述。
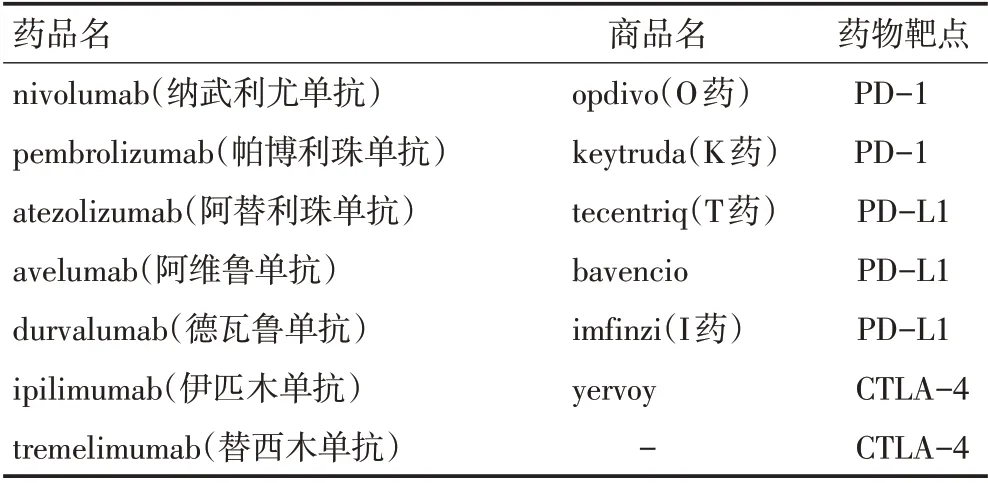
表1 已上市的免疫检查点抑制剂药物及作用靶点
1 ICIs作用机制
多种细胞参与免疫调节,T细胞是其中最重要的节点之一。T细胞的激活需要两个过程,首先是抗原提呈细胞(antigen-presenting cell,APC)提呈的抗原与T细胞表面受体相结合,从而初步激活T细胞,后一过程则需要共信号分子的参与。不同的共信号分子可以促进或抑制T细胞的激活,已知的共刺激信号有CD28/B7,在T细胞被APC传递的抗原激活后,其表面的CD28分子与APC表面的B7分子结合,促进T细胞的活化,进而激活效应细胞对表达相关抗原的细胞进行杀伤[3]。免疫检查点则是T细胞活化的共抑制信号,T细胞被初步激活后,免疫检查点通过抑制T细胞的活化进行负向调节,从而防止过度的免疫反应。目前已知的免疫检查点有CTLA-4、PD-1、T淋巴细胞弱化因子(B and T lymphocyte attenuator,BTLA)以及淋巴细胞激活因子-3(lymphocyte activation gene-3,LAG-3)等[4],部分肿瘤细胞也借此机制来逃避机体免疫系统的监控。这给利用CTLA-4、PD-1等免疫检查点来治疗肿瘤的新疗法提供了思路和理论基础,下文将详细描述这两种通路的免疫机制(图1)。
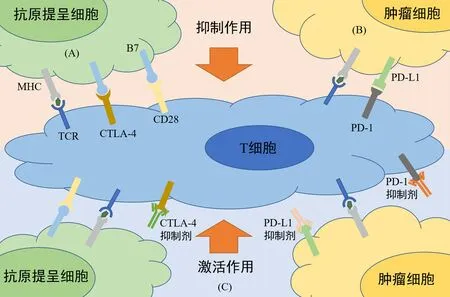
图1 免疫检查点及抑制剂作用机制
CTLA-4,也称为CD152(分化簇152),是一种共抑制蛋白受体,在T细胞未激活时位于细胞内。当T细胞被激活后,CTLA-4被转移至细胞膜表面,凭借着比CD28更高的与B7的亲和性,得以更好的和B7相结合,抑制CD28与B7的结合,从而抑制T细胞的进一步激活。因此,ipilimumab、tremelimumab这类针对CTLA-4的抗体与CTLA-4结合,导致CTLA-4无法与B7相结合,使得原本亲和性更低的CD28得以与B7相结合,进一步激活T细胞,达到抗肿瘤细胞的目的。
PD-1是CD28超家族成员,是一种重要的免疫抑制分子,主要表达于T 细胞、B 细胞、自然杀伤细胞、单核细胞和巨噬细胞。PD-L1 与PD-L2 是PD-1 的配体,PD-L1 是其主要配体,主要表达于抗原提呈细胞、间充质干细胞和骨髓源性肥大细胞。当PD-1与配体结合时,可以降低细胞凋亡的阈值,从而导致T细胞的减少。部分肿瘤细胞通过提高PD-L1表达的水平,从而抑制T 细胞的作用,达到逃避机体免疫系统的目的。nivolumab、pembrolizumab 这类针对PD-1的抗体以及atezolizumab、avelumab、durvalumab 这类针对PD-L1的抗体通过与PD-1或PD-L1相结合,从而阻断PD-1与PD-L1结合,导致T细胞功能增强,达到杀伤肿瘤细胞的目的。
2 免疫治疗相关内分泌不良反应
ICIs通过抑制免疫检查点活性,增强T细胞对肿瘤的免疫应答,从而达到抗肿瘤的目的[5]。在这个过程中虽影响除肿瘤抗原外的其他抗原,导致机体正常组织自身免疫功能出现损害,免疫耐受平衡被打破,而引起正常器官和组织的损伤,临床上称为irAEs。irAEs 会影响内分泌、皮肤、呼吸、消化、肌肉骨骼、泌尿、神经、心血管、视觉以及血液系统等各个系统[6]。其中内分泌系统相关irAEs 包括垂体炎、甲状腺功能异常、肾上腺功能不全、自身免疫型糖尿病以及甲状旁腺功能低下等[1]。发生irAEs的机制尚不明确,可以确定的是与ICIs导致的过度的免疫反应相关。当抑制剂与CTLA-4、PD-1 或PD-L1 等靶点结合后,针对肿瘤表达抗原与机体正常抗原的T细胞激活均被增强,而这种过度的自身免疫反应导致了irAEs 的发生,同时细胞因子及相关炎症反应也参与了该过程[7]。另一个重要的影响因素是遗传因素。CTLA-4 相关突变被报道与复杂的免疫失调综合征相关,而其在小鼠上的缺失会导致致死性的自身免疫反应[8]。有报道发现,CTLA-4 表达与自身免疫疾病相关,但仍需更多相关研究的证实[9]。
2.1 垂体炎
ICIs 诱导的垂体炎是其最常见的内分泌不良反应之一。免疫治疗相关垂体炎的发生与过度免疫激活相关,是一种自身免疫反应。一项研究表明,7 例发生垂体炎的接受免疫抑制剂患者以及反复注射CTLA-4 抑制剂的小鼠体内均发现了相关抗垂体抗体,同时该研究也发现小鼠体内CTLA-4相关垂体内分泌细胞也参与了补体激活过程,引起炎症反应[10]。此外,在人体正常垂体以及垂体瘤患者体内均发现了CTLA-4的表达,进一步证明了垂体炎的发生与CTLA-4 的ICIs 相关性[11]。有研究通过尸检明确了应用CTLA-4 的ICIs 治疗患者的垂体中有CT⁃LA-4 强表达,且其表达程度与垂体炎临床症状呈正相关[12]。有别于CTLA-4 抑制剂相关垂体炎,PD-1抑制剂导致的垂体炎则可能是Ig4 相关垂体炎[13]。腺垂体细胞以及垂体淋巴细胞中有PD-1的表达,而垂体瘤浸润性淋巴细胞中则有PD-L1 的表达,这可能是PD-1抑制剂引起垂体炎的病理机制[14]。
CTLA-4 和PD-1 的ICIs 所致垂体炎发病机制不同,导致了其发病率也各不相同。研究表明,接受ipilimumab 单药治疗或联合治疗时患者垂体炎的发生率较nivolumab 和pembrolizumab 更高[15]。研究显示,ipilimumab 相关垂体炎的发病率为8%[16],而另一项研究则表明ipilimumab 相关垂体炎的发病率为11%左右(1.5%~25%)[17]。PD-1抑制剂所致的垂体炎发病率更低,有研究表明为0.5%[15],另一项研究则显示CTLA-4 和PD-1 联合治疗的发病率为8%[18]。总之,ICIs引起的垂体炎常见于60岁以上的男性,男性比女性风险高2~5倍[7,19]。
垂体炎是最常见的ICIs相关不良反应,通常发生于使用ICIs后的第8~10周,最早可在第4周,最晚则发生于治疗后第19 个月[1,16,20]。患者的临床表现各异,典型症状包括头痛、恶心、全身乏力、视力改变以及低血压等,其他少见的临床表现还有精神错乱、记忆力减退、厌食、低钠血症、性功能下降、闭经以及尿崩症等[7],这些症状的发生与患者肿瘤类型无关。由于垂体炎患者的临床表现复杂,且与肿瘤进展引起的垂体炎症状相似,应与感染、肿瘤等其他原因导致的垂体炎相区别[21]。由于垂体功能异常继发改变包括继发性甲状腺功能减退、低促性腺激素性性腺功能减退和继发性肾上腺皮质功能减退,发生率分别为7.6%、7.5%和6.1%[1]。促肾上腺皮质激素(adre⁃nocorticotropic hormone,ACTH)、TSH、生长激素以及催乳素均有不同的改变[19]。垂体相关激素检测和MRI 可以帮助诊断垂体炎。当接受ICIs 治疗的患者出现上述症状时,应及时完善垂体MRI,同时评估垂体功能。如MRI 提示垂体炎但未发现垂体功能减退,仍需继续监测8 点皮质醇水平,因为垂体功能减退可能会在后续阶段出现[22]。如果患者出现口渴、多尿或多饮症时,还需要同时检查血钠、血渗透压、尿渗透压和尿比重等指标[23]。当垂体炎患者出现恶心、呕吐、电解质紊乱、低血压、意识模糊、神志不清甚至休克等症状时,则需警惕肾上腺危象,如未及时处理可能危及生命[24]。
2.2 甲状腺功能异常
ICIs 治疗中另一常见的内分泌相关不良反应是甲状腺功能异常,包括甲状腺功能亢进和甲状腺功能减退[25-26]。ICIs 患者发生甲状腺功能异常的机制仍不明确,可能由过度的免疫激活随后引起免疫或炎症反应所致[1,27]。部分研究认为ICIs相关甲状腺功能异常与Graves病不同,ICIs导致甲状腺功能亢进的患者甲状腺摄取功能下降,且抗TSH 受体阴性[28-29]。此外,在ipilimumab 和nivolumab 联合治疗的患者中发现,主要的病理学改变是甲状腺滤泡和胶质肉芽肿中出现淋巴细胞浸润,这同样显示了ICIs导致甲状腺功能亢进与Graves 病的不同[30]。另外也有研究报道了ipilimumab治疗相关的Graves病,部分患者还出现了Graves 眼病[31]。两种发病机制的不同仍需更深入的研究证明。另外,18FDG-PET中甲状腺功能异常患者的甲状腺亲和性也相应增加[32]。
在ICIs相关甲状腺功能异常中,甲状腺功能亢进的发生率低于甲状腺功能减退,且甲亢多为甲减发生前的一过性变化[25]。与垂体炎恰好相反,ICIs相关的甲状腺功能减退在女性中更为常见,而甲状腺功能亢进则在男性中更为常见[16,28,33]。在抗PD-1 或PD-L1 抗体治疗过程中发生甲状腺功能异常的风险高于抗CTLA-4 抗体治疗,前者的发生率为4%~19.5%[34],后者为0~7.4%[35-36]。而在接受ipilimumab和nivolumab 联合治疗的患者中,甲状腺功能减退和甲状腺功能亢进的发生率可达9.9%~22%[29,34]。研究发现抗PD-1 抗体治疗诱导的甲状腺功能减退的发生率为7.0%,抗PD-L1 抗体次之为3.9%,抗CT⁃LA-4 抗体最低为3.8%,而nivolumab 联合ipilimumab治疗患者甲状腺功能减退的发生率高达13.2%;抗PD-1 抗体治疗诱导的甲状腺功能亢进的发生率为3.2%,抗CTLA-4 抗体次之为1.7%,抗PD-L1 抗体最低为0.6%,nivolumab 联合ipilimumab 治疗患者甲状腺功能亢进的发生率为8.0%[37]。
ICIs 相关甲状腺功能异常也是其常见的内分泌相关不良反应之一,在pembrolizumab相关治疗中,甲状腺毒症一般发生在第3~21周[38],而另一项研究报道甲状腺功能减退可以发生于第5~9 个月[16,28]。ICIs 诱导的甲状腺功能异常患者通常无症状或仅有轻度症状,如甲状腺功能亢进者可能出现心动过速、出汗、腹泻和体质量减轻;甲状腺功能减退症的临床表现包括疲劳、便秘、发冷、皮肤干燥和体质量增加[39]。由于ICIs 诱导的甲状腺功能异常发病率高且症状不明显,建议ICIs 治疗之前、治疗后的第5 个周期以及这之后每3 个月均应对甲状腺功能进行测试。ICIs引起的Graves病则相对症状更为明显,甚至可能出现甲状腺危象[40]。ICIs 相关Graves 眼病的报道也相对较少,ipilimumab、tremelimumab 及nivolum⁃ab治疗后均有发生Graves眼病,另外有1例男性患者经nivolumab联合ipilimumab治疗6周后甲状腺功能、抗甲状腺过氧化酶抗体及TSH受体刺激性抗体均正常,仅出现甲状腺眼病样眼眶炎综合征[41-42]。
2.3 肾上腺功能不全
ICIs 引起的肾上腺功能不全大多是继发性肾上腺皮质功能不全,也有少量原发性肾上腺功能不全的报道。目前ICIs 相关肾上腺功能不全的病理机制尚不明确。有研究表明在应用ipilimumab 的晚期黑色素瘤患者中发生肾上腺功能不全,其双侧肾上腺的18FDG-PET摄取功能异常,提示肾上腺功能不全可能与双侧肾上腺肿瘤转移有关[43]。
有研究表明ICIs 引起的肾上腺功能不全的发生率为0.7%左右[37],抗CTLA-4抗体相关的原发性肾上腺功能不全的发生率为0.3%~1.5%[35,44],抗PD-1抗体也会诱发原发性肾上腺功能不全[45],Trainer 等[46]首次报道了nivolumab 诱导的原发性肾上腺衰竭。ICIs 引起的肾上腺功能不全发生时间在开始治疗后2.5~4.3个月[34,47]。
ICIs引起的肾上腺功能不全临床表现复杂,包括乏力、血容量不足、低血压、低钠血症、高钾血症、低血糖、发热、腹痛、皮肤色素沉着、体质量下降等[46]。另外,有病例报道应用pembrolizumab 治疗停药后1个月的患者出现肾上腺危象,21-羟化酶抗体和肾上腺皮质抗体阳性,最终出现肾上腺萎缩[48]。血皮质醇和ACTH 是区分原发性肾上腺皮质功能减退症和肾上腺皮质功能减退症的关键,当血皮质醇降低,ACTH 升高,考虑原发性肾上腺皮质功能减退症;若血皮质醇和ACTH均降低,符合继发性肾上腺皮质功能减退症。
2.4 自身免疫性糖尿病
ICIs 引起的自身免疫性糖尿病的发病机制目前尚不明确,有研究表明自身免疫性糖尿病的发生与遗传因素相关[49],部分患者存在易感的HLA基因型,包括DR3-DQ2、DR4-DQ8、DR4-DQ4 和DR9-DQ9等。在疾病发生过程中,PD-L1与配体PD-1和B7-1的结合被阻碍,导致T 细胞的激活失调,从而导致胰腺β 细胞被浸润破坏,最终引发自身免疫性糖尿病[50]。另外有研究发现在2型糖尿病患者中PD-1的表达下调,NK 细胞的PD-1表达水平与胰岛素水平、糖尿病病程呈正相关,单核细胞上PD-1的表达水平与体质量指数呈负相关,这提示PD-1 可能也参与2型糖尿病的发病[51]。
有研究表明ICIs 引起的自身免疫性糖尿病的发病率为1.5%,其中PD-1 抑制剂相关的发病率为1.8%,应用ipilimumab治疗的患者则未出现自身免疫性糖尿病[52]。另外有研究显示nivolumab相关的自身免疫性糖尿病发病率为0.9%,pembrolizumab 相关的自身免疫性糖尿病发病率则为0.2%[53]。PD-1 抑制剂相关自身免疫性糖尿病出现的平均时间在治疗后第8.5(2~72)周[54],也有研究表明其平均发生时间为11(1~52)周[50]。
ICIs 引起的自身免疫性糖尿病通常是以糖尿病酮症酸中毒为首发症状的1型糖尿病[34],也有少数原有2型糖尿病应用ICIs 后加重的报道[52]。通常,90%以上的1 型糖尿病会在确诊时发现糖尿病相关抗体阳性[55],然而ICIs引起的自身免疫性糖尿病报道中只有近50%的患者出现抗体阳性[56],但需进一步研究证实。总之,ICIs引起的自身免疫性糖尿病患者多以糖尿病酮症酸中毒为首发症状,C 肽水平明显减低,胰岛β 细胞功能衰竭较快,需尽早诊断治疗,必要时停止免疫治疗直到血糖得到有效控制。
2.5 甲状旁腺功能低下
ICIs引起的甲状旁腺功能减退较为少见,目前仅有少数相关的病例报道[57-58]。Win等[57]报道了第1例联合应用ipilimumab 及nivolumab 后诱发的甲状旁腺功能减退,表现为严重低钙血症和高磷血症。另有研究表明,PD-1 抑制剂与低钙血症之间具有显着性相关,其低血钙症达到严重程度(3级或更高)的比例高达13.0%,且与剂量大小相关,但未对发生机制进行深入的研究[59]。Piranavan 等[58]报道的另1 例niv⁃olumab 治疗甲状旁腺功能减退患者中,发现钙敏感受体抗体水平升高。相关ICIs 引起的甲状旁腺功能减退相关报道较少,仍需更多的病例总结和试验,临床医生在诊治过程中应注意血钙、血磷及甲状旁腺激素的改变。
3 结语
ICIs应用范围广泛,能够显著延长肿瘤患者的生存期,给许多晚期恶性肿瘤患者带来新的希望,但同时也伴发有多种ICIs相关不良反应,其中内分泌相关不良反应发病机制不明,临床表现复杂,严重者可危及生命,是ICIs 相关不良反应研究的重点,需进行更多相关机制的研究、临床数据的报道分析,从而帮助临床医生获得更好的循证医学证据,提高对相关不良反应的诊治能力。
