人参核盘菌菌核分泌液致病性及生物学特性研究
2020-10-23傅俊范尹海波周如军李自博
王 丹 ,傅俊范 ,尹海波 ,周如军 ,李自博
(1.辽宁中医药大学 药学院,辽宁 大连 116600;2.沈阳农业大学植 物保护学院,沈阳 110161)
人参(Panax ginseng C.A.Meyer)属五加科(Araliaceae)、人参属(Panax),是我国最重要的药用植物之一。由于国家明令禁止新林地开垦栽参,农田栽参已成为人参种植的主要方式。农田病原菌繁多,且人参为多年生宿根植物,导致人参根部病害呈逐年加重的趋势,已成为限制我国人参产业健康发展的主要障碍之一[1-3]。由人参核盘菌(Sclerotinia ginseng Wang et Chen)引起的人参菌核病是人参种植过程中危害最为严重的根部病害之一,主要侵染3 年以上参根[4]。发病初期,病株地上部分与健株无明显差别,发病后期,地上部分萎蔫,叶片呈红褐色或黄褐色,地下参根髓部组织腐解殆尽。人参受害后,一般发病率为10%~15%,严重时可达30%以上[5-6]。
许多产核真菌在菌核发育早期会在菌核表面形成分泌液,菌核分泌液成分复杂,在菌核生长发育和致病过程中起着重要的作用。LIANG 等[7]对核盘菌(S.Sclerotiorum)菌核分泌液中蛋白组成的结果表明,核盘菌菌核分泌液中碳水化合物代谢相关的蛋白比例最高,为45%,推测菌核分泌液参与真菌营养代谢和细胞壁的形成。PANDEY 等[8]对雪腐核盘菌(Sclerotium rolfsii)菌核分泌液中成分组成的测定结果表明,雪腐核盘菌菌核分泌液中含有多种酚酸类物质,这些物质可以有效抑制其他微生物的生长发育,从而保护自身不被其他微生物降解,可在土壤中长期存活。WANG 等[9]对人参核盘菌菌核分泌液有机酸鉴定结果表明,人参核盘菌菌核分泌液中含有大量草酸,而草酸是人参核盘菌的主要致病因子。为明确人参核盘菌菌核分泌液致病性及生物学特性,本研究测定了人参核盘菌菌丝及菌核分泌液对人参根组织的侵染特性和细胞壁降解酶活性差异,分析了培养基、碳源、氮源和pH 对人参核盘菌菌丝生长、产核及菌核分泌液形成的影响等,旨在明确人参核盘菌菌核分泌液的致病性及生物学特性,为揭示人参核盘菌菌核形成及致病机制的后续研究提供理论基础。
1 材料与方法
1.1 材料
供试3 年生活体参根购自辽宁省抚顺市清源县人参种植区。供试人参核盘菌(Sclerotinia ginseng),菌株编号GSgF-01,由沈阳农业大学植物保护学院药用植物病害研究室保藏提供。
供试 10 种培养基为:PDA 培养基、SDA 培养基、OA 培养基、MEA 培养基、MEA-peptone 培养基、CA 培养基、V8 培养基、Czapek 培养基、Richard 培养基和 OA-YE 培养基[10]。供试 20 种碳源为:蔗糖、葡萄糖、果糖、肌醇、麦芽糖、甘露醇、山梨醇、乳糖、半乳糖、甘油、木糖、海藻糖、阿拉伯糖、葡萄糖酸钠、可溶性淀粉、乌来糖、壳聚糖、鼠李糖、核糖和赤藓糖醇。供试20 种氮源为:牛肉膏、蛋白胨、酵母浸粉、丙氨酸、硝酸钠、酪氨酸、苯丙氨酸、甘氨酸、赖氨酸、脲、白氨酸、天门冬酰胺、草酸铵、磷酸铵、氯化铵、硝酸钾、甲硫氨基酸、硝酸铵、半胱氨酸和硫酸铵。供试碳源和氮源均为分析纯试剂,购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 人参核盘菌菌丝与分泌液的致病性测定 将供试人参核盘菌菌株活化,打取直径5mm 菌饼,置于带有玻璃纸的PDA 平板中央,20℃黑暗培养3d,将菌丝轻轻刮下,向收集的菌丝加适量无菌水匀浆,测其吸光度值(OD600),使菌丝悬浮液调 OD600=2,备用。
将供试菌株活化,培养方法同前,培养11d 后用20μL 一次性采血管吸取菌核表面分泌液,经0.22μm 的微孔滤膜过滤后,-20℃保存备用。
采取刺伤接种法,选取参体较为一致的供试参根,70%酒精擦拭后无菌水清洗,用无菌针刺伤处理,分别取1mL 的分泌液和菌丝悬浮液对伤口进行接种处理,于第3,5,9,15 天对人参根部拍照记录发病情况。
1.2.2 病菌粗酶液的提取及细胞壁降解酶活性测定 取1g 菌丝和1mL 分泌液,加入5mL 0.1mol·L-1Naacetate 缓冲液,菌丝处理组冰浴条件下加入适量的石英砂充分研磨,过滤后,4℃、16000g 离心20min,取上清液于-20℃保存备用。
参照王鹏程等[11]方法绘制半乳糖醛酸和葡萄糖标准曲线。
细胞壁降解酶活性测定: 在试管中加入1.5mL 的对应底物溶液,PG 酶底物为10g·L-1多聚半乳糖醛酸,PMG 酶底物为 10g·L-1果胶溶液,Cx 酶底物为 10g·L-1羧甲基纤维素钠溶液,β-葡萄糖苷酶底物为 10g·L-1水杨苷,在PG 酶和PMG 酶测定试管中加入1mL 的乙酸-乙酸钠缓冲液,将所有处理于37℃的恒温水浴5min,之后加入0.5mL 的对应粗酶液,对照为煮沸灭活的粗酶液,于37℃的恒温水浴反应1h,取出后立即加入1.5mL 的DNS 溶液,于沸水浴中加热5min,之后迅速冷却至室温,用蒸馏水稀释至25mL,在540nm 处测得吸光度值,计算酶活性,PG 酶和 PMG 酶活性按公式(1)计算,Cx 酶和 β-葡萄糖苷酶活性按公式(2)计算[12]。

式中:m 为从标准曲线查得的半乳糖醛酸质量(mg);5.14 为1 mg 半乳糖醛酸的微摩尔数;V 为菌丝过滤后酶液总体积(m L);V' 为测定时加入的样品体积(mL);t 为酶促反应时间(min);m' 为菌丝质量(g)。

式中:m 为从标准曲线查得的葡萄糖质量 (mg);5.56 为1 mg 葡萄糖的微摩尔数;V 为菌丝过滤后酶液总体积(mL);V' 为测定时加入的样品体积(mL);t 为酶促反应时间(min);m' 为菌丝质量(g)。
1.2.3 病菌生物学特性测定 将供试菌株GSgF-01 活化后,打取直径为5mm 的菌饼,放置于不同处理培养基平板中央,3 次重复,20°C 黑暗培养,3d 后测量菌落直径,11d 后测量产核数量、菌核干重、鲜重和分泌液产生量。考察10 种不同培养基对人参核盘菌生长的影响;以Czapek 培养基为基础培养基,考察供试20 种碳、氮源对人参核盘菌的影响;以PDA 培养基为基础培养基,用1mol·L-1HCL 和1 mol·L-1NaOH 调pH 值,考察不同pH 值(3,4,5,6,7,8,9,10,11,12)对人参核盘菌的影响[13]。
1.2.4 数据分析方法 试验所得数据结果采用Excel 2010 进行标准偏差分析,使用SPSS 13.0 软件进行显著性差异分析。
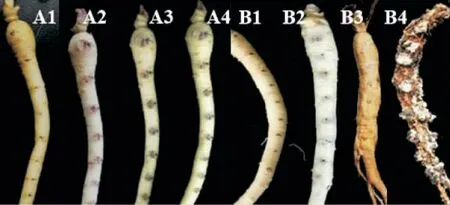
图1 人参核盘菌分泌液和菌丝悬浮液对人参的致病性Figure 1 The process of ginseng being infected by exudate and mycelial suspension
2 结果与分析
2.1 人参核盘菌菌丝与分泌液的致病性
以病菌菌丝悬浮液和分泌液分别接种人参根部的致病性测定结果表明,处理第3 天时,接种分泌液的参根部位颜色开始加深,接种菌丝悬浮液的参根部位无明显症状;第5 天时,接种分泌液的参根部位颜色继续加深,接种菌丝悬浮液的参根部位开始加深,并有菌丝形成;第9 天时,分泌液接种部位呈深褐色,病斑扩散较慢,菌丝悬浮液接种部位开始变软,病斑扩散较快;第15天时,分泌液接种部位呈黑褐色,无软化现象,菌丝悬浮液接种部位呈软腐状,根髓部逐渐腐解,仅存根皮部,表面生出黑色菌核(图1)。
2.2 人参核盘菌分泌液和菌丝中的细胞壁降解酶含量
由图2 可知,菌丝和分泌液中均含有PG 酶和Cx酶,分泌液中的PG 酶活性高于菌丝,Cx 酶活性低于菌丝,酶活性分别为 0.0098U·g-1和 0.0602U·g-1、0.0924U·g-1和0.0796U·g-1,PMG 酶只在菌丝中测得,酶活性为0.0252U·g-1,β-葡萄糖苷酶在二者中均未检测到。
2.3 人参核盘菌的生物学特性
2.3.1 不同培养基对病菌菌丝生长、菌核产生及分泌液形成的影响 由表1 可知,人参核盘菌在10 种供试培养基中均能生长,在SDA 培养基中的生长速度最快,为13.47mm·d-1,Czapek 培养基中的生长速度最慢,为4.48mm·d-1;在V8 培养基中,供试菌株产核个数最多,为267 个,但菌核鲜重和干重最小,分别为0.1353g 和0.1441g;在OA 培养基中,供试菌株产核个数最少,为51 个;在MEA 培养基中,供试菌株菌核鲜重和干重最大,分别为0.8683g 和0.6004g;在PDA 培养基中,供试菌株分泌液产生量最大,为 1.3108g;在SDA,Czapek 和Richard 培养基中,未收集到分泌液。
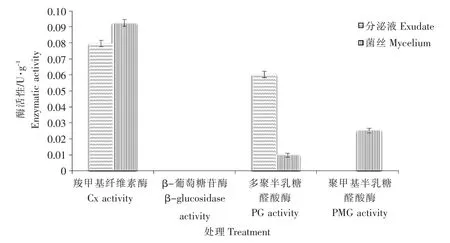
图2 人参核盘菌菌丝和分泌液中不同致病酶活性Figure 2 The enzymatic activity of mycelium and exudate of S.ginseng
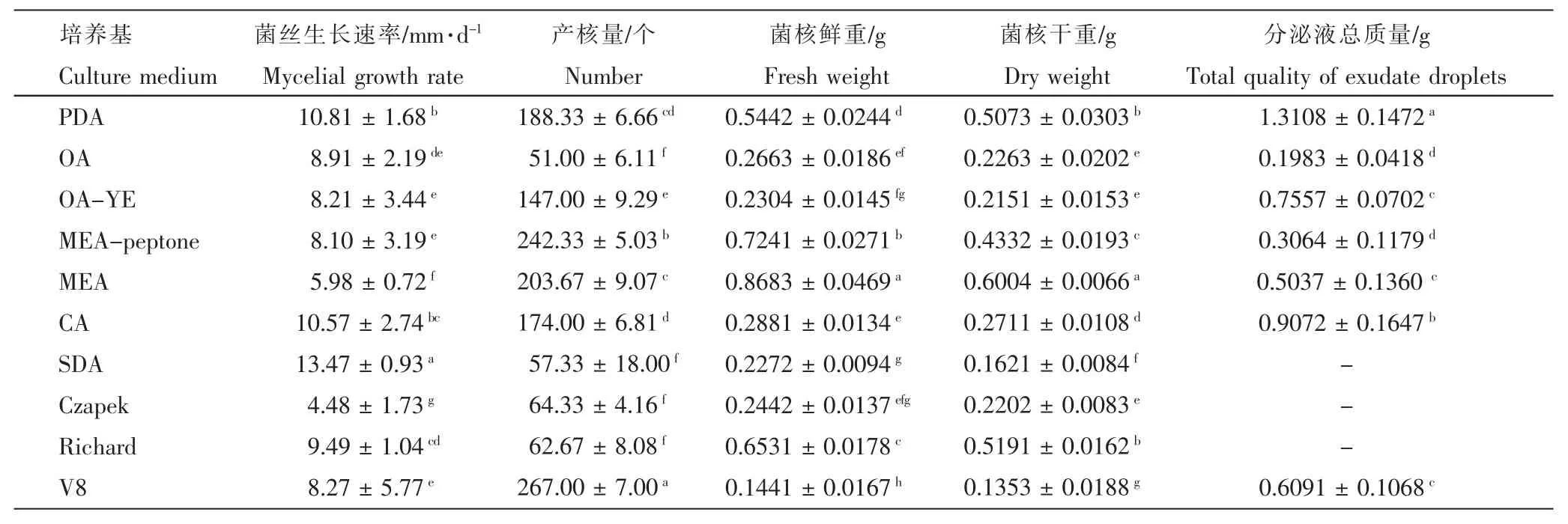
表1 不同培养基对人参核盘菌生长速率、产核及分泌液形成的影响Table 1 Mycelial growth rate, sclerotial number and the formation of exudate on different cultivation media
2.3.2 不同碳源对病菌菌丝生长、产核及分泌液形成的影响 由表2 可知,人参核盘菌在不同碳源培养基中的菌丝生长速率、产核个数、菌核干、鲜重及分泌液形成存在显著差异。以蔗糖与葡萄糖为碳源时,供试菌株菌丝生长速率最快,分别为18.12mm·d-1和17.02mm·d-1;以乌来糖为碳源时,供试菌株停止生长。以肌醇、海藻糖、阿拉伯糖、赤藓糖和壳聚糖为碳源时,供试菌株仅进行菌丝生长,不产生菌核;以甘油和半乳糖为碳源时,供试菌株产生菌核,但不形成分泌液;以葡萄糖酸钠为碳源时,菌核产量最多,为280 个。以果糖为碳源时,菌核鲜重和干重最大,分别为0.5383g 和0.2153g。以葡萄糖为碳源时,菌核分泌液产生量最大,为0.5456g。
2.3.3 不同氮源对病菌菌丝生长、菌核产生及分泌液形成的影响 由表3 可知,人参核盘菌在不同氮源培养基中的菌丝生长速率、产核个数、菌核干、鲜重及分泌液形成存在显著差异。以蛋白胨、牛肉膏和酵母浸粉为氮源时,供试菌株菌丝生长速率最快,分别为19.76,19.74,19.61mm·d-1;以甲硫氨酸、半胱氨酸、硝酸铵、氯化铵、硫酸铵、磷酸铵、草酸铵、尿素、赖氨酸为氮源时,供试菌株停止生长。以丙氨酸为氮源时,供试菌株仅进行菌丝生长,不产生菌核;以酵母浸粉为氮源时,菌核产量、菌核鲜、干重和分泌液产生量最大,分别为132 个、0.7190g、0.2812g 和 1.3253g。
2.3.4 不同pH 值对病菌菌丝生长、菌核产生及分泌液形成的影响 由表4 测定结果表明,人参核盘菌在pH值为3~10 的范围均可生长,pH 值为5 时,供试菌株菌丝生长速率、产核量、菌核鲜、干重以及分泌液产生量最大,分别为 16.37mm·d-1、267 个、0.8311g、0.6554g 和 1.5369g。
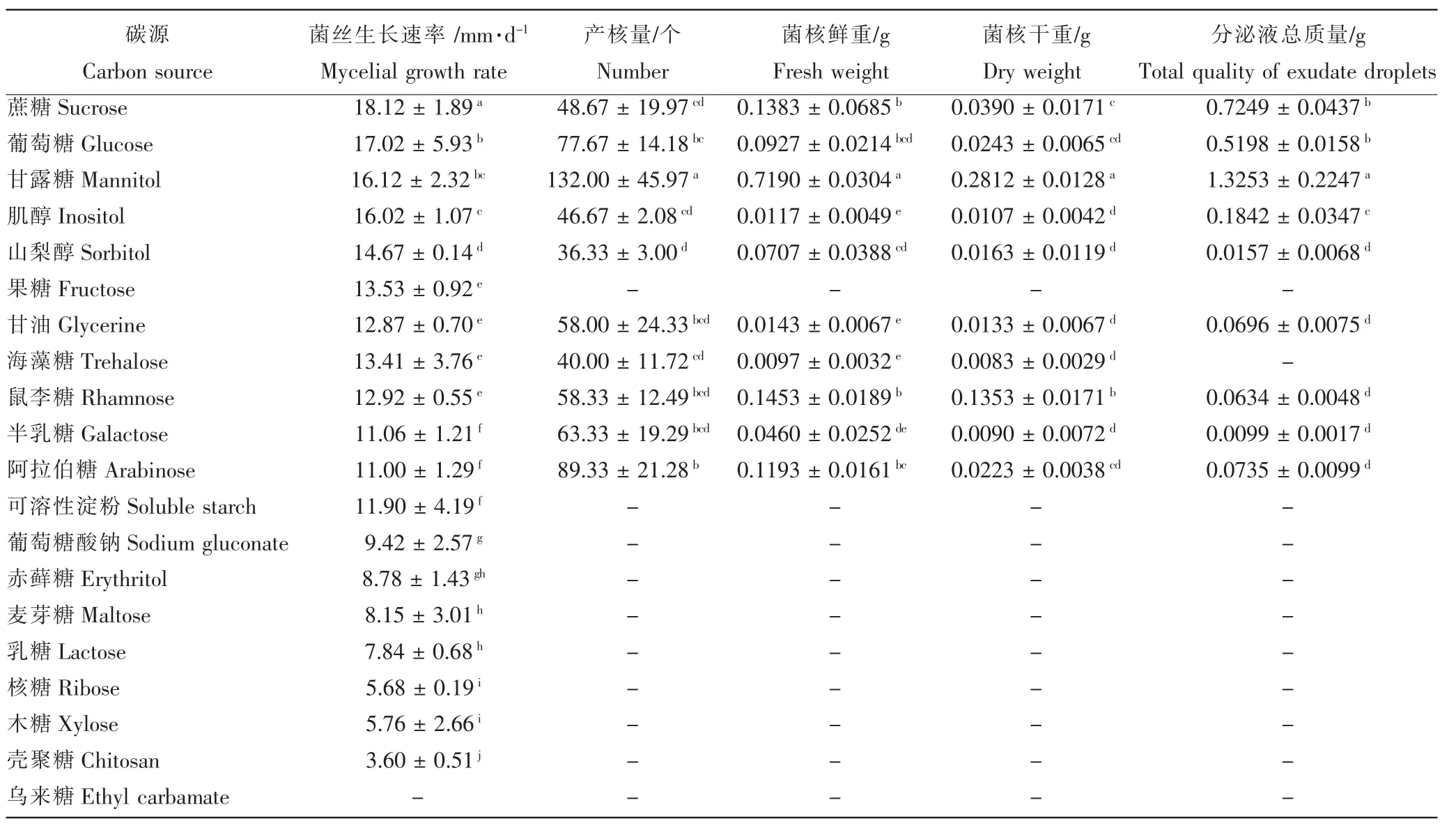
表2 不同碳源对人参核盘菌生长速率、产核及分泌液形成的影响Table 2 Mycelial growth rate, sclerotial number and the formation of exudate on different carbon sources

表3 不同氮源对人参核盘菌生长速率、产核及分泌液产生的影响Table 3 Mycelial growth rate, sclerotial number and the formation of exudate on different nitrogen sources
3 讨论与结论
人参核盘菌主要以菌核在土壤或病残体上越冬,翌年气候条件适宜时,菌核萌发出菌丝进行侵染,越冬菌核数量和气候条件是人参菌核病发生和流行的主要影响因素[14]。人参核盘菌的生长发育主要包括7 个阶段,气生菌丝的营养生长、菌丝团的初始聚集、菌丝团增大与内部加固、菌核的发育初期、菌核的固化与分泌液的析出、菌核色素沉积与表皮的形成以及菌核的成熟[15-16]。菌核分泌液的形成开始于菌丝团表面,随着菌核的进一步发育,分泌液开始大量析出,菌核老熟时,分泌液逐渐消失。菌核分泌液的形成伴随着菌核的发育,对于菌核分泌液的研究有助于进一步阐明人参核盘菌致病机制及菌核发育机制。
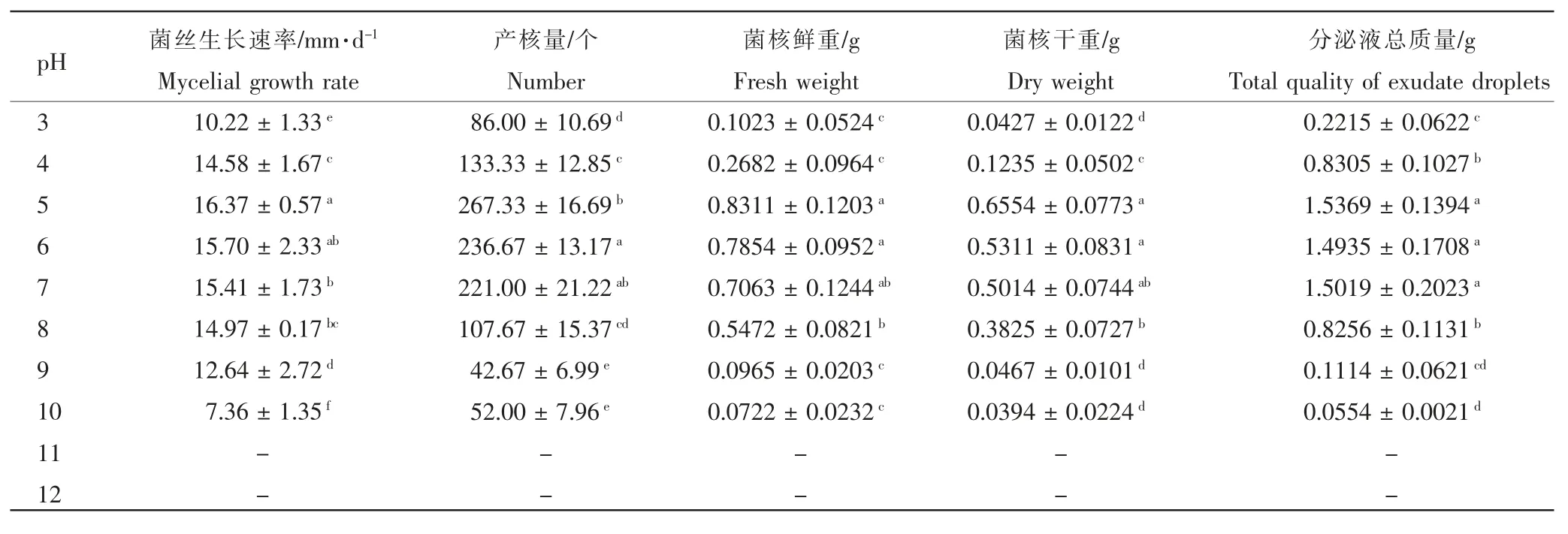
表4 不同pH 浓度对人参核盘菌生长速率、产核及分泌液产生的影响Table 4 Mycelial growth rate, sclerotial number and the formation of exudate on different pH
本试验对人参核盘菌菌核分泌液和菌丝悬浮液致病性的研究结果表明: 分泌液和菌丝都能使参根产生坏死状病斑,且接种分泌液病斑出现的时间早于菌丝,但分泌液持续侵染能力比菌丝弱。对分泌液和菌丝中的细胞壁降解酶种类及活性的分析结果表明:分泌液和菌丝中均存在PG 酶和Cx 酶,分泌液中的PG 酶活性高于菌丝,Cx 酶活性低于菌丝,PMG 酶仅在菌丝中检测到,分泌液和菌丝中均不含β-葡萄糖苷酶。细胞壁降解酶是许多植物病原真菌主要的致病因子,其主要作用为降解寄主植物中胶层,破坏纤维素,使细胞解离,组织崩溃,使侵染部位出现不同程度的软腐或腐烂[17-18]。人参核盘菌分泌液中存在PG 酶和Cx 酶,说明分泌液具有分解寄主植物细胞壁和细胞胶质结构的能力,这可能是分泌液可导致参根出现坏死斑的主要原因。在侵染的早期阶段,PG 酶是植物病原真菌最早分泌的细胞壁降解酶之一,其切割细胞壁果胶质的α-1,4 糖苷键,导致细胞壁塌陷,使其他水解酶更容易降解细胞壁[19]。人参核盘菌分泌液中PG 酶活性高于菌丝,这解释了在分泌液和菌丝接种参根时,分泌液接种坏死斑的出现早于菌丝。
碳源和氮源作为主要的能量来源、代谢底物和调节因子对真菌的生长发育过程具有十分重要的作用,真菌中存在复杂的碳源和氮源感应系统[20-21]。本试验分析了不同培养基、碳源、氮源和pH 值对人参核盘菌菌丝生长、产核及分泌液形成的影响,结果表明:人参核盘菌在不同培养条件下的菌丝生长速率、产核个数、菌核干、鲜重及分泌液形成存在显著差异。供试菌株在SDA 培养基中生长速率最快,但产核数量较少,且不产生分泌液;在MEA 和MEA-peptone 培养基中产核数量最多,但分泌液产生较少;以乌来糖为碳源时,供试菌株停止生长,以肌醇、海藻糖、阿拉伯糖、赤藓糖和壳聚糖为碳源时,供试菌株仅进行菌丝生长;以甘油和半乳糖为碳源时,供试菌株产生菌核,但不形成分泌液。由此可以推测人参核盘菌菌丝生长、菌核发育及菌核分泌液形成虽然是相互交织的连续过程,菌核是菌丝聚集的一种体现,但三者间具有相对独立发育过程和营养调控。本试验筛选出的不同培养基和营养成分可促进人参核盘菌的不同发育进程,用于人参核盘菌菌核发育机制的研究。
在人参种植过程中,随着栽参年限的增加土壤pH 值会逐渐降低[22-23]。此外,农药化肥的施用、人参自身的化感作用以及根系分泌物等均可使得老参地土壤pH 值下降,引起土壤酸化。而土壤酸化会造成人参生长所需营养元素的缺失,增加土壤溶液中铝离子的含量,严重阻碍人参的正常生长与发育,降低人参的品质与产量[24-25]。本试验对不同pH 值对人参核盘菌菌丝生长、产核及分泌液形成影响的研究结果表明:酸性条件下,人参核盘菌菌丝生长、产核个数、菌核鲜、干重以及分泌液形成量更多,更有利于人参菌核病的发生和流行。所以在人参菌核病的防控措施中,应根据病原菌的生物学特性,结合土壤改良等多种农业防治措施,以实现绿色有效防控的目标。
