甜瓜ADF7基因的克隆与生物信息学分析
2020-10-23吕艳玲张家旺张丽丽刘石磊闫大波
吕艳玲 ,何 明 ,张家旺 ,张丽丽 ,刘石磊 ,闫大波 ,汪 澈
(1.辽宁省农业科学院 蔬菜研究所,沈阳 110161;2.沈阳农业大学 生物科学技术学院,沈阳 110161)
肌动蛋白作为一种古老的蛋白质广泛存在于真核细胞中,有单体肌动蛋白(globularactin,G-actin)和丝状肌动蛋白(filanentous actin,F-actin)两种形式,是构成微丝骨架的主要成分[1]。细胞中的微丝骨架处于高度动态之中,这种动态特征依赖肌动蛋白结合蛋白 (actin binding proteins,ABPs),ABPs 通过与 G-actin 或 F-actin 结合,调节两者间的动态平衡,进一步去调控微丝骨架的组织和功能。在植物细胞中,微丝骨架在面对细胞自身生命活动的需要以及外界环境胁迫、病原微生物的入侵时,通过具有特定功能[2-3]的不同ABPs 对其精准快速的有序调控,传递信息,促使细胞作出一系列快速有效的反应[4-7]。其中,肌动蛋白解聚因子(actin depolymerizing factor,ADF)家族蛋白作为一种肌动蛋白结合蛋白,被认为是肌动蛋白变化的主要调控因子[8-9]。
ADF 是所有真核生物中都存在的一类重要的ABPs[10],含量丰富且高度保守。ADFs 分子量为13~19kDa,能与G-actin 和F-actin 结合,优先结合F-actin 上以ADP-G-actin 为主的靠近负端的区域,能解聚、剪切F-actin[9,11],促使单体actin 从F-actin 负端解离[11],含有保守的核定位信号序列,可以与actin 一起进入细胞核[12],调节基因表达和染色体重塑等[13]。ADF 是由多基因家族编码的[9],植物中ADF 家族成员要远多于动物中的。ADF 的同源基因具有不同的表达模式[14]。拟南芥ADF 家族的表达研究较为清楚[15],其中,ADF1-4 属于Subclass I,在除了花粉外的其他组织中强烈表达;Subclass II 包含 IIa(ADF7 和 ADF10)及 IIb(ADF8 和 ADF11),ADF7 和 ADF10 主要在成熟花粉和花粉管中表达,而ADF8 和ADF11 主要在根和根毛中表达;ADF5 和ADF9 属Subclass III,主要在愈伤组织、幼叶和分生组织等快速生长细胞中表达,在成熟营养组织中微弱表达;Subclass IV 只含有ADF6,表达于所有组织中。不同的ADF 亚型具有功能性差异。ADFs 在植物的生长和发育中发挥着重要作用,参与多个生物与非生物应答反应[16-17]。AtADF1 的缺失和过表达都会导致植物生长、发育和形态方面发生缺陷[18]。AtADF2-RNAi 植株生长发育受到抑制,使线虫的营养来源细胞不能正常生长而抑制线虫增殖[19]。ZmADF3 促进根毛的伸长[20]。AtADF4 与植株的生长发育有关[21];能在ABA 和干旱诱导气孔关闭过程中起作用[22];能提高拟南芥对细菌DC3000AvrPphB 的抗病性[6];拟南芥adf4 突变体对高氏白粉菌(G.orontii)的抗性显著增加,而敲低第一亚家族的4 个ADF (ADF1-4Ri) 后,抗性进一步增强,且均未显示肉眼可见的病变和植物发育缺陷[23]。AtADF5 在低温下表达量显著增加[24];其功能缺失会造成花粉萌发延迟、花粉管生长和管内胞质环流速率变慢[25]。水稻OsADF3、ZmADF5 转基因拟南芥抗旱性提高[26-27]。小麦TaADF4 和TaADF7 在抵抗条锈菌侵染过程中发挥了积极的作用[14,28]。
甜瓜(Cucumis melo L.)在全世界广泛栽培,其生产规模居世界十大水果前列,具有很高的经济价值。甜瓜一代杂交种的生产主要通过人工杂交授粉获得,需要对母本进行人工去雄,费时费工,还增加了种子生产成本。花粉发育和花粉管生长受多种因素调节,微丝骨架参与其中并协同调控。微丝骨架为细胞内物质运输和花粉管生长提供主要动力系统[25],抑制微丝组织和动态,会使花粉管极性生长、转运囊泡在倒锥形区域的聚集及胞质环流会受到抑制。植物ADF7 属于典型的ADF,其解聚能力要弱于ADF1[29-30],可能已经进化以满足花粉特定要求,其介导的剪切调节了纵向肌动蛋白索的周转以促进花粉管尖端增长。GhADF7 在拟南芥中过表达产生花粉败育表型,花粉管生长减慢[31]。AtADF7 通过调节拟南芥花粉管中的微丝骨架来影响花粉管的极性生长,其缺失突变体adf7 中花粉管生长受到显著抑制[12]。基于此,本研究对甜瓜的一个主要在花中表达的ADF 基因进行了克隆,并分析了该基因的分子特征以及在不同组织中的表达情况,以期为甜瓜ADF 基因的功能研究奠定基础,为甜瓜杂交育种提供新材料、新途径。
1 材料与方法
1.1 材料
供试薄皮甜瓜 (Cucumis melo var.makuwa Makino) 材料为辽宁省农业科学院蔬菜所培育的高代自交系LT1802。取叶片组织作为克隆CmADF7 基因材料;取根、茎、叶、雄花和雌花等组织作为CmADF7 基因组织特异性表达分析的材料,所有材料于液氮中速冻,保存于-80℃冰箱。
Easy Pure Plant RNA Kit 植物总RNA 提取试剂盒 (北京全式金生物技术有限公司),TIANScriptcDNA 第一链合成试剂盒、RealMasterMix (SYBR Green) 均购自天根,RNA 固相清除剂购自索莱宝。qPCR 试剂、DNA Markers 购自大连宝生物公司,克隆载体pGM-T、2xTaq PCR Master Mix 聚合酶购自北京天根公司。Escherichia coli DH5a 为本课题组保存,引物合成和测序均委托上海生工生物工程技术服务有限公司完成。
1.2 方法
将保存的所有材料于液氮中充分研磨后,按Easy Pure Plant RNA Kit 植物总RNA 提取试剂盒步骤提取总RNA,使用TIANScriptcDNA 第一链合成试剂盒按步骤反转录合成cDNA 的第一条链。
1.2.1 CmADF7 基因的分离 从拟南芥信息资源网站TAIR(https://www.arabidopsis.org/)获得拟南芥ADF7 基因(Sequence ID:AT4G 25590)序列,在甜瓜基因组数据库(http://melonomics.net)中进行比对,得到甜瓜ADF7 基因的核苷酸全长序列和ORF 序列,利用Primer Premier 5.0 软件设计特异PCR 引物(F:5'TCTAGAACCCATCTTTC TCCTCCT TTCATAC 3';R:5'GGTACCAAAAGCTCGAGCTTTGATTATGTC 3')。PCR 扩增体系(25μL):2×Taq Mix为 12.5μL,引物各 1 μL,模板 cDNA1μL,ddH2O 9.5μL。扩增条件:95℃ 预变性 5 min;95℃变性 30 s,58℃ 退火30 s,72℃延伸40 s,34 个循环;72℃延伸10 min。PCR 产物回收与pGM-T 载体进行连接,连接产物转化大肠杆菌DH5α 感受态细胞,鉴定为阳性的克隆送上海生工生物科技公司测序。
1.2.2 生物信息学分析 利用DNAMAN(ver.6.0)软件寻找阅读框,并完成CmADF7 基因DNA 序列的翻译;在NCBI 网站用 blastx 比对同源序列,利用 ClustalX 2.1、ESpript3.0 (http://espript.ibcp.fr/ESPript/cgi-bin/ESPr ipt.cgi)进行多序列比对;采用MEGA6 邻接法,1000 次重复,以默认参数构建系统发育进化树;采用GSD 2.0(http://gsds.cbi.pku.edu.cn/)软件分析内含子、外显子;利用在线软件ProtParam(http://web.expasy.org/prot param/)预测CmADF7 蛋白的氨基酸数量、分子质量、理论等电点和亲水指数等理化性质;利用SMART(http://smart.emblheidelberg.de/) 分析保守结构域;利用WoLF SPORT (https://wolfpsort.seq.cbrc.jp/) 进行亚细胞定位分析;利用ProtScale (http://web.expasy.org/protscale/)、SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/) 和 TMHMM Server V.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分别在线预测蛋白亲疏水、信号肽和跨膜域;利用SWISSMODEI (http://swissmo del.expasy.org/)在线预测蛋白三级结构;应用PlantCARE(http://bioin formatics.psb.ugent.be/webtools/plantcare/html/)在线预测启动子上可能存在的顺式调控元件。
1.2.3 qRT-PCR 分析 采用实时荧光定量PCR 进行CmADF7 基因表达模式分析。根据CmADF7 基因的cDNA 序列,设计 qRT-PCR 引物 (F:5-ACCCATCTTTCTCCTCCTTT CAT-3;R:5-CTCTTCAGGGCTTCCAAG TTTCT-3),其中 PCR 产物长度 191 bp。选用 18srRNA (F:5-AAACGGCTACCACATCCA-3;R:5-CACCAG ACTTGCCCTCCA-3)作为内参进行qRT-PCR 分析,以各组织cDNA 为模板进行扩增。qRT-PCR 反应条件:95℃预变性30s;95℃变性5s,58℃退火30s,72℃延伸s,共40 个循环。数据整理去除Cq 值相差0.5 以上的数据后计算平均值,分析采用2-ΔΔT法计算相对表达量。
2 结果与分析
2.1 CmADF7 的克隆及基因结构的分析
以甜瓜幼苗叶片组织提取的总RNA 反转录的cDNA 为模板,用CmADF7 基因CDS 序列引物CmADF7-F/CmADF7-R 进行PCR 扩增,扩增产物经1%琼脂糖凝胶电泳检测(图1)。克隆片段测序结果表明,CmADF7 基因ORF 长度为414 bp,编码137 个氨基酸(图2)。基因结构分析显示,CmADF7 包含3 个外显子,大小分别为3,260,151bp,其中第 1 位外显子为起始密码子 ATG;2 个内含子,大小分别为 562,420bp(图3)。

图1 CmADF7 基因的PCR 扩增产物Figure 1 The PCR amplified fragment of CmADF7 gene

图2 CmADF7 基因编码区序列及推测的氨基酸序列Figure 2 CmADF7 gene coding sequence and predicted amino acid sequence
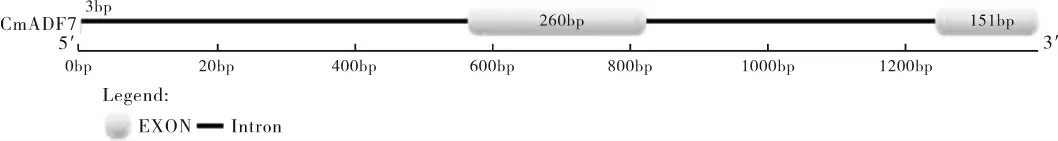
图3 CmADF7 的外显子和内含子Figure 3 Exons and introns of CmADF7
2.2 推导的氨基酸序列比对与进化分析
将甜瓜ADF7 与拟南芥ADF 基因家族成员及黄瓜、西瓜、中国南瓜、印度南瓜、西葫芦、玉米、鹰嘴豆、棉花等9 个物种来源的ADF 氨基酸序列进行多序列比对,同源性比较分析发现,与同属葫芦科的西瓜、黄瓜的同源性最高,达到99.27%和98.54%,与拟南芥的ADF7 同源性为88.32%(图4)。系统进化树分析显示,与拟南芥中的AtADF7 聚在一起(图5),属于第2 亚家族的IIa,以上表明ADF 基因在长期物种进化过程中保持了较高的保守性。
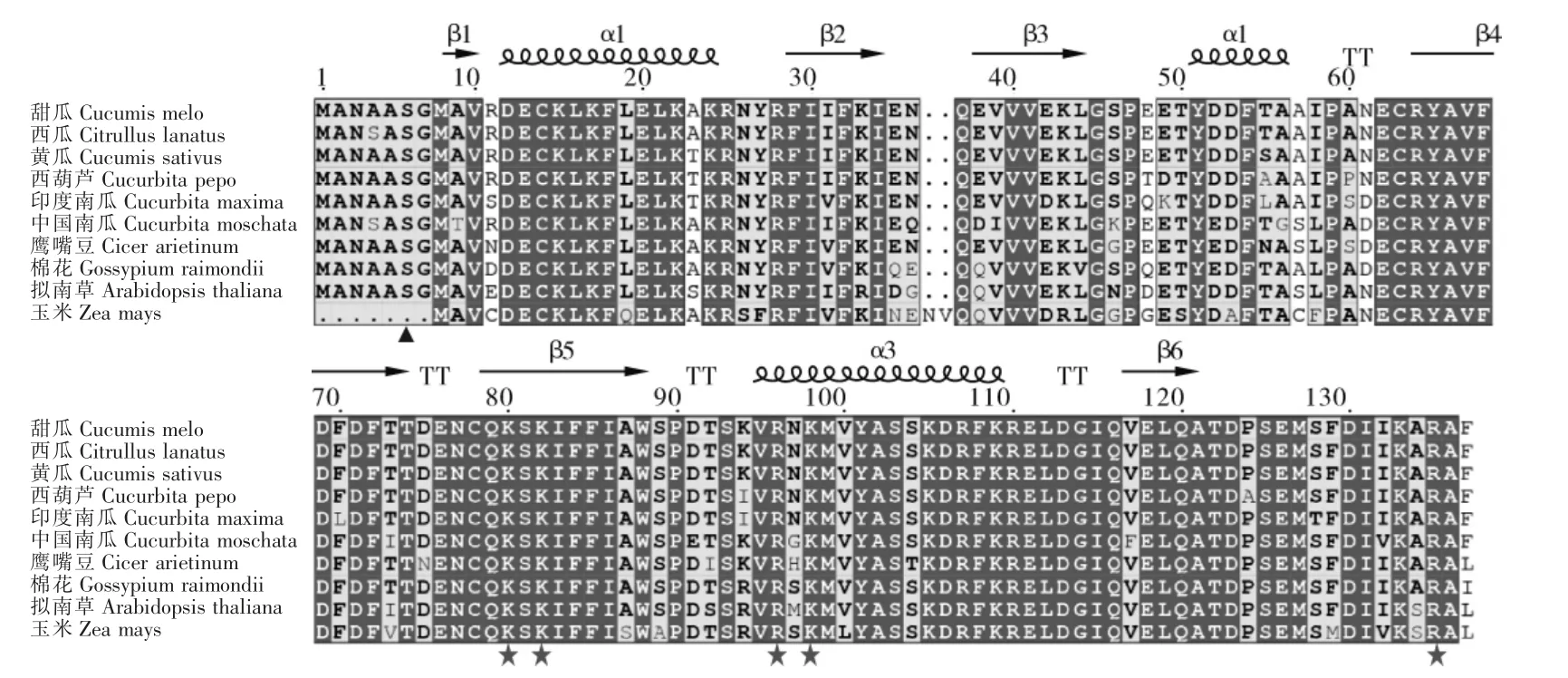
图4 CmADF7 蛋白序列与其他植物ADF 蛋白序列比对Figure 4 Sequence alignment of deduced CmADF7 and other plant ADF proteins

图5 CmADF7 与其他9 个物种的ADF 蛋白的进化树Figure 5 Phylogenetic tree of CmADF7 and ADF proteins from other nine species
2.3 CmADF7 基因编码蛋白序列预测与结构分析
2.3.1 蛋白质理化特性 通过ProtParam 预测蛋白质理化性质:CmADF7 基因编码的137 个氨基酸,理论分子量15.82102 kD,等电点5.32,蛋白原子组成C707H1097N185O213S7。在CmADF7 蛋白的氨基酸组成中,有23个是负电荷氨基酸(Asp+Glu),21 个是正电荷氨基酸(Arg+Lys)。该蛋白中富含丙氨酸(A)10.2%,谷氨酸(E)8.8%,天冬氨酸(D)8.0%,赖氨酸(K)9.5%,苯丙氨酸(F)8.8%。进一步分析氨基酸序列亲水性发现,85 位的苯丙氨酸亲水性最强 (1.111),而107 位的精氨酸疏水性最强(-2.511),整个蛋白的氨基酸序列疏水性氨基酸多于亲水性氨基酸(图6)。说明CmADF7 蛋白是疏水性蛋白。蛋白信号肽预测显示CmADF7 蛋白不具有典型的信号肽。亚细胞定位发现CmADF7 蛋白主要定位在细胞质中(表1)。
2.3.2 蛋白质三级结构预测 以拟南芥ADF1 的晶体结构(PDB ID code 1F7S) 作为建模模板,通过SWISSMODEL 在线预测CmADF7 的三级结构。结果显示中间含有保守的 5 个 β 折叠,前 4 个 β 折叠反平行,而第 4,5β 折叠平行,3 个 α 螺旋围绕着中心 5 个 β 折叠(图7)。
2.3.3 蛋白质的跨膜结构及保守结构域分析 使用TMpred 进行跨膜结构分析,发现ADF7 不属于跨膜蛋白,利用SMART 对蛋白质结构域进行分析,结果显示甜瓜ADF7 具有高度保守的ADF-H 结构域,其氨基酸序列为 12~137。
2.4 CmADF7 基因组织表达分析
以18srRNA 为内参基因,以甜瓜的根、茎、叶、雌花、雄花等部位组织的表达情况进行qRT-PCR 分析(图8)。结果表明,CmADF7 基因在根、茎、叶中虽有表达,但表达量很低,主要在花中表达,说明该基因表达具有组织特异性。
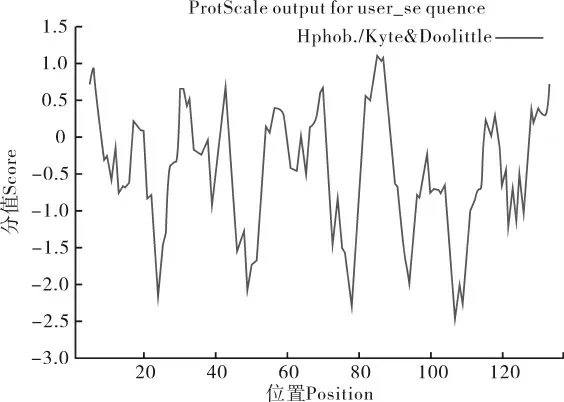
图6 CmADF7 氨基酸序列亲水性预测Figure6 Hydrophilicprodiction of amino acid sequences of CmADF7

表1 CmADF7 蛋白亚细胞定位预测Table 1 Subcellular location of CmADF7 protein

图7 CmADF7 蛋白三级结构Figure 7 Tertiary structure of CmADF7 protein in melon

图8 CmADF7 基因组织表达分析Figure 8 Expression of CmADF7 gene in organs
2.5 CmADF7 启动子的生物信息学分析
选取CmADF7 基因ATG 上游2000 bp 长的启动子序列,利用PlantCARE 在线预测其上可能存在的顺式调控元件 (表2)。经PlantCARE 分析发现主要包括下面几类顺式作用调节元件: 启动子核心元件TATA 框和CAAT 框;参与光响应调节的顺式作用元件 G-box、G-box、Box 4、AT1-motif、GATA-motif、I-box、TCT-motif、AAAC-motif 和GT1-motif;低温响应元件LTR,防御与胁迫响应元件TC-rich repeats,对于厌氧感应至关重要的ARE 元件;植物激素响应元件参与脱落酸、水杨酸响应的顺式作用元件ABRE、TCA-element,赤霉素响应元件GARE-motif 和P-box 及参与光响应的MYB 结合位点MRE。
3 讨论与结论
被子植物的ADF 基因结构很保守,甜瓜ADF 基因也一样主要包含3 个外显子和2 个内含子,其中第1 个外显子为起始密码子ATG,而紧随其后的是一个较长的内含子,有研究报道PhADF1 的这个长内含子能增强它的表达[32]。通过序列比对可看出甜瓜ADF 基因与其他物种的序列具有高度的相似性,与拟南芥ADF7 同源性达到88.32%,且与之聚在一起,另外主要表达于花中,因此命名为CmADF7。CmADF7 蛋白所含的保守结构域和三级结构也与文献报道的高度相似,说明ADF 蛋白在进化过程中高度保守。不同物种ADFs 的功能位点非常保守,在CmADF7 的N 端第6 位(植物)同样存在一个非常保守的丝氨酸(图4),拟南芥ADF1 在这个位点的突变体(AtADF1S6D)结合G-actin 和F-actin 的能力减弱。ADF 活性受磷酸化和去磷酸化调节,磷酸化的ADFs 失去结合和剪切F-actin 的活性[29];拟南芥AtCDPK6 能通过磷酸化AtADF1 的第6 位丝氨酸抑制ADF1的活性来调节微丝成束[16]。此外,在CmADF7 上还存在一些保守的与G-actin 和F-actin 结合非常关键的氨基酸(图4),这些带正电荷的K 和R 组成一个保守结构面[33-34],通过它,磷脂酰肌醇4,5-二磷酸(PIP2)与微丝竞争结合ADF/cofilin,抑制ADF/cofilin 与微丝的结合,进而调节微丝[35-36],PIP2 与玉米ZmADF3 的结合会抑制其解聚微丝的能力[37]。启动子元件分析结果表明,CmADF7 基因的启动子序列具有典型的启动子特征,CmADF7可能参与甜瓜生长发育过程中光信号响应、低温、胁迫应答及激素调节。
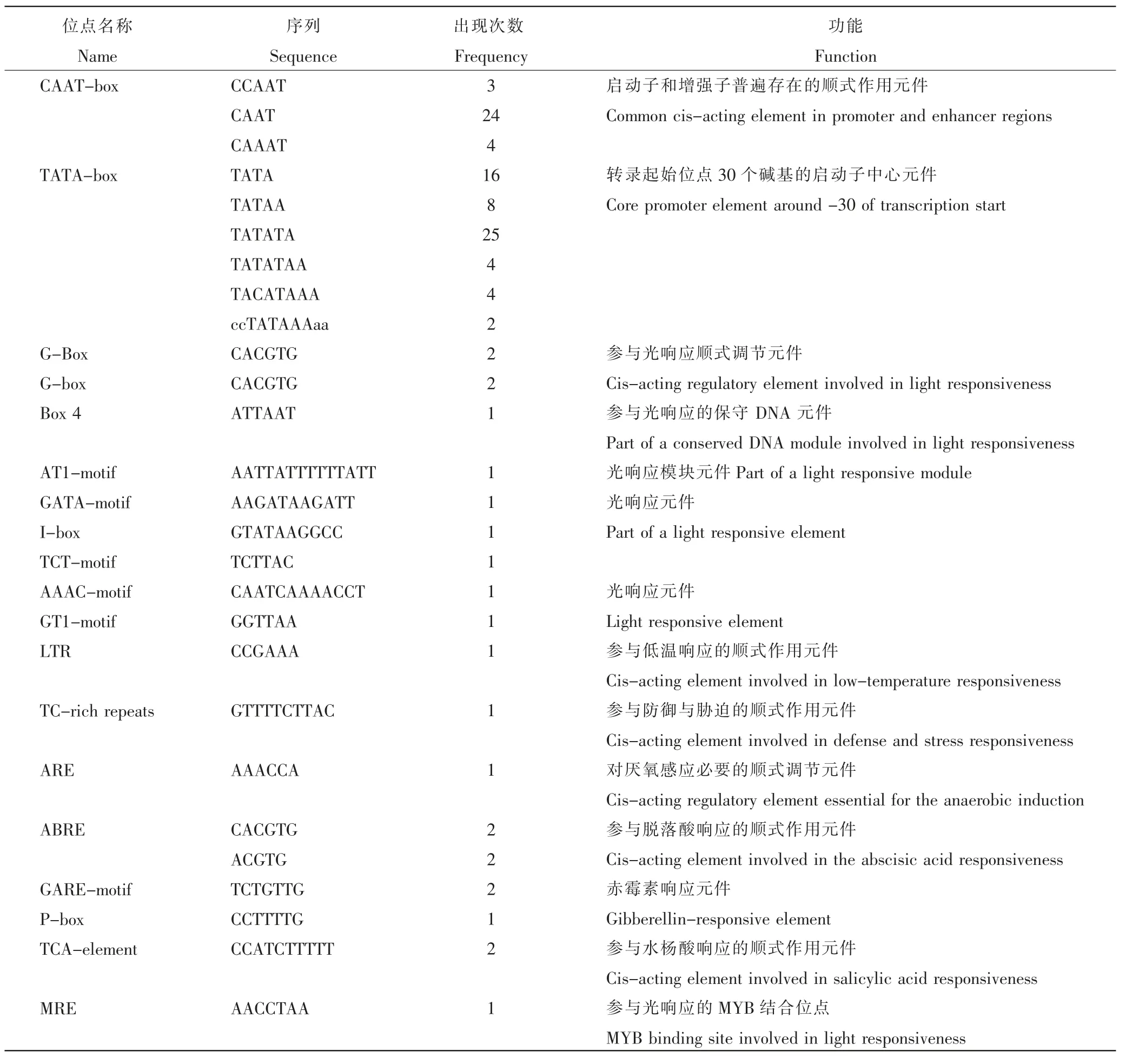
表2 CmADF7 基因启动子序列顺式作用元件Table 2 The cis-acting elements in promoter sequence of CmADF7
ADFs 在植物生长、发育及应对生物与非生物刺激中发挥着重要作用,然而,在甜瓜中对ADF 家族基因的研究未见任何报道,本研究对甜瓜的一个ADF 基因进行克隆,并分析了该基因的分子特征、蛋白结构、组织表达情况及潜在功能,将为进一步研究CmADF7 蛋白功能和发掘其他CmADFs 奠定基础。
