同时检测猪血浆中芬苯达唑、奥芬达唑、芬苯达唑砜和伊维菌素UPLC-MS/MS方法的建立
2020-10-23王宏磊刘义明陈孝杰张志博华伟毅蒋玲玉李秀波
王宏磊,刘义明,徐 飞,陈孝杰,张志博,华伟毅,蒋玲玉,李秀波
(中国农业科学院饲料研究所 国家饲料药物基准实验室,北京 海淀 100081)
动物寄生虫病是危害养殖业发展的一种重大疾病,能够使患病动物表现为生产缓慢、抵抗力低下,严重时致动物死亡,给养殖业带来严重的经济损失。传统的动物抗寄生虫药毒性大、残留高、效力低,在动物养殖业的使用过程中受到了一定的限制[1-2]。芬苯达唑是人工合成的芳香杂环化合物,属于苯并咪唑类药物。奥吩达唑和芬苯达唑砜是芬苯达唑在动物体内的主要代谢物[3]。芬苯达唑的化学名称为苯硫咪胺甲酯,为白色或类白色粉末,无臭,无味,能溶解于冰醋酸、二甲基亚砜,微溶于甲醇,不溶于水[4]。其驱虫谱广泛、毒性小、安全范围大,是国内首选的动物驱虫药[5]。伊维菌素是阿维菌素类药物的一种,由链霉菌发酵产生的一种大环内酯类抗生素驱虫药[6],为白色结晶粉末、无味,能溶于甲醇、乙腈、丙酮,几乎不溶于水,微有引湿性。其作用机理是干扰寄生虫的神经活动,导致寄生虫出现麻痹死亡[7-8],抗虫谱广、高效、安全[9-10]。芬苯达唑和伊维菌素主要用于猪、马、牛、羊、犬、猫、野生动物等的驱虫。二者联合用药,扩大了驱虫谱,提高了一次性驱虫效果,减轻了人们多次给药的麻烦,也减轻了多次给药对动物机体的应激刺激,并且两者不同的杀虫机制使其具有协同作用,降低耐药虫株的产生。目前没有同时测定血浆中芬苯达唑、奥芬达唑、芬苯达唑砜和伊维菌素的方法,本文建立了同时测定猪血浆中芬苯达唑、奥芬达唑、芬苯达唑砜和伊维菌素的超高效液相色谱质谱联用仪(UPLC-MS/MS)方法,该方法操作简单、稳定性好,回收率高,定量限低,抗干扰能力强,适用于血浆中这4种药物的同时检测,为血浆中芬苯达唑、奥芬达唑、芬苯达唑砜和伊维菌素的药物代动力学研究提供检测方法。
1 材料与方法
1.1 仪器 超高效液相色谱仪(ACQUITY UPLC,美国 WATERS公司),质谱仪 (Xevo TQ-S Mass Detector 美国 WATERS公司),CPA4202S电子天平(德国 Sartorius公司),N-EVAP112氮气浓缩仪(美国 Organomation公司),Biofuge stratos低温离心机(美国 Thermo Fishers公司),Reference移液枪(美国 Eppendorf公司),KQ-30B0DE数控超声波清洗器(中国 舒美公司),N-EVAP-24超纯水系统(德国 Membrapure公司),G560E涡动议(美国 Scientific industry公司)。
1.2 试剂 芬苯达唑标准品(中国兽医药品监察所,批号:H0441108,含量:100.0%),奥芬达唑标准品(德国Dr.Ehrenstorfer公司,批号:112511,含量:98.0%),芬苯达唑砜标准品(加拿大多伦多研究化学公司,批号:#1-EQJ-10-1,含量:100%),伊维菌素标准品(中国兽医药品监察所,批号:K0191406,含量:91.0%)。甲醇、乙腈、甲酸铵为质谱纯,均购自美国Fisher公司。固相萃取小柱:Bond Elut C18 500 mg/6 mL,购自美国Agilent公司。0.22 μm针筒式微孔滤膜,购自美国WATERS公司。2 mL医用注射器,购自中国康寿公司。
1.3 方法
1.3.1 色谱及质谱条件
1.3.1.1 色谱条件 色谱柱:Waters Acquity UPLC BEH C18(50 mm×2.1 mm,1.7 μm),柱温35 ℃,流动相A:5 mmol/L甲酸铵溶液,流动相B:甲醇,流速:0.3 mL/min,进样体积2 mL。梯度洗脱见表1。
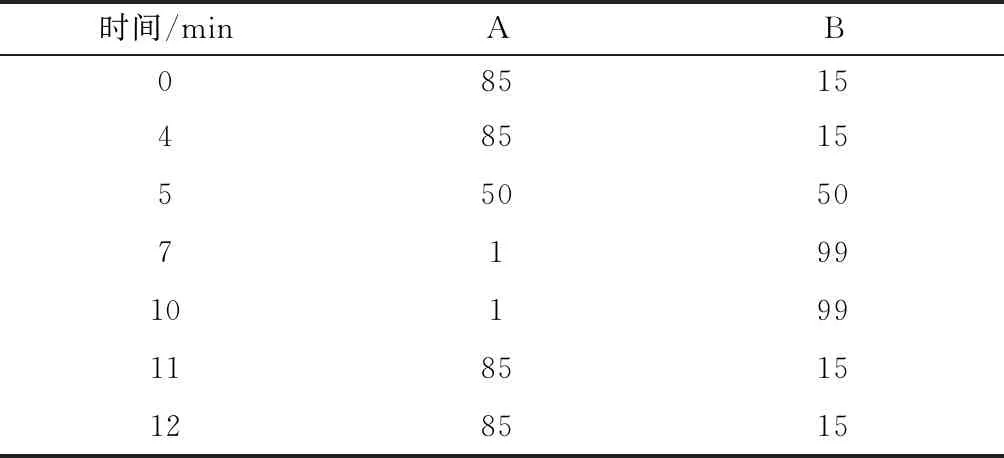
表1 梯度洗脱条件Table 1 Gradient elution condition (%)
1.3.1.2 质谱条件 电喷雾离子源(ESI),正离子模式,电喷雾毛细管电压和锥孔电压分别为3.2 KV、30 V雾化温度为800 ℃,去溶剂气流速和锥孔反吹气流量分别为500 L/Hr、150 L/Hr,二级碰撞气为氩气,检测方式为多反应监测(MRM)。芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的母离子、子离子参数如表2所示。
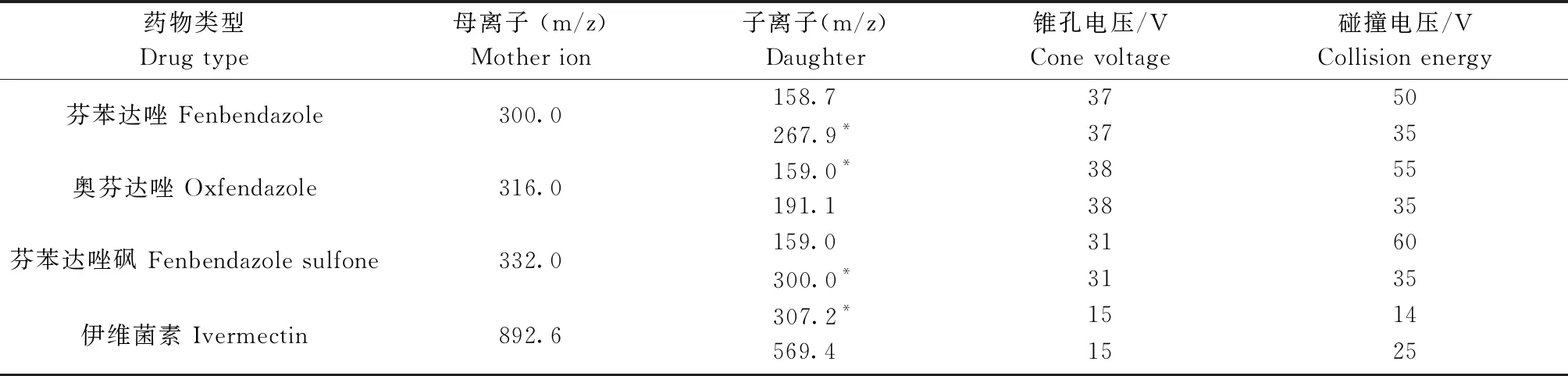
表2 芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的质谱参数Table 2 Mass spectrum parameters of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin
1.3.2 储备液的配制 芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素储备液的配置:分别精密称取芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素标准品50.00 mg、51.02 mg、50.00 mg、54.95 mg,然后加入到50 mL的容量瓶中。先向装有芬苯达唑、奥芬达唑、芬苯达唑砜的50 mL的容量瓶中加入10 mL的冰醋酸,然后涡旋1 min、超声10 min,使其完全溶解,最后加入甲醇定容至50 mL。向装有伊维菌素的容量瓶中直接加入甲醇定容至50 mL,然后涡旋1 min、超声10 min。得到浓度为1 000 μg/L的4种标准储备液,将标准储备液放置在-20 ℃的冰箱中备用。
1.3.3 样品前处理
1.3.3.1 样品提取 取1 mL血浆于10 mL的离心管中,加入2 mL乙腈,涡动1 min,在5 000 r/min、 10 ℃的条件下离心10 min,将提取液转移到50 mL的离心管中。再向残渣中加入1 mL的乙腈,按照上述条件进行2次离心,将提取液与第1次的合并,然后向合并的提取液中加入30 mL的水。
1.3.3.2 样品的净化 将SPE小柱固定在固相萃取真空装置上,用5 mL的乙腈活化小柱,5 mL乙腈-水-三乙胺(V∶V∶V=40∶60∶0.1)平衡小柱,将上一步得到的提取液全部过柱。在提取液过柱的过程中,调节真空泵的压力,使液体1滴/s匀速流下。最后用5 mL的甲醇-乙腈(V∶V=1∶1)进行洗脱,收集洗脱液于10 mL的离心管中。在40 ℃水域下用氮气吹干。用1 mL 0.1%甲酸甲醇溶液复溶,过0.22 μm针筒式微孔滤膜,待上机检测。
1.3.4 检测限和定量限 用处理过的空白血浆提取液作为稀释液,配置一系列不同浓度的芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素混合基质添加液,过0.22 μm针筒式微孔滤膜,然后上机检测。以信噪比S/N≥3的最小浓度作为检测限,以信噪比S/N≥10的最小浓度作为定量限。
1.3.5 准确度和精密度 准确度:将一定浓度的芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素混合标准溶液添加到空白血浆中,配成高、中、低3个浓度的样品,每个浓度5个平行,计算回收率,衡量准确度。精密度:将一定浓度的芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素混合标准溶液添加到空白血浆中,配成高、中、低3个浓度的样品,每个浓度5个平行,1 d内每个浓度测定5个样品,每个浓度进行5 d的试验。
1.3.6 工作曲线 用处理过的空白血浆提取液将芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素混合标准储备液稀释成浓度为100 μg/L、75 μg/L、50 μg/L、25 μg/L、10 μg/L和1 μg/L的样品液。用已建立的检测方法测定芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的峰面积,以芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的浓度对峰面积进行线性回归分析。
1.4 动物给药及采血 选择(20±2) kg的健康猪2头,按7.5 mg/(kg·bw)的剂量经胃管一次性给予复方芬苯达唑伊维菌素粉剂(规格:100 g含有芬苯达唑12 g、伊维菌素0.6 g,用法用量以芬苯达唑计),药物用水冲服,再以适量的水冲洗胃管。在给药后的1 h从猪的前腔静脉采血10 mL,血样采集后放入预先用肝素钠处理过的离心管,在3 000 r/min离心10 min后吸取上清,置于-20 ℃保存备用。
1.5 血浆样品检测 按照1.3.3 样品前处理方法处理采集的血浆样品,按照1.3.1 色谱及质谱条件进行血浆样品的检测。
2 结果
2.1 检测限和定量限 按照信噪比S/N≥3的最小浓度作为检测限,信噪比S/N≥10的最小浓度作为定量限的要求,得出芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的检测限分别为0.05 μg/L、0.05 μg/L、0.05 μg/L和0.01 μg/L,定量限分别为0.1 μg/L、0.1 μg/L、0.1 μg/L和0.2 μg/L。定量限的色谱图见中插彩版图1~4。

图1 血浆中芬苯达唑的定量限Fig.1 Quantitative limit of fenbendazole in plasma

图2 血浆中奥芬达唑的定量限Fig.2 Quantitative limit of oxfendazole in plasma
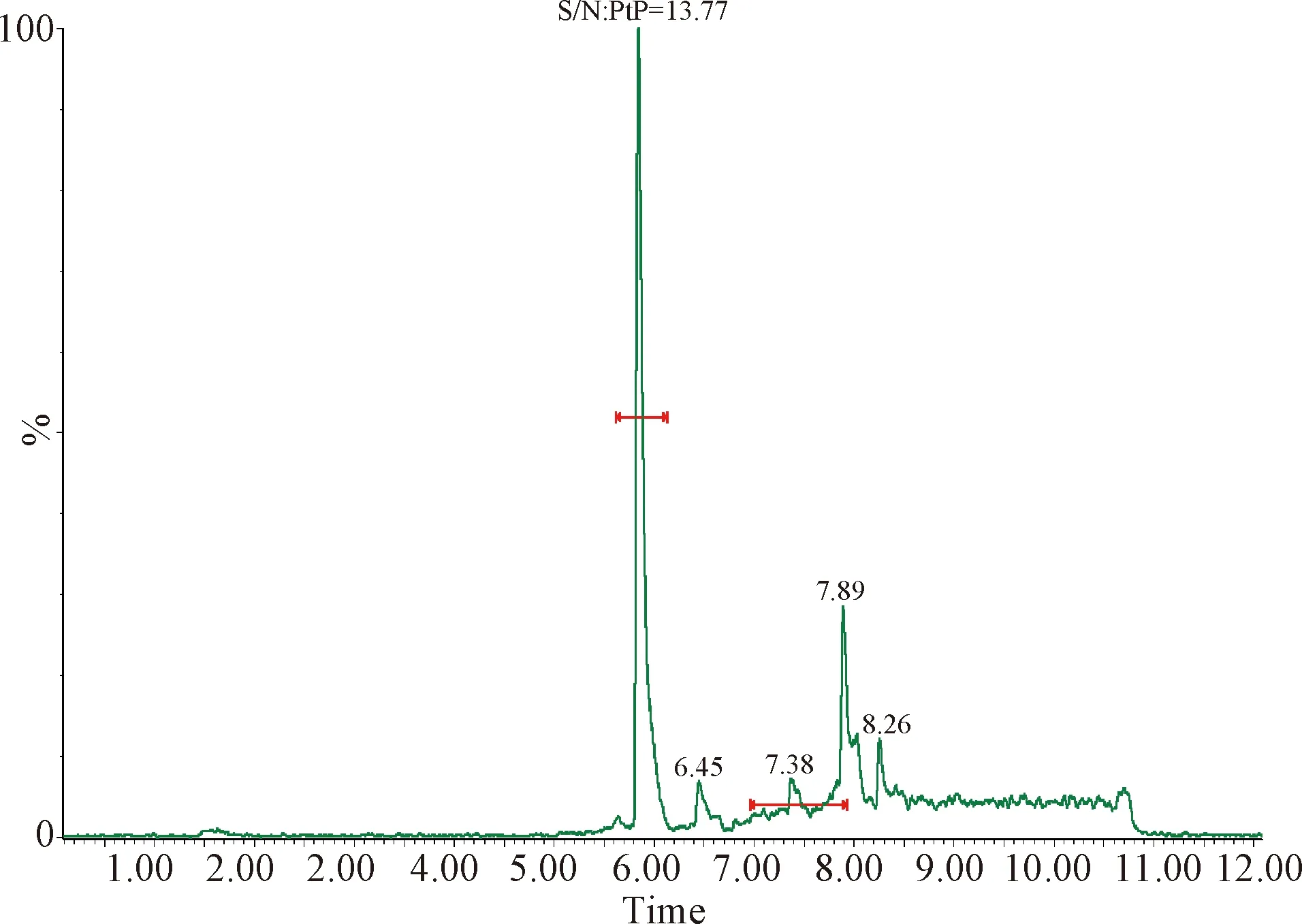
图3 血浆中芬苯达唑砜的定量限Fig.3 Quantitative limit of fenbendazole sulfone in plasma
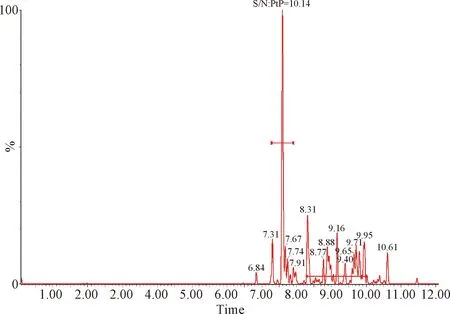
图4 血浆中伊维菌素的定量限Fig.4 Quantitative limit of lvermectin in plasma
2.2 准确度和精密度 方法的准确度是指试验中的测定值与准确值的接近程度,一般在样品检测时用样品的添加回收率来体现方法的准确度。精密度表示方法的重复性,是指同一样品的测定结果与平均值的偏离程度。方法的精密度通常用相对标准偏差表示,也称变异系数,用RSD表示,能够反映随机误差的大小。芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素在3个不同浓度的回收率范围分别为89.42%~94.33%、79.05%~92.28%、86.19%~92.29%、82.09%~88.40%。批内变异系数的范围分别为1.71%~7.11%、1.80%~12.99%、2.37%~17.90%、3.74%~13.70%。批间变异系数的范围分别为4.43%~6.27%、5.05%~10.44%、5.73%~8.84%、5.74%~9.97%。如表3。
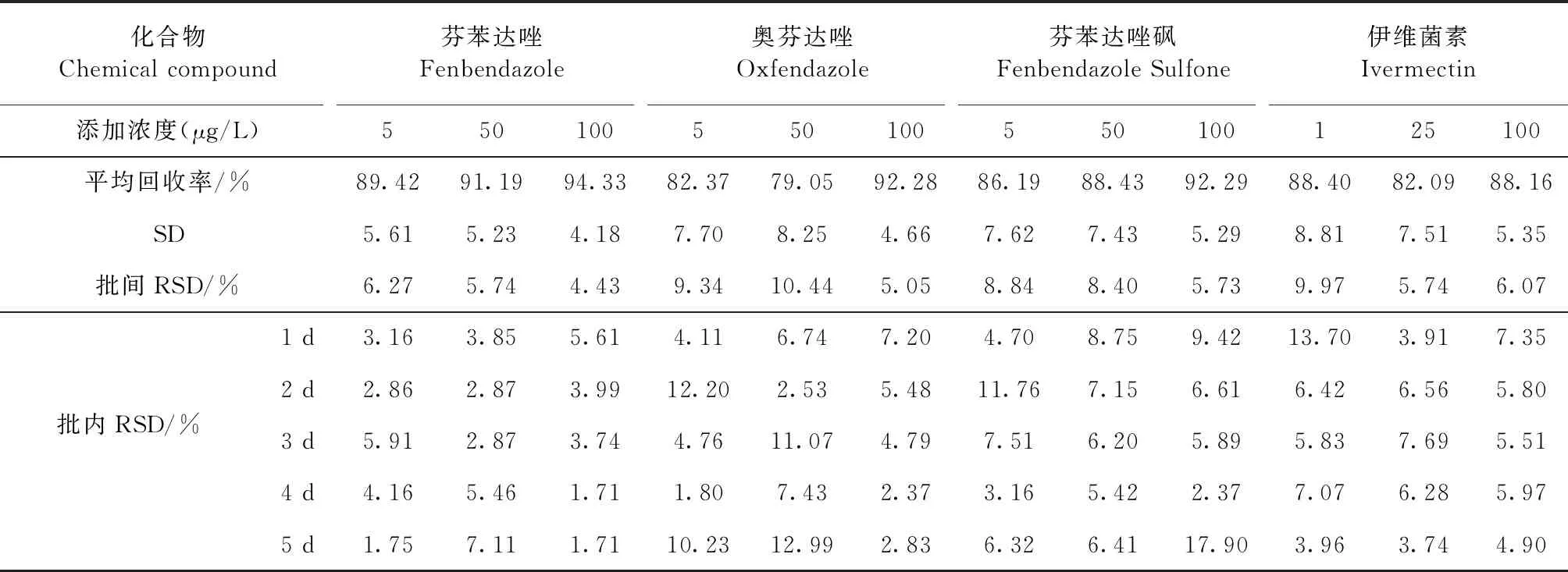
表3 血浆中芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的回收率及批间、批内变异系数Table 3 Recovery rate,inter and intra batch variation coefficient of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma
2.3 线性范围 以色谱图上的药物峰面积为纵坐标y,以药物的添加浓度为横坐标x,用加权最小二乘法进行线性回归分析后,得到的芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的线性回归方程和相关系数,如表4。

表4 血浆中芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的回归方程和相关系数rTable 4 Regression equation and correlation coefficient r of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma
2.4 血浆样品检测 给药后1 h的2头试验猪血浆的检测结果如下:1号猪芬苯达唑、奥芬达唑、芬苯达唑砜和伊维菌素的浓度分别为28.8 μg/L、37.3 μg/L、1.28 μg/L和4.04 μg/L;2号猪4种药物的浓度分别为22.7 μg/L、29.9 μg/L、1.2 μg/L和3.9 μg/L。血浆色谱图如图5~8。
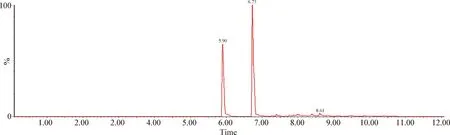
图5 1号猪血浆中芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的总离子流图Fig.5 Total ion flow diagram of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma of number 1 pig

图6 1号猪血浆中芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的色谱图Fig.6 Chromatogram of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma of number 1 pig
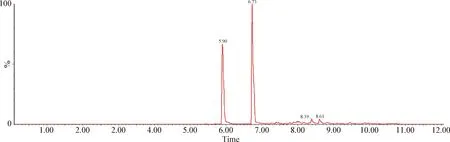
图7 2号猪血浆中芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的总离子流图Fig.7 Total ion flow diagram of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma of number 2 pig
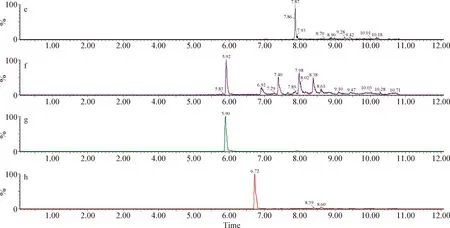
图8 2号猪血浆中芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的色谱图Fig.8 Chromatogram of fenbendazole,oxfendazole,fenbendazole sulfone and ivermectin in plasma of number 2 pig
3 讨论

3.2 提取剂的选择 选择合适的提取液来提取血浆或牛奶中的伊维菌素和芬苯达唑已经有大量的研究和报道。乙腈对糖、脂肪、蛋白质的溶解性较小,且可以沉淀血浆中的蛋白质,还可以与血浆中的水以任意比例混溶[13]。周鑫等[8]比较了用丙酮、二氯甲烷、乙腈和乙酸乙酯作为提取液提取牛奶中的伊维菌素,得出乙腈是理想的提取剂。邢丽红等[14]比较了乙腈、甲醇和乙酸乙酯作为提取液提取鲈鱼组织中的伊维菌素的提取效率,结果表明,乙腈的回收率高、乙酸乙酯和甲醇的回收率低。范盛先等[13]用乙腈提取猪牛羊可食性组织的阿苯达唑类药物,得到的回收率都在75%以上。Fletouris D J等[15]用乙腈提取牛奶中的芬苯达唑,回收率接近100%。刘洪斌[16]用含5%乙酸的乙腈提取牛奶中12种苯并咪唑类药物,平均回收率在70%以上。所以本试验也选择了提取能力强的乙腈作为提取液。结果表明,4种药物的峰形好、杂质峰较少、基质干扰程度低。
3.3 固相萃取小柱的选择 杨君宏等[17]和王亮[18]用碱性氧化铝固相萃取小柱净化牛肉组织中的伊维菌素,回收率在70%以上。本试验开始选用的是碱性氧化铝固相萃取小柱,但是净化的效果不佳,芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的回收率都只有50%左右。对固相萃取小柱进行改进,参照王梅等[19]、岳虹等[20]和Moreno L等[21]采用C18固相萃取小柱净化伊维菌素和芬苯达唑的方法,本试验中4种药物的回收率都达到了70%以上,并且药物峰与杂质峰能够分开。对净化方法进一步优化,参考周德刚等[22]对兔排泄物中的伊维菌素的提取方法,在过柱之前向乙腈提取出的溶液中加入30 mL的水,将提取液稀释成10%的乙腈溶液,然后再过固相萃取小柱,4种药物的回收率可以达到80%以上。
3.4 色谱柱的选择 李晶[23]对C8和C18色谱柱的分离效果进行了比较,C8柱比C18柱的出峰时间短,导致芬苯达唑、奥芬达唑、芬苯达唑砜难以和杂质干扰峰分离完全,故其选用了C18色谱柱。丁艳[24]测定复方芬苯达唑片中芬苯达唑和吡喹酮的含量和吴海港[4]测定猪血浆中的芬苯达唑选用的都是C18色谱柱,得到的芬苯达唑的色谱图峰形好。故本试验也选用了C18色谱柱,能够得到峰形好、出峰时间早的4种药物的色谱图。
3.5 检测限和定量限 郜进[5]测定狗血浆中芬苯达唑、奥芬达唑、芬苯达唑砜的检测限为2 μg/L、定量限为5 μg/L,本试验得到的猪血浆中芬苯达唑、奥芬达唑、芬苯达唑砜的检测限为0.05 μg/L、定量限为0.1 μg/L,检测限和定量限都更低。
3.6 回收率及标准曲线 本试验得到的芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素的回收率都在80%以上,回收率比较高。4种药物的线性方程都比较好,其相关系数r都在0.999 2以上,说明线性方程的拟合度高,满足工作曲线的要求,可以用于血浆样品中4种药物的含量测定。
3.7 血浆样品检测 在2个试验猪的血浆中均检测到了芬苯达唑、奥芬达唑、芬苯达唑砜、伊维菌素。1号猪血浆中4种药物的浓度分别为23.9 μg/L、207.3 μg/L、32.3 μg/L、15.2 μg/L;2号猪血浆中4种药物的浓度分别为28.3 μg/L、236 μg/L、42 μg/L、12.0 μg/L。说明本试验建立的检测方法,能够用于猪血浆中这4种药物的同时检测。
4 结论
本文建立了猪血浆中芬苯达唑、奥芬达唑、芬苯达唑砜和伊维菌素的UPLC-MS/MS同时检测方法。该方法测得的血浆中4种药物的定量限分别为0.1 μg/L、0.1 μg/L、0.1 μg/L和0.2 μg/L,灵敏度高;4种药物的回收率都能在80%以上,回收率高,标准曲线的相关系数r都在0.999 2以上,满足试验要求。在2只试验猪的血浆中检测到了4种药物,说明该方法可为4种药物在猪血浆中的药物代谢动力学研究提供检测方法。
