副干酪乳杆菌K56调节肠道菌群及润肠通便功能研究
2020-10-23刘伟贤郝婧宇陈希民冷候喜赵子夫洪维鍊
刘伟贤,郝婧宇,陈希民,冷候喜,王 鑫,李 东,赵 雯,赵子夫,*,洪维鍊
(1.内蒙古乳业技术研究院有限责任公司,内蒙古呼和浩特010110;2.北京市营养源研究所,北京 100069;3.内蒙古伊利实业集团股份有限公司,内蒙古呼和浩特 010110)
副干酪乳杆菌是一种革兰氏阳性异型发酵乳酸菌,是一种兼性厌氧、不运动、无芽孢的杆菌或长杆菌,是乳杆菌属的重要成员,广泛存在于人类口腔、肠道、发酵乳制品(尤其是奶酪)和植物原料发酵物(泡菜、酒和饲料)中[1]。在功能研究中,副干酪乳杆菌具有乳杆菌属共性作用,如摄入副干酪乳杆菌代谢产物如有机酸、细菌素和苯乳酸[2-3]等,能够有效的抑制致病菌和腐败菌的生长;调节细胞因子的分泌,促炎细胞因子活性降低,从而降低肠易激综合征免疫激活的作用[4-5]。同时,副干酪乳杆菌通过胞外酶的作用分解蛋白产生小分子肽,在降血压、抗肿瘤、抗氧化、降低胆固醇[6-9]等方面发挥着重要作用。副干酪乳杆菌通过发酵过程,不断影响食品的品质和风味,产生有益物质,如抗氧化肽[10],提高多酚和抗氧化活性,减少生物胺[11],抑制黄曲霉毒素[12]等,主要用于干酪和酸奶,在肉制品的应用研究中也有少量报道。
近几年,国内外开展多项副干酪乳杆菌作用研究,主要集中于调节肠道菌群及缓解便秘[13-19],其他功效如副干酪乳杆菌NTU101乙醇提取物可抵抗牙周炎[20],PS23延缓衰老小鼠认知下降[21],CNCMI-4034调节沙门氏菌诱导的炎症作用[22]等已有相关报导。目前,副干酪乳杆菌部分菌株联合其他益生菌在临床中已有使用[23-28],在食品中的应用主要集中于功能功能乳品的添加[29-30]。
副干酪乳杆菌在消化系统中定植,对肠道健康产生直接影响,进而对机体健康产生影响,因此菌株对肠道的作用为其首要研究内容。本研究以分离鉴定副干酪乳杆菌菌株K56为研究对象,参考保健食品功能评价程序和检验方法进行实验,通过小肠推进实验、排便实验及肠道菌群增殖实验对副干酪乳杆菌K56菌株的通便效果和肠道健康调节效果进行研究,为后续的深入研究和食品中的添加提供基础数据。
1 材料和方法
1.1 材料与仪器
副干酪乳杆菌K56菌株冻干粉(实验室检测菌株规格为1.5×1011CFU/g) 内蒙古乳业技术研究院有限责任公司;伊红美蓝琼脂、叠氮钠-结晶紫-七叶苷琼脂、BBL琼脂、Lbs琼脂、TSC琼脂 北京陆桥技术股份有限公司;成年Balb-c小鼠 280只,体重(22.0±2.0) g,北京华阜康实验动物技术有限公司(实验动物生产许可证:SCXK(京)2014-0004),实验动物屏障环境饲养(饲养许可证号:SYXK(京)2014-0047)。
SW-CJ-1FD超净工作台 苏州安泰空气技术有限公司;XS1003S型电子天平 瑞典Mettler Toledo公司;DIGITAL S菌落计数仪 杭州迅数科技有限公司;HH.CP-TW(80L)二氧化碳恒温培养箱 上海申贤恒温设备厂。
1.2 实验方法
1.2.1 混悬液制备 蒸馏水灭菌,称适量副干酪乳杆菌K56冻干菌粉溶于100 mL灭菌蒸馏水制备成溶液,十倍梯度依次稀释为5个剂量混悬液,配制为0.00433、0.0433、0.433、4.33、43.33 mg/100 mL溶液。
1.2.2 剂量设置 设置0.000867、0.00867、0.0867、0.867、8.67 mg/kg作为实验极低、低、中、高、极高剂量组动物剂量,根据小鼠与人体体表面积换算分别对应人体每日摄入量为1.0×106、1.0×107、1.0×108、1.0×109、1.0×1010CFU/d,调节肠道菌群实验设置对照组,小肠运动实验和排便实验设置对照组和模型组,均以灭菌蒸馏水作为对照,剂量为20 mL/kg。
1.2.3 调节肠道菌群功能实验 参考《保健食品检验及评价技术规范》中调节肠道菌群功能检验相关方法进行设计和实验,84只Balb/c小鼠于屏障环境中适应性喂养3 d,按照体重随机分为6组,每组14只。实验期间动物自由饮水摄食,灌胃给予受试物14 d。给予受试物前及灌胃14 d后,无菌采取小鼠粪便2~3粒,分别使用BBL琼脂、Lbs琼脂、伊红美蓝琼脂、叠氮钠-结晶紫-七叶苷琼脂和TSC琼脂平板检测[20]粪便中双歧杆菌、乳杆菌、肠杆菌、肠球菌、产气荚膜梭菌检含量,结果以单位质量粪便菌落形成单位的对数值表示(lg CFU/g)。
1.2.4 小肠运动实验 参考《保健食品检验及评价技术规范》中润肠通便功能检验相关方法进行设计和实验,98只Balb/c小鼠于屏障环境中适应性喂养3 d,体重[(22.0±2.0) g],按照体重随机分为7组,每组14只,实验期间动物自由饮水摄食。灌胃干预30 d后,各组小鼠禁食不禁水16 h。模型对照组和各干预组给予0.04%(m/V)盐酸洛哌丁胺溶液,正常对照组给予蒸馏水(剂量为20 mL/kg)30 min后,各干预组小鼠灌胃含相应剂量受试物的阿拉伯胶墨汁悬液,正常对照组给予空白阿拉伯胶墨汁(剂量为20 mL/kg)。25 min后,颈椎脱臼处死动物,解剖分离动物肠道,剪取上端自幽门、下端至回盲部的肠管,轻轻将小肠拉成直线,测量肠管长度为小肠总长度,从幽门至墨汁前沿为墨汁推进长度,计算墨汁推进率:
墨汁推进率(%)=墨汁推进长度(cm)/小肠总长度(cm)×100
1.2.5 排便实验 参考《保健食品检验及评价技术规范》中润肠通便功能检验相关方法进行设计和实验,98只Balb/c小鼠于屏障环境中适应性喂养3 d,称重(22.0±2.0) g,按照体重随机分为7组,每组14只,实验期间动物自由饮水摄食。灌胃干预30 d后,各组小鼠禁食不禁水16 h。模型对照组和各干预组给予0.04%(m/V)盐酸洛哌丁胺溶液,正常对照组给予蒸馏水(剂量为20 mL/kg)30 min后,各干预组小鼠灌胃含相应剂量受试物的阿拉伯胶墨汁悬液,正常对照组给予空白阿拉伯胶墨汁(剂量为20 mL/kg)。动物单笼饲养,正常饮水进食,从灌胃阿拉伯树胶开始计时,记录每只动物首粒黑便时间、5 h内黑便数量及重量。
1.3 数据处理
采用SPSS 18.0统计软件进行方差分析,满足方差齐性要求后对干预组与对照组数据进行LSD两两比较,以P<0.05作为差异显著性判定标准。实验结果参考保健食品检验预评价技术规范[9]中排便与调节肠道菌群阳性结果判定方法执行。
2 结果与分析
2.1 K56菌株对小鼠肠道菌群的影响
图1可以看出,干预前与对照组比较,小鼠粪便双歧杆菌、乳杆菌、肠杆菌、肠球菌、产气荚膜梭菌均无显著性差异(P>0.05),说明各组小鼠肠道菌群处于相同状态。干预前后比较,对照组小鼠粪便中双歧杆菌和乳杆菌数量对数值在实验后显著增长(P<0.05);各组小鼠摄入副干酪乳杆菌K56菌株14 d后,小鼠粪便内乳杆菌、双歧杆菌、产气荚膜梭菌对数值均显著增加(P<0.05);肠杆菌和肠球菌未见显著变化(P>0.05)。干预后与对照组相比,摄入副干酪乳杆菌K56菌株30 d后,中、高、极高剂量组小鼠粪便双歧杆菌和乳杆菌数量对数值均显著升高(P<0.05);极低、低、高剂量组小鼠粪便产气荚膜梭菌在干预30 d后数量对数值显著降低(P<0.05),其他组别小鼠粪便菌群无显著性差异(P>0.05)。
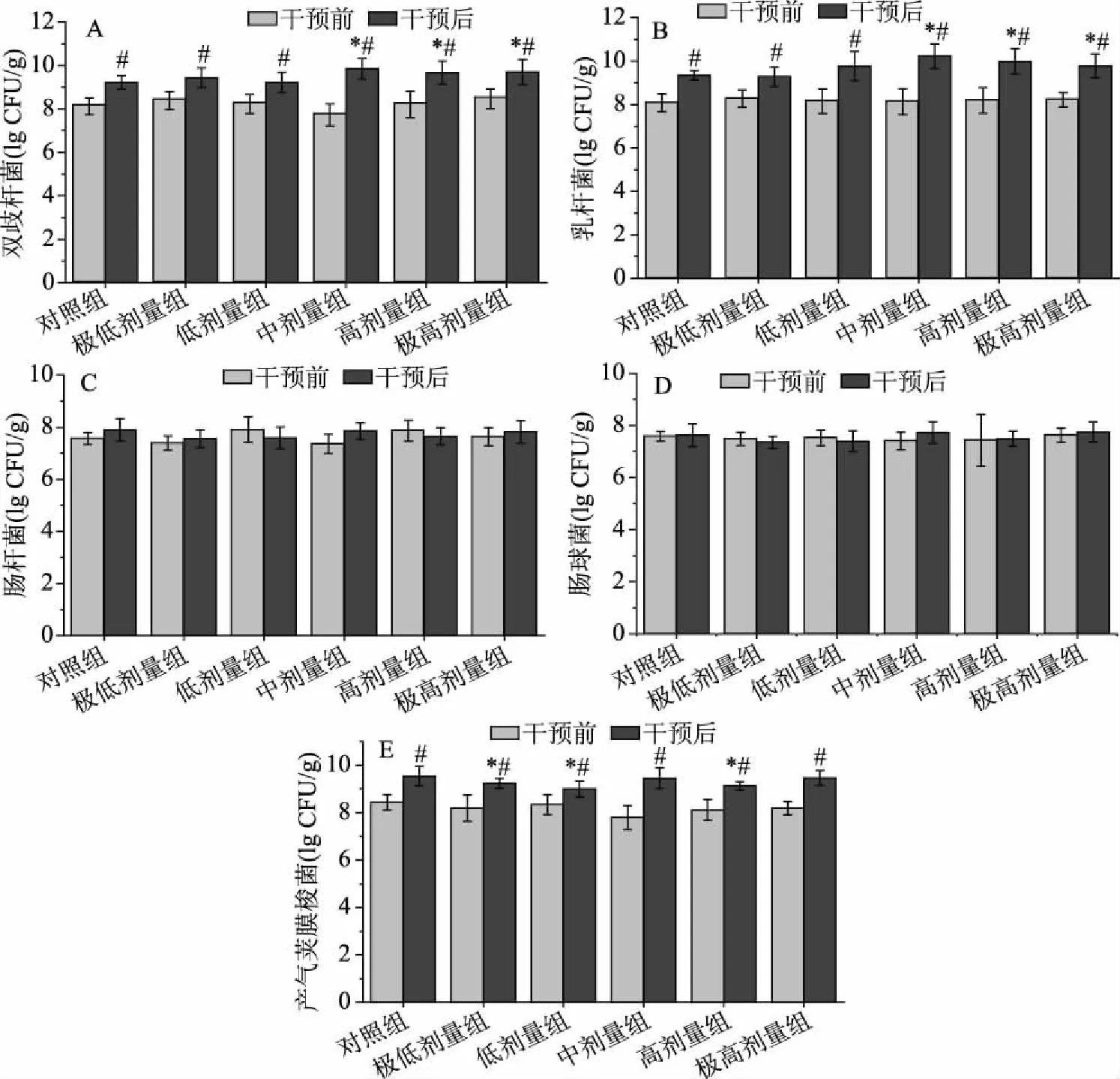
图1 摄入K56菌株前后动物肠道菌群的变化
对照组前后比较,益生菌双歧杆菌、乳杆菌及产气荚膜梭菌含量均增加,这可能跟动物周龄有关,小鼠随着周龄增长肠道容量同时增长,肠道定植菌群种类数量及肠道环境也随之产生变化,但变化总趋势为益生菌含量增加、条件致病菌减少或无变化。本研究中参考保健食品检验与评价技术规范中判定标准:双歧杆菌和/或乳杆菌明显增加,肠球菌、肠杆菌、产气荚膜梭菌减少或无明显变化或增加幅度低于双歧杆菌、乳杆菌增加的幅度,判定样品调节肠道菌群功能动物实验阳性。干预后肠道菌群变化符合阳性结果判定标准,推论副干酪乳杆菌K56具有调节肠道菌群的作用。
各剂量组组间比较发现(图1A、图1B),两种益生菌双歧杆菌和乳杆菌在粪便中的含量随着剂量增加而增加,当剂量达到中剂量即人体剂量为108CFU/d,粪便中益生菌益生菌增长幅度最大且含量最高。随着剂量继续增高,粪便中的益生菌含量未见持续增加,而是趋于平衡,说明中剂量的K56(人体剂量为108CFU/d)可达到调节肠道菌群的最高效果。
2.2 副干酪乳杆菌K56对小鼠肠道运动功能的影响
由表1可见,模型组小鼠的墨汁推进率显著低于正常对照组的墨汁推进率(P<0.05),提示本实验中肠道蠕动抑制模型建立。与模型组比较,低、高、极高剂量组小鼠肠道运动实验中的墨汁推进率显著增高(P<0.05),极低剂量组和中剂量组与模型组比较未出现统计学差异,但呈现了一定的增高趋势。
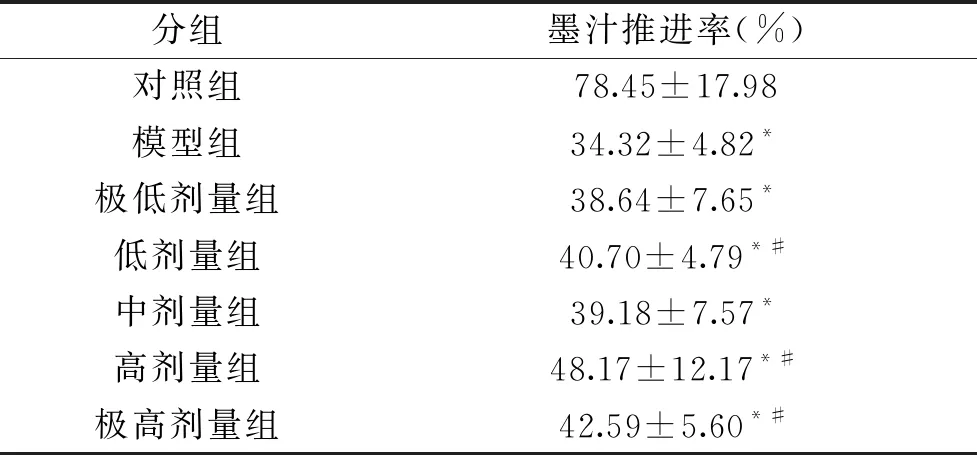
表1 副干酪乳杆菌K56对小鼠墨汁推进率的影响
既往研究表明副干酪乳杆菌可改变肠道中短链脂肪酸SCFAs含量,其中丁酸为肠道细胞的运动提供能量,促进肠道细胞的增殖,提高肠道动力,加快肠道蠕动速率[16],发挥润肠通便作用。108CFU/g副干酪乳杆菌L9每日0.2 mL可以连续干预21 d,小鼠肠道中SCFAs乙酸、丙酸、丁酸合成增加[17]。107、108、109CFU/g副干酪乳杆菌连续干预15 d,小鼠粪便中乙酸、丁酸、丙酸和戊酸的含量均增加[16]。本研究中墨汁推进率并未呈现明显的剂量效应关系,可能原因是:组间动物消化系统具有一定的差异;实验中动物依据体重给予盐酸洛哌丁胺溶液,因给予体积不同,其抑制肠道蠕动的效果也存在差别,但各组与模型组比较均呈现增高趋势,表明副干酪乳杆菌K56长期干预具有促进肠道蠕动的功能。
2.3 副干酪乳杆菌K56对小鼠排便功能的影响
图2可见,模型组小鼠首粒黑便时间与正常对照组比较显著延长(P<0.05),黑便粒数和黑便重量较正常对照组显著降低(P<0.05),说明小鼠肠蠕动抑制模型建立。与模型组比较,副干酪乳杆菌K56菌株对小鼠首粒黑便时间无显著影响(P<0.05),低、中剂量组小鼠首粒黑便时间具有缩短趋势,较模型组分别缩短了10.15%和11.22%(见图2A)。中剂量组和高剂量组小鼠黑便粒数和黑便重量显著增加(P<0.05),其中黑便粒数分别增加44.42%和56.22%(见图2B),黑便重量分别增加44.76%和63.81%(见图2C)。
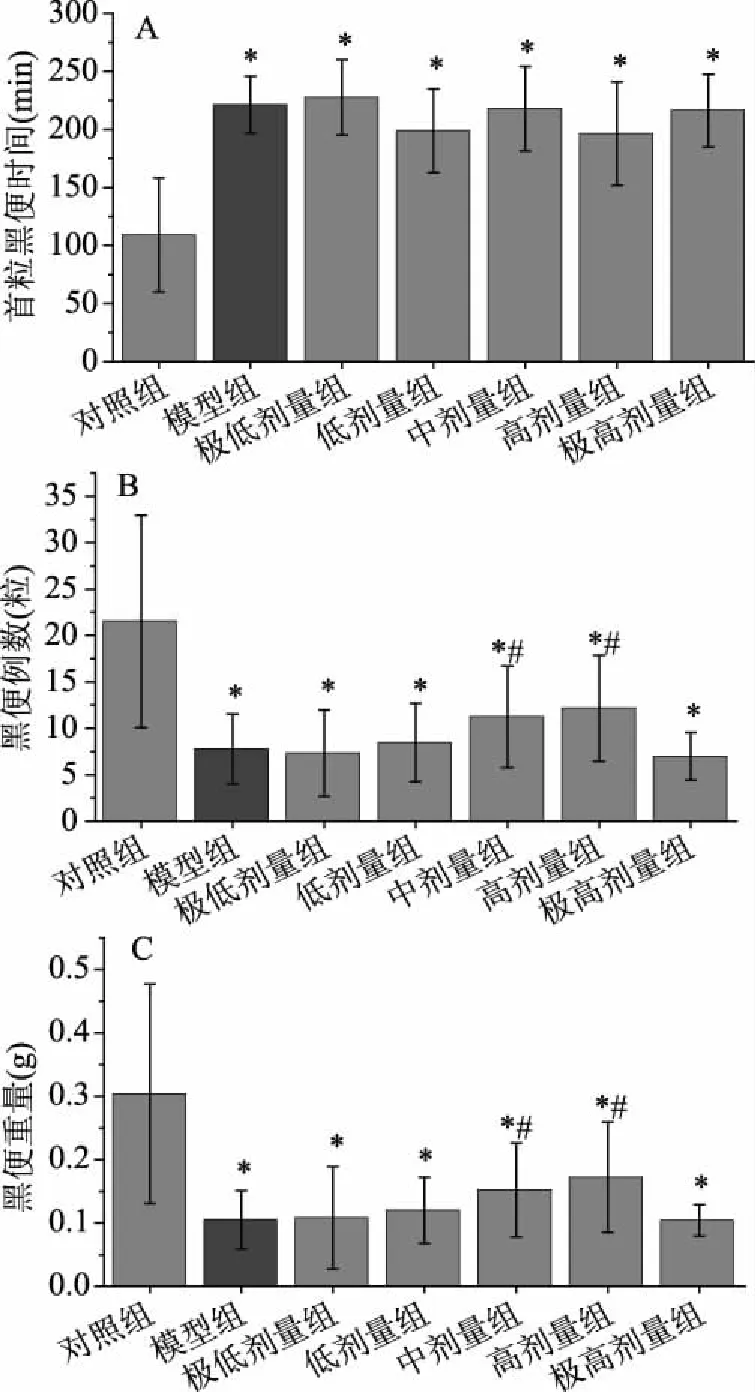
图2 副干酪乳杆菌K56对小鼠排便功能的影响
保健食品检验与评价技术规范中规定,黑便粒数或黑便重量一项结果阳性,同时小肠运动实验和排便时间一项结果阳性,可判定该样品通便功能动物实验结果阳性。本研究中中、高剂量组排便粒数与排便重量结果阳性,高、极高剂量组小肠运动实验结果阳性,可推论副干酪乳杆菌K56人体剂量达到高剂量即人体剂量为109CFU/d时,可产生促进肠道蠕动改善便秘的功效。这与既往研究中4×108CFU/d热灭活副干酪乳杆菌Lc19[17]可显著增加便秘小鼠排便能力,107CFU/d副干酪乳杆菌N1115[18]可显著增加小鼠排便量及粪便含水量的有效剂量相近。
本项实验中并未出现剂量效应关系,但实验在中剂量时开始出现阳性结果,说明随着剂量增加,开始逐渐出现便秘改善的效果,且在高剂量组时可判定副干酪乳杆菌具有改善便秘的功效。当达到极高剂量时,改善便秘的效果并不显著,这可能与造模程度及2.1中肠道菌群并未随剂量增加而增加有关联。
3 结论
本研究中副干酪乳杆菌K56的摄入促进了小鼠肠道中双歧杆菌和乳杆菌的增殖,同时具有促进小鼠排便的作用,可推测摄入副干酪乳杆菌K56对于改善肠道微生态,促进肠道健康具有积极的作用。参考保健食品检验与评价技术规范中调节肠道菌群和通便功能评价方法中的阳性结果的判定标准,可认为副干酪乳杆菌K56具有调节肠道菌群功能和通便功能。以人体每日摄入量作为参照进行研究,结果未呈现出明显的剂量-效应关系,但0.0867、0.867、8.67 mg/kg(108、109和1010CFU/d人体剂量)均可以显著增加肠道中益生菌的含量,因此推断副干酪乳杆菌K56调节肠道菌群动物实验最适剂量为0.0867 mg/kg(108CFU/d人体剂量)。0.867 mg/kg(109CFU/d人体剂量)可以显著(P<0.05)促进肠道蠕动,但在本试验中以极高剂量(1010CFU/d人体剂量)干预小鼠,肠道菌群虽发生变化,通便实验未见显著效果,需要做进一步验证。副干酪乳杆菌K56属于乳杆菌,后期将对其功效及安全性进行系统研究,为其在食品中及更广泛的应用提供科学支持。
