畜禽肉中金黄色葡萄球菌活菌可视化LAMP检测方法的研究
2020-10-23董华夏戴小芳
陈 琼,董华夏,戴小芳,刘 萍,晏 涛,郦 娟
(武汉食品化妆品检验所,湖北武汉 430012)
我国是世界上第一大的畜禽肉消费国[1],畜禽肉中的致病菌污染严重威胁着我国食品安全[2-3],其中,金黄色葡萄球菌(Staphylococcusaureus)已成为生鲜畜禽肉中食源性致病菌的重大隐患[4-5]。
肉类食物因含有丰富的营养成分,可以满足金黄色葡萄球菌的生长需求,使其产生肠毒素,这也是金黄色葡萄球菌引起食物中毒的主要原因[6]。金黄色葡萄球菌的检验一般按国标GB 4789.10-2016[7]进行传统微生物检验,但是传统微生物检验由于检验时间长,操作繁琐,在实际操作中存在一定的限制[8]。现代分子生物学聚合酶链式反应(polymerase chain reaction,PCR)技术由其操作简单、快速,被广泛的应用于食品安全检测[9-10]。由于Bst DNA 聚合酶的使用使环介导恒温扩增技术(loop-mediated isothermal amplification,LAMP)实现了在恒温条件(60~65 ℃)下的快速扩增,并在1 h内完成检验且无需复杂的仪器设备[11-12]。当前,基于LAMP法的金黄色葡萄球菌的快速检测方法研究已成为热门[13-14]。但是,由于PCR技术无法区分死菌和活菌,从而使反应结果容易出现假阳性[15],经查阅文献发现,叠氮溴化丙啶(propidium monoazide,PMA)在一定光照条件下可以与死菌DNA结合且不影响活菌DNA的扩增[16-17],因此在样品处理阶段添加一步PMA处理可有效抑制死菌的扩增,提高结果准确率[18-19]。同时在LAMP反应中添加荧光指示剂羟基萘酚蓝(hydroxynaphthol blue,HNB),可使反应结果直接通过颜色来判断[20-22]。
本研究建立的PMA-HNB-LAMP联用技术可成功应用于畜禽肉中金黄色葡萄球菌活菌的快速检测,实现了检验技术的高效快速准确,具有一定的推广价值。
1 材料与方法
1.1 材料与仪器
火腿肠(3份)、市售冷冻畜禽肉产品(共50份,猪肉10份、牛肉8份、羊肉7份、鸡肉10份、鸭肉8份、鹅肉7份);实验所用标准菌株及其他菌株,见表1 均购于中国工业微生物菌种保藏管理中心或美国典型菌种保藏中心等;样品分离菌株,见表2 为本实验室日常检测分离获得;7.5%氯化钠肉汤、Baird-Parker琼脂、血琼脂平板、脑心浸出液肉汤(BHI) 北京陆桥技术股份有限公司;革兰氏阳性细菌鉴定卡、革兰氏阴性细菌鉴定卡 生物梅里埃美国股份有限公司;TIANGEN细菌基因组DNA提取试剂盒(离心柱型)、DEAOU细菌基因组DNA快速提取试剂盒;金黄色葡萄球菌快速检测试剂盒 广东环凯微生物科技有限公司。
表1 实验所用标准菌株

表2 样品分离菌株
X-30冷冻离心机 美国贝克曼库尔特公司;PL601-L电子天平 梅特勒-托利多仪器(上海)有限公司;HH.S21-8-S数显电热恒温水浴锅 上海新苗医疗器械制造有限公司;CFX96 TOUCH荧光定量PCR仪 美国伯乐公司;VITEK2 compact system全自动生化鉴定系统 美国Biomerieux公司。
1.2 实验方法
1.2.1 金黄色葡萄球菌可视化HNB-LAMP检测方法的建立
1.2.1.1 DNA提取 标准菌株及分离菌株DNA提取:使用TIANGEN细菌基因组DNA提取试剂盒(离心柱型)按说明书方法提取细菌DNA,-20 ℃保存备用。
检测样品增菌液DNA提取:检测样品按照GB 4789.10-2016[7]进行增菌培养,使用DEAOU细菌基因组DNA快速提取试剂盒按说明书方法提取细菌DNA,-20 ℃保存备用。
1.2.1.2 LAMP扩增体系的建立 参照SN/T 2754.1-2011《出口食品中致病菌环介导恒温扩增(LAMP)检测方法 第1部分:金黄色葡萄球菌》设计引物和反应体系[23],反应体系见表3。反应条件设置为:63 ℃反应45 min。
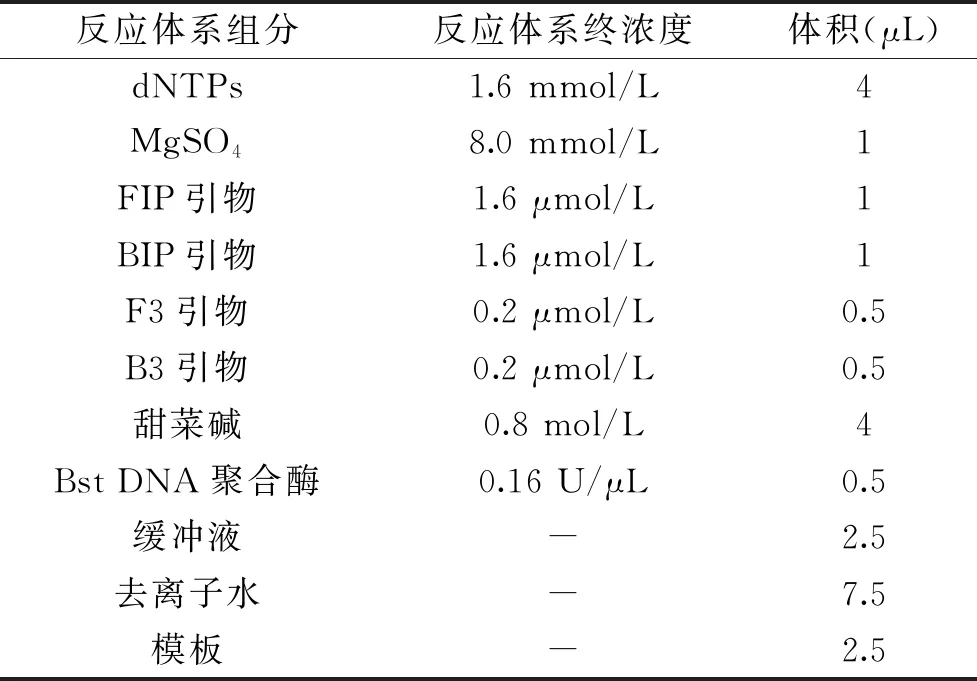
表3 金黄色葡萄球菌LAMP扩增体系
1.2.1.3 HNB浓度的优化实验 制备浓度为106CFU/mL金黄色葡萄球菌活菌菌悬液,提取DNA。在建立的反应体系中加入终浓度为240、210、180、150、120、90、60、30 μmol/L的羟基萘酚蓝,通过肉眼观察反应结果。
1.2.2 HNB-LAMP法的特异性和灵敏度分析
1.2.2.1 灵敏度分析 标准菌株灵敏度分析:将金黄色葡萄球菌菌株接种到BHI增菌液中,(36±1) ℃培养12 h,用生理盐水进行梯度稀释,得到浓度为10~106CFU/mL的活菌菌悬液,每个稀释度分别吸取1 mL以0.3、0.3、0.4 mL接种量分别接种到三块Baird-Parker平板进行计数[7]。同时,按照1.2.1.1提取DNA,并按前文所建立的金黄色葡萄球菌可视化HNB-LAMP反应体系进行检测,进行灵敏度分析。
基质灵敏度分析:取火腿肠25 g(按照GB 4789.10-2016[7]检测为未污染目标菌样品)加入到225 mL无菌生理盐水中,均质。分别取1 mL梯度稀释纯菌液加入到9 mL样品匀浆里,混匀,同时进行计数以确定实际浓度。得到浓度为10~108CFU/mL的样品匀液,抽提DNA作为模板,按照前文建立的金黄色葡萄球菌可视化HNB-LAMP反应体系,进行灵敏度分析。
1.2.2.2 特异性分析 将表1和表2的菌株进行培养,按1.2.1提取各菌株的DNA,按照前文建立的金黄色葡萄球菌可视化HNB-LAMP反应体系,进行特异性分析。
1.2.3 HNB-LAMP法与其他检测方法的比较 选取以钙黄绿素-LAMP为检验原理的某金黄色葡萄球菌检测试剂盒,比较其与本研究确定的HNB-LAMP法的标准菌株灵敏度和基质灵敏度。
1.2.4 HNB-LAMP法检测实际样品 随机选取15份冷冻畜肉和15份冷冻禽肉,在45 ℃以下不超过15 min解冻[7],分别称取25 g加入盛有225 mL 7.5% 氯化钠肉汤的无菌均质袋中,均质1~2 min,于(36±1) ℃培养18~24 h。将培养后的增菌液一分为二,一组参考国标法GB 4789.10-2016[7]进行定性检测,一组经HNB-LAMP法检测,比较两组最终的检测结果。
1.2.5 PMA处理的优化
1.2.5.1 不抑制活菌扩增的最高PMA浓度 吸取平板计数定量为104~107CFU/mL的菌悬液0.5 mL,加入不同量的PMA工作液,充分混匀,室温避光孵育5 min,卤素灯下曝光15 min[24],按1.2.1.1提取DNA进行qPCR反应。
1.2.5.2 完全抑制死菌扩增的最低PMA浓度 选择平板计数定量为105~106CFU/mL的菌悬液,100 ℃煮沸10 min[17],吸取1 mL菌液以0.3、0.3、0.4 mL接种量分别接种三块Baird-Parker平板,(36±1) ℃培养24~48 h,以确认金黄色葡萄球菌被完全灭活。吸取0.5 mL死菌菌悬液,加入不同量的PMA工作液,充分混匀,室温避光孵育5 min,卤素灯下曝光15 min,按1.2.1.1提取DNA进行qPCR反应。
1.2.6 PMA-HNB-LAMP检测人工污染金黄色葡萄球菌的阳性样品 人工污染2个火腿肠样品(按照GB 4789.10-2016[7]检测为未污染目标菌样品),污染浓度约为105CFU/mL金黄色葡萄球菌活菌和死菌。利用传统微生物方法、HNB-LAMP法和PMA-HNB-LAMP法进行检测。HNB-LAMP法和PMA-HNB-LAMP法直接取样品匀液进行后续检测,传统微生物方法将样品匀液作为7.5% NaCl肉汤增菌液进行后续检验。
1.2.7 PMA-HNB-LAMP检测实际样品 随机选取10份冷冻畜肉和10份冷冻禽肉,在45 ℃以下不超过15 min解冻[7],分别称取25 g加入盛有225 mL 7.5%氯化钠肉汤的无菌均质袋中,均质1~2 min,于(36±1) ℃培养18~24 h。将培养后的增菌液一分为二,一组参考国标法GB 4789.10-2016[7]进行定性检测,一组经HNB-LAMP法和PMA-HNB-LAMP法检测,比较三种方法的检测结果。
1.3 数据分析
本文PCR反应的原始数据均由Bio-Rad CFX Manager处理后导出,然后采用EXCEL 2010版进行线性拟合和绘图,并采用SPSS 19.0对数据进行统计分析。
2 结果与分析
2.1 金黄色葡萄球菌可视化HNB-LAMP法的建立
2.1.1 HNB浓度的选择 实验表明,向LAMP实验体系中添加HNB,可以使反应结果通过简单的颜色变化直观的反映出来,即阳性为天蓝色,阴性为紫罗兰色[21]。在本研究中发现,当添加的HNB浓度在150~240 μmol/L范围内时,阴性和阳性结果差异明显,结果见图1。为保证建立的HNB-LAMP法具有高检出率,本实验选取210 μmol/L浓度的HNB添加到LAMP反应体系中。
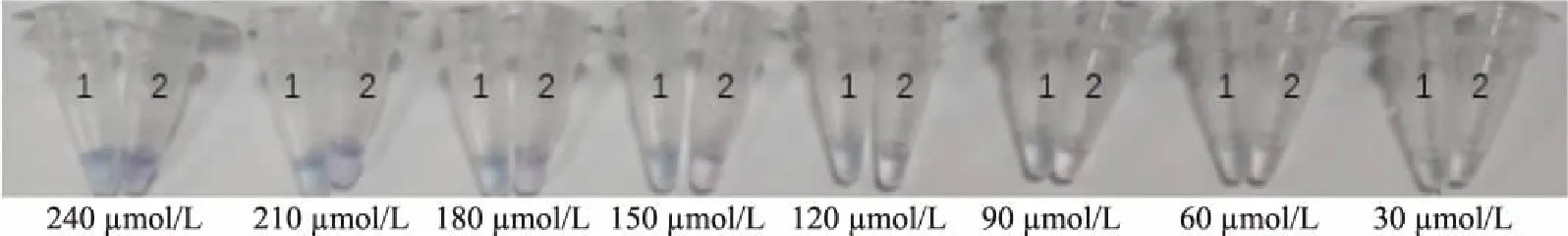
图1 LAMP反应体系中添加不同浓度的HNB的显色结果
2.1.2 HNB-LAMP法的灵敏度分析
2.1.2.1 标准菌株的灵敏度分析 金黄色葡萄球菌HNB-LAMP法的灵敏度分析实验结果见表4,由表4可知,本研究建立的HNB-LAMP法的菌株灵敏度为104CFU/mL。

表4 HNB-LAMP法的标准菌株灵敏度分析结果
2.1.2.2 人工污染样品基质的灵敏度分析 用HNB-LAMP法检测人工污染金黄色葡萄球菌活菌的样品时发现当样品-菌混合液中金黄色葡萄球菌活菌的浓度为105~108CFU/mL时,反应结果呈阳性,见表5。由表5可知,建立的HNB-LAMP法的样品基质灵敏度为105CFU/mL。

表5 HNB-LAMP法的样品基质灵敏度分析结果
2.1.2.3 HNB-LAMP法与其他检测方法的灵敏度比较 挑选以钙黄绿素-LAMP法为检验原理的某金黄色葡萄球菌快速检测试剂盒,以浓度为10~106CFU/mL的金黄色葡萄球菌活菌DNA作为模板,按试剂盒说明书进行扩增反应,反应结果见表6。由表6可知,市售的某金黄色葡萄球菌检测试剂盒的标准菌株灵敏度为104CFU/mL。本研究建立的HNB-LAMP法与市售的成品试剂盒的标准菌株灵敏度相同。

表6 市售的某金黄色葡萄球菌检测试剂盒的标准菌株灵敏度分析结果
在用上述市售的金黄色葡萄球菌检测试剂盒检测人工污染金黄色葡萄球菌的样品基质实验中,可以发现当金黄色葡萄球菌的浓度为106~108CFU/mL时,反应结果呈阳性,结果见表7。由表7可知,市售的某金黄色葡萄球菌检测试剂盒的样品基质灵敏度为106CFU/mL。本研究建立的HNB-LAMP法的样品基质灵敏度略优于市售的成品试剂盒的样品基质灵敏度。

表7 市售的某金黄色葡萄球菌检测试剂盒的样品基质灵敏度分析结果
2.1.3 HNB-LAMP法的特异性分析 利用建立的金黄色葡萄球菌可视化HNB-LAMP法,按照1.2.2.2进行特异性分析,结果见表8。由表8可知,建立的HNB-LAMP法特异性好,金黄色葡萄球菌均被检出,其他非金黄色葡萄球菌均未被检出。

表8 HNB-LAMP法的特异性分析结果
2.1.4 HNB-LAMP法检测实际样品 利用传统微生物检法GB 4789.10-2016[7]检测30份实际冷冻畜禽肉样品时,发现3个样品结果呈阳性;用建立的HNB-LAMP法检测实际样品时,有12个样品结果呈阳性,其中包括传统微生物法检测出的3个阳性样品。这表明,HNB-LAMP法虽然大大缩短了检测时间,但同时由于其无法区分死菌和活菌而出现了假阳性结果。
2.2.1 不抑制活菌扩增的最高PMA浓度 用不同浓度的PMA处理104~107CFU/mL的金黄色葡萄球菌活菌时,发现各浓度的金黄色葡萄球菌活菌经10 μg/mL的PMA处理后Ct值均无明显变化,结果见图2。由图2可知,不抑制活菌扩增的最高PMA浓度可以确定为10 μg/mL。
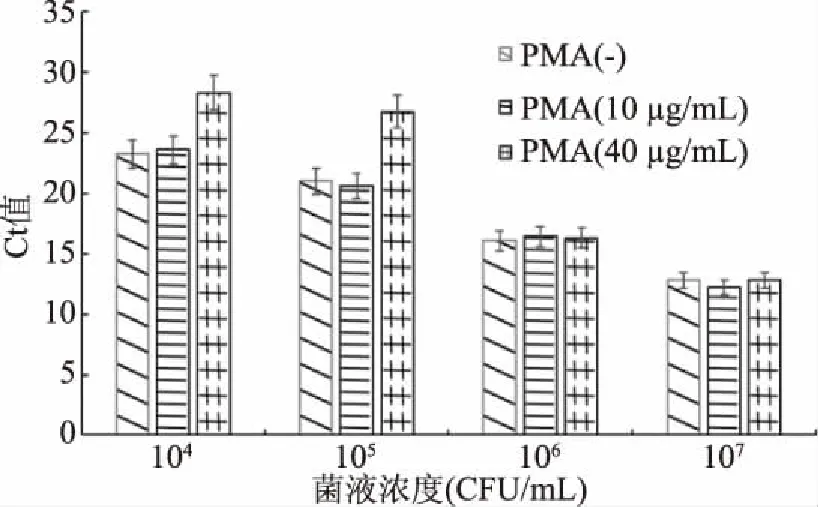
图2 不同浓度PMA处理对活菌扩增的影响结果
2.2.2 完全抑制死菌扩增的最低PMA浓度 当以不同浓度PMA处理浓度为104~107CFU/mL的金黄色葡萄球菌死菌时,PMA浓度为10 μg/mL可以完全抑制104、105CFU/mL的死菌DNA扩增,结果见图3。由图2、图3最终确定金黄葡萄球菌的PMA处理浓度为10 μg/mL,在该浓度条件下,既可以完全抑制不高于105CFU/mL的死菌DNA扩增,又不影响不低于104CFU/mL的活菌DNA扩增。
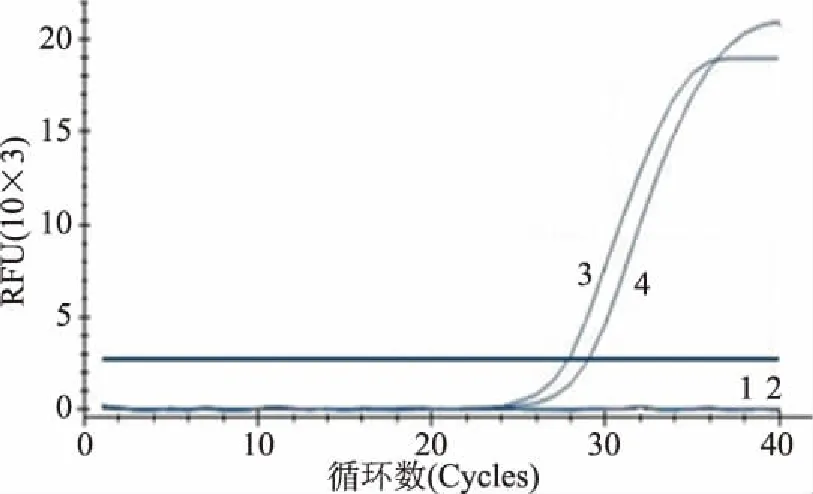
图3 10 μg/mL PMA处理不同浓度金黄色葡萄球菌死菌的DNA扩增结果
2.3 PMA-HNB-LAMP法检测人工污染金黄色葡萄球菌样品的检测结果
采用PMA-HNB-LAMP法、HNB-LAMP法、传统微生物法(GB 4789.10-2016)三种方法检测人工污染金黄色葡萄球菌的样品的检测结果如表9所示。由表9可知,本研究建立的PMA-HNB-LAMP法与传统微生物法的检测结果一致,而HNB-LAMP法在检测时由于无法区分死菌和活菌而出现了假阳性结果。
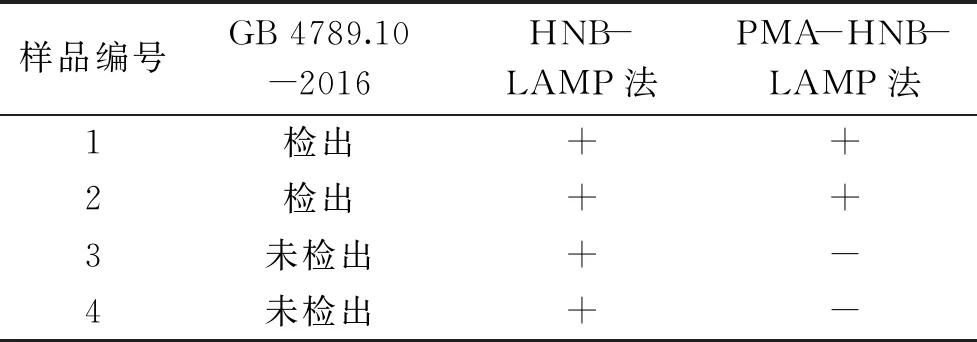
表9 采用三种方法检测人工污染金黄色葡萄球菌样品的检测结果
2.4 PMA-HNB-LAMP法检测实际样品的检测结果
10份冷冻畜肉和10份冷冻禽肉同时经国标法GB 4789.10-2016、HNB-LAMP法和PMA-HNB-LAMP法检测,检测结果如表10所示。由表10可知,20份样品经三种方法检测确认为阳性的样品个数依次为6个、5个、5个;检出率分别为30%、25%、25%。
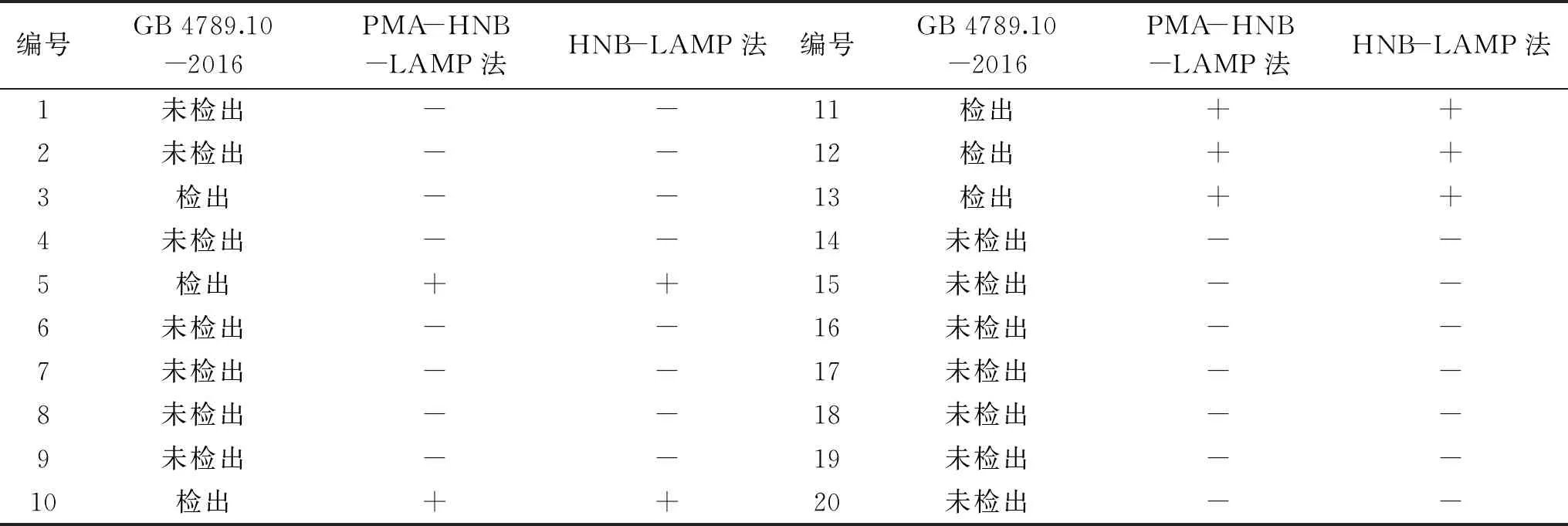
表10 采用三种方法对实际样品的检测结果
3 结论与讨论
为实现快速检测畜禽肉中的金黄色葡萄球菌活菌的污染情况,本研究建立了一套仪器设备要求简单、耗费低、操作简便、结果可视化的金黄色葡萄球菌PMA-HNB-LAMP法,该方法既解决了传统微生物法操作繁琐、检验周期长、生化鉴定复杂的问题,又在检验过程中有效的避免了可能由死菌DNA扩增造成的假阳性结果。建立的金黄色葡萄球菌PMA-HNB-LAMP检测方法特异性强,其纯菌液灵敏度为104CFU/mL,样品基质灵敏度为105CFU/mL,根据美国食品药品监督管理局(food and drug administration,FDA)和国外一些学者的研究[25-27],均将金黄色葡萄球菌的最小产毒浓度定为105CFU/g,即在该浓度下可产生1.0 μg肠毒素而引起食物中毒,本研究建立的金黄色葡萄球菌快速检测方法在现有的检出限下,可用于快速检测出含有高于最小产毒浓度金黄色葡萄球菌活菌的高风险致病样品。同时,灵敏度不高也是该法面临的实际问题,需要在今后研究中对方法进行进一步的优化改进。将建立的金黄色葡萄球菌可视化PMA-HNB-LAMP法应用于检测实际样品时,发现其阳性样品检出率略低于传统微生物法GB 4789.10-2016[7]的检出率,但是无假阴性结果的出现,推其原因可能是购买的冷冻生畜禽肉中存在某些抑制LAMP扩增的因素,具体原因及解决方法有待进一步研究。该法除了用于畜禽肉的检测外,还可以应用到其他种类的食品检测中,具有很广的应用前景。
